超声波处理对酪蛋白结构特性的影响
2015-12-16冯景丽贾峰王金水高芸芳周晓配李小伟
冯景丽 ,贾峰,王金水,高芸芳,周晓配,李小伟
(河南工业大学a.生物工程学院;b.粮油食品学院,郑州450001)
0 引言
超声波是指频率大于20 kHz的声波,在液体介质中传播时会产生“空化效应”,从而影响或改变物质的状态、性质及结构[1-2]。酪蛋白是一种含磷的酸性蛋白,分子量约为20~25 ku,空间结构由单体αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白通过αs-螺旋、β-折叠和β-转角等构成。酪蛋白在人体内不易被消化,易过敏,这限制了其在食品领域的使用。高芸芳等利用超声波处理酪蛋白研究了水解度(DH)、酶解产物中可溶性氮、氨基氮及肽氮含量的变化规律,但对超声波对酪蛋白的表面结构和空间构象影响的研究较少[3]。本研究以超声波处理对酪蛋白结构的影响为切入点,期望为制备生物活性肽,呈味肽等新产品提供新技术方法,提高和改善酪蛋白的功能特性及拓宽其应用领域。
1 实验
1.1 材料
酪蛋白(蛋白质量分数82.84%,水分11.96%,灰分2.48%)。
JY92-Ⅱ型超声波细胞粉碎机,LC1260高效液相色谱仪,Quanta200扫描电子显微镜,BT-9300H激光粒度分布仪,WQF-510傅里叶红外光谱仪。
1.2 方法
1.2.1 超声波处理酪蛋白
在室温条件下,量取100 mL去离子水置于500 mL的烧杯中,调整磁力搅拌器转速为300 r/min。然后准确称量5.0 g酪蛋白,边搅拌边缓慢加入烧杯中,待酪蛋白完全加完后继续搅拌5 min使形成5%酪蛋白悬浮液,调节至pH=8使其溶解,将酪蛋白悬浮液置于超声波细胞粉碎(25 kHz)机中,调整超声波的输出功率分别为160 W和400 W,设置超声波处理时间为1 h,未经超声波处理酪蛋白悬浮液为对照。处理之后的悬浮液直接进行粒度分布的测定。处理之后的悬浮液进行冷冻干燥的样品分别用于表面结构测定、二级结构测定和分子量分布测定。
1.2.2 蛋白表面结构测定
采用扫描电子显微镜观测酪蛋白及超声波处理的酪蛋白样品的表面结构。具体步骤如下:将微量的冷冻干燥后的样品置于样品台,经离子溅射仪真空干燥、金粉喷镀后,调节电镜加速电压为20 kV,对样品进行观测摄图。
1.2.3 蛋白的粒度分布测定
粒度分布采用激光粒度分布仪进行测定,样品为酪蛋白悬液(pH=8)及其酶解液,介质为蒸馏水,介质折射率为1.361,设置物质折射率为1.52,测定时以蒸馏水为背景,加入样品至遮光率于10%~20%后,进行信息采集,每个样品平行采集3次,取平均图谱。
1.2.4 蛋白的二级结构测定
采用傅里叶红外光谱(FTIR)测定超声波处理酪蛋白的二级结构。具体步骤如下:称取固体样品2 mg,加入200 mg溴化钾充分研磨干燥,压片,使用傅里变换叶红外光谱仪进行4 000~400 cm-1波数扫描[4]。选取波数为1 600~1 700 cm-1波谱图做傅里叶去卷积和二阶导数图谱,采用Gauss函数进行多次拟合至残差最小。
1.2.5 蛋白的分子量分布测定
采用高效体积排阻色谱(HPSEC)检测超声波处理酪蛋白的分子量分布情况。称取固体样品,溶于10%的乙腈,使样品的最终质量浓度为0.1 g/L。色谱条件如下,流动相为10%乙腈,柱子:Agilent PL aquagel-OH MIXED-H(8 μm,300× 7.5 I.D.),柱温为30 °C,流速为0.5 mL/min,进样10 μL,检测为214 nm,流动相及样品溶液均过0.45 μm纤维素酯薄膜。
1.2.6 数据处理
各实验重复3次,结果以平均值±标准偏差表示。数据在P<0.05水平上的显著性采用SPSS 13.0软件进行分析。
2 结果与分析
2.1 超声波处理对酪蛋白表面结构的影响
由图1(a)(b)可以看出,酪蛋白形成一个大块,呈层叠状,组织结构致密,中间没有明显的空隙;经160 W超声波处理1 h后的酪蛋白,结构有了较大的变化,酪蛋白呈层片状,表面平整,有较明显的“撕裂状”,且有“孔洞”出现(图1(c)(d));经400 W超声波处理1 h后的酪蛋白结构变化更加明显,表面的层片状结构变小,呈“锯齿状”,层片中间有较多的“孔洞”出现(图1(e)(f))。表明超声波处理能够有效地打破酪蛋白的胶团表面结构,使其经过层片化和“孔洞”化,逐步破碎,在相同的处理时间,随着超声波功率的增大对于酪蛋白的破碎效果逐渐明显。

图1 酪蛋白表面结构
2.2 超声波处理对酪蛋白悬液粒度分布的影响
由图2酪蛋白粒径分布可以看出,当溶液pH值为8时,未处理的酪蛋白粒径分布范围较宽,约为0.2~70.0 μm,主要的粒度在0.8~10.0 μm之间,但在10.0~70.0 μm之间的分布也有一个小高峰;经160 W和400 W超声波处理后的酪蛋白粒度的分布明显变窄,约为0.2~30.0 μm,主要的粒度在0.6~6.0 μm之间,且分布曲线呈双峰(0.7 μm和6.0 μm处)模式,经160 W超声波处理后的酪蛋白在6.0 μm处的峰稍微下陷,而在20.0 μm处的另有一峰;经400 W超声波处理后的酪蛋白双峰特征明显,而在20.0 μm处的未出现峰。表明经过超声波处理之后酪蛋白的粒度分布发生了变化,随着处理功率的增加,粒度分布更加均匀,约为0.6 μm,但也可以看出,超声波处理酪蛋白不能够是其小于0.2 μm的粒度增加,说明,如果需要更加细小的酪蛋白,超声波处理的效果可能不好。

图2 超声波处理对酪蛋白粒度分布的影响
从图2酪蛋白粒径分布累积含量图,并结合表1数据可知,160 W和400 W超声波处理1 h后,pH值为8酪蛋白悬液中粒径在0.2~70.0 μm之间的分布比对照的粒度更加细,但是160 W与400 W超声波处理1 h后的粒度分布来看,差异不大;表明超声波处理能够减小酪蛋白粒径,对比大功率和小功率超声波处理之后的粒度分布来看,大功率的超声波对酪蛋白胶团的“破碎”作用效果不明显。超声波对蛋白质粒径的影响已有报道,Gordon利用高强度超声波研究超声时间、温度、溶液浓度对乳清分离蛋白粒度分布的影响发现,适当的超声条件能够降低乳清分离蛋白的粒径[5]。Arzeni发现,超声波处理对蛋白粒度分布的作用因蛋白种类而不同,如经高强度超声处理后,乳清浓缩蛋白及大豆分离蛋白的粒径减小,而卵清蛋白则升高[1]。
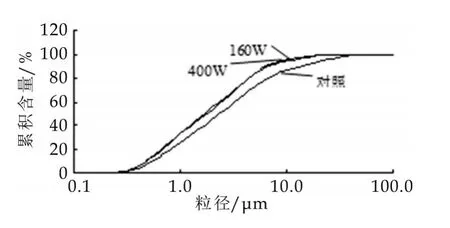
图3 超声波处理对酪蛋白粒度分布累积含量的影响

表1 超声波处理对酪蛋白粒度分布指标的影响
2.3 超声波处理对酪蛋白二级结构的影响
酪蛋白经超声波处理之后的傅里叶变换红外光谱检测结果如图4所示。经超声波处理之后与对照相比,主要在2 000 cm-1和2 400 cm-1处有明显的吸收峰和吸收谷存在。傅里叶变换红外光谱属于振动光谱,具有高通量、高信噪比、高灵敏度、样品用量少等优点,当一定频率的红外光照射被测样品时,样品中某些组分会吸收能量而发生振动能级的跃迁,不同组分的能量吸收特性不同,从而产生不同的谱峰,通过分析谱峰特点可以预测样品结构特性。但是,对于蛋白质和多肽二级结构预测主要集中在酰胺Ⅰ带(波数1 700~1 600 cm-1)、酰胺Ⅱ带(1 600~1 500 cm-1)和酰胺Ⅲ带(1 330~1 220 cm-1)上,酰胺Ⅰ带较宽,主要为酰胺C=O伸缩振动模式,酰胺Ⅱ带为酰胺C-N伸缩振动及N-H振动。对蛋白质二级结构分析和应用最为广泛的是对酰胺Ⅰ带进行去卷积、二阶导数拟合处理,且认为 1 610~1 640 cm-1为β-折叠,1 640~1 650 cm-1为无规则卷曲,1 650~1 658 cm-1为α-螺旋,1660~1700 cm-1为β-转角。
对未经超声波和超声波处理后的酪蛋白的红外光谱酰胺I带(1 600~1 700 cm-1)进行去卷积、二阶导数拟合处理结果如图5所示,对照酪蛋白得到6个二级结构子峰(图5a),经过超声波处理的照酪蛋白分别得到7个二级结构子峰(图5b和图5c)。分别把对照和处理的二级结构进行合并结果如表2。由表2可知:酪蛋白二级结构含量分别为α-螺旋22.3%、β-折叠32.26%、β-转角25.19%、无规则卷曲18.47%。酪蛋白经160 W与400 W超声波处理1 h后,各种二级结构含量发生不同程度的变化,α-螺旋、β-折叠含量均减少,β-转角含量明显增大,经160 W和400 W超声处理后,酪蛋白中α-螺旋含量由原来的22.53%分别下降为10.73%和13.29%,β-转角含量由原来的25.19%分别增大为52.04%和49.39%。Raza研究的结果表明,酪蛋白酰胺Ⅰ带拟合α-螺旋25%,β-折叠30%,β-转角36%,无规则卷曲9%。与本检测酪蛋白中的α-螺旋和β-折叠比例相近,而β-转角和无规则卷曲相差较大,可能与材料的纯度差异有关[6]。
另外,α-螺旋与β-折叠含量比值可以在一定程度上表征蛋白质内部结构的柔韧性,α-螺旋/β-折叠数值越小,蛋白柔韧性越大。表2显示,酪蛋白经超声波处理后,α-螺旋/β-折叠由0.70下降到0.46,表明经超声波处理后酪蛋白柔韧性增大。蛋白质二级结构的构成会对其高级结构有一定影响,酪蛋白扫描电镜结果显示为超声波处理后酪蛋白结构疏松,经160 W超声处理后的酪蛋白呈现“撕裂状”且表面有孔状结构,经400 W超声处理后的酪蛋白则呈现“锯齿状”。
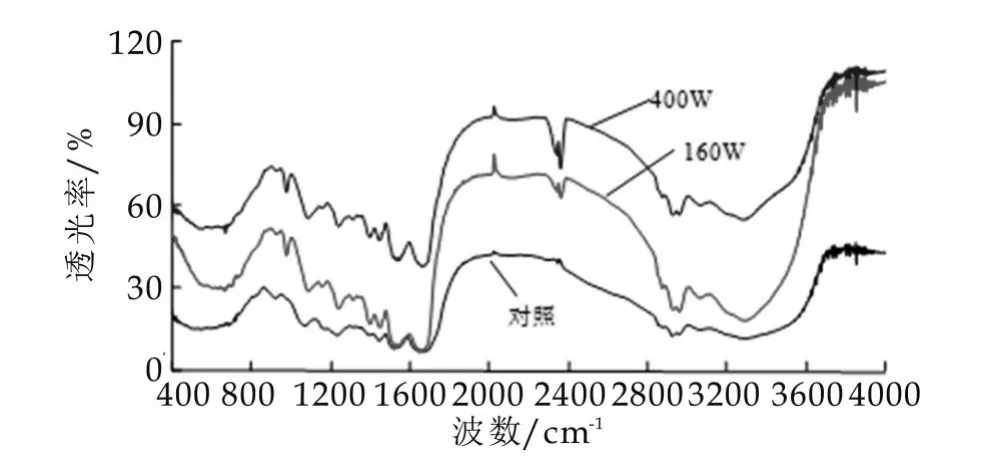
图4 超声波处理前后酪蛋白傅里叶红外光谱对比结果
再者,酪蛋白中有较高含量的脯氨酸(Pro),而Pro残基为中心的转角与β-折叠基团组成的刚性区域受到一些弹性基团(α-螺旋)的束缚,这些弹性基团使得酪蛋白胶团处于具有一种张力与压力流变平衡的状态,因而使得酪蛋白表现为球形结构;超声波处理使得得以维系酪蛋白稳定球形结构的弹性基团含量减少,致使酪蛋白柔韧性增加,易于形成片层结构。

图5 酪蛋白的红外光谱酰胺I拟合图
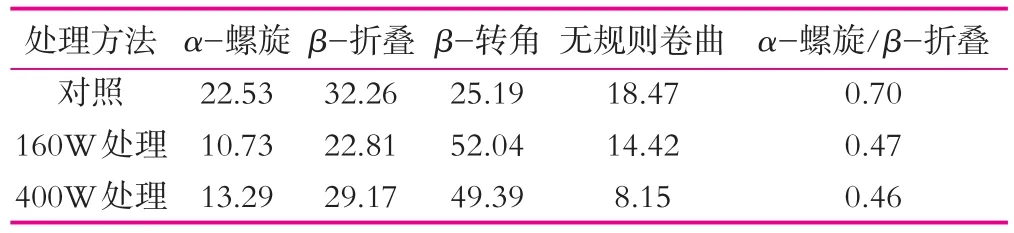
表2 超声波处理对酪蛋白二级结构的影响
张海华等研究了超声波处理对小麦面筋蛋白的影响,结果发现经超声波处理后α-螺旋含量减少,而β-折叠与β-转角含量增多[7]。另外,超声波处理时形成的“空穴作用”及伴随着温度的升高,对蛋白质二级结构的破坏作用也比较明显,容易造成二级结构间的相互转化。
2.4 超声波处理对酪蛋白分子量分布的影响
以未经超声波处理的酪蛋白为对照,分别以160 W和400 W超声波处理酪蛋白悬液1 h后冷冻干燥为固体粉末,采用HPSEC检测酪蛋白的分子量分布,结果表3所示。由表3可以看出,酪蛋白中分子量比较集中的范围为30 000~40 000 u,其次为20 000~30 000 u。相比于对照酪蛋白,经160 W和400 W超声波处理1 h后,分子量范围为30 000~40 000 u与40 000~45 000 u的多肽含量有所下降,且较小分子量范围多肽含量增加,表明超声波处理使得酪蛋白中某些大分子量多肽发生了分解。

表3 酪蛋白分子量分布 %
3 结论
采用超声波处理蛋白酶能够对使酪蛋白的表面致密的结构发生层片化和孔洞化变化,在较大的酪蛋白颗粒的粒度变小与分子量分布的检测结果相一致,酪蛋白的二级结构α-螺旋、β-折叠和无规则卷曲减少,即减少分子中的弹性结构,而β-转角的含量增加;同时,超声波作用削弱了酪蛋白分子间的作用力,使得酪蛋白原先致密的结构变得相对松散,增加了比表面积,有利于后续的酶解和处理。
[1]ARZENI C,MARTINEZ K,ZEMA P,et al.Comparative study of high intensity ultrasound effects on food proteins functionality[J].Journal of Food Engineering,2012,108:463-472.
[2]BONIZZI I,BUFONI J N,FELIGINI M.Quantification of bovine casein fractions by direct chromatographic analysis of milk.Approaching the application to a real production context[J].Journal of Chromatography A,2009,1216:165-168.
[3]高芸芳,王金水,苏银杰.超声波处理对酪蛋白-胰蛋白酶体系酶解特性的影响[J].河南工业大学学报:自然科学版,2012,33(5):11-14.
[4]WANG C,JIANG L Z,WEI D X.Effect of secondary structure determined by FTIR spectra on surface hydrophobicity of soybean protein isolate[J].Procedia Engineering,2011(15):4819-4827.
[5]LAURA G,Ana M,PILOSOF R.Application of High-Intensity Ultrasounds to Control the Size of Whey Proteins Particles[J].Food Biophysics,2010,(5):203-210.
[6]RAZA H,CLAIRE G,JQEL S.From high milk protein powders to the rehydrated dispersions in variable ionic environments:A review[J].Journal of Food Engineering,2012(113):486-503.
[7]张海华,朱科学,周惠明.超声波对小麦面筋蛋白结构的影响[J].中国农业科学,2010,43(22):4687-4693.
