益生菌复合微生态制剂冻干保护剂的优化及活菌变化研究
2015-12-16迟涛田木张欣宇钟姝凝张铁华王玉堂刘鹏
迟涛,田木,张欣宇,钟姝凝,张铁华,王玉堂,刘鹏
(1.国家乳业工程技术中心黑龙江省乳品工业技术开发中心,哈尔滨150028;2.吉林大学食品科学与工程系,长春130062;3.东北农业大学食品学院,哈尔滨150030)
0 引言
随着抗生素的长期使用,其表现出的弊端日益明显,如引起耐药性、药物残留等缺点[1]。微生态制剂又可称为促生素、益生素、活菌制剂等[2],以微生态学理论为指导,采用单一菌种培养或多菌种复合培养,经过发酵技术制备而成[3,4]。现在市场上常见的微生态制剂为单菌制剂,对复合微生态制剂的研究还比较少。微生态制剂常用的保护剂有很多种,按保护剂的分子量大小可以分为高分子保护剂和低分子保护剂[5-6]。本实验选取乳酸菌、酵母菌及枯草芽孢杆菌为实验菌株,其中乳酸菌、酵母菌来源于已证明对人类具有很好生理功能的“开菲尔粒”复合菌相,通过多菌株复合培养制备一种高活力的益生菌复合微生态制剂。
1 实验
1.1 材料与仪器
开菲尔粒,枯草芽孢杆菌。全自动真空冷冻干燥机,超低温冰箱,离心机,生化培养箱,生物安全柜。
1.2 方法
1.2.1 开菲尔粒中乳酸菌、酵母菌的分离纯化及活化
1.2.1.1 乳酸菌、酵母菌的分离纯化
在小试管中装少量灭菌生理盐水,取一小块开菲尔粒放入小试管中并用玻璃棒捣碎,取少量试管内样品分别涂到MRS固体琼脂培养基和麦芽汁-琼脂培养基上,将培养基分别置于37℃和培养箱中分别恒温培养48~72 h和12~72 h。挑取经显微镜检测符合乳酸菌标准形态的菌落划线接种到MRS固体琼脂培养基上,在37℃培养箱中培养18~24 h,重复做几次得到纯化乳酸菌菌株;符合酵母菌标准形态的菌落划线接种到麦芽汁-琼脂培养基上,在28℃培养箱中培养12~72 h,重复做几次得到纯化酵母菌菌株,得到的乳酸菌菌株和酵母菌菌株再分别接种到人工模拟胃液及肠液环境进行筛选,筛出耐酸及胆盐的优势菌株[7],并分别接种于MRS半固体培养基和麦芽汁液体培养基中,分别放到37℃和28℃培养箱中恒温培养18~24 h。放4℃冰箱中保存,供实验用[8]。
1.2.1.2 乳酸菌、酵母菌活化
按脱脂乳粉∶蒸馏水=1∶10的培养基中接种对酸及胆盐耐受性好的乳酸菌、酵母菌,在23℃恒温生化培养箱中培养18~20 h。放4℃冰箱中保存,供实验用。
1.2.1.3 枯草芽孢杆菌活化
配置活化培养基(均为质量浓度):葡萄糖12.11 g/L,牛肉膏23.31 g/L,磷酸二氢钾2.33 g/L,调节pH值为7.5,灭菌后接种经镜检符合枯草芽孢杆菌的标准形态的,生长状态良好的枯草芽孢杆菌,在37℃恒温生化培养箱中摇床震荡培养18 h。放4℃冰箱中保存,供实验用。
1.2.2 菌种复配
菌种复合培养的培养基(均为质量浓度,g/L):浓缩乳清蛋白粉 20,酵母粉7.64,乳清粉26.6,脱脂乳40,葡萄糖 13.4,碳酸钙 6.2,硫酸镁0.2,硫酸锰0.03;调节pH值为7.0,将活化后的乳酸菌、酵母菌与枯草芽孢杆菌按1∶1∶1比例接种到此培养基中,在32℃恒温生化培养箱中培养18 h。
1.2.3 冻干保护剂单因素筛选
冷冻干燥过程会对微生物产生影响,容易降低微生态制剂中的活菌总数。因此在进行冷冻干燥前添加保护剂,不但可以恢复微生态原有的生物活性,还可以提高微生态制剂的活菌数。本研究选取的保护剂为脱脂乳、海藻糖、谷氨酸钠、吐温-80和甘油等,如表1所示。

表1 微生态制剂保护剂单因素水平 %
1.2.4 制备方法
(1)冷冻干燥及冻干存活率。
将活化好的菌种乳酸菌、酵母菌与枯草芽孢杆菌按1∶1∶1比例加到高密度培养基中,32℃培养18 h,对发酵液进行离心(6 000 r/min,15 min,4℃[9]),弃上清液,收集离心后的菌体,将离心后收集到的菌体加入到保护剂中,其中保护剂与菌体的体积比为3∶1[10],混合均匀备用。在进行冷冻干燥之前,样品需在-80℃超低温冰箱预冻至少5 h,使样品中的水以固体冰的形式存在,取出样品放入冷冻干燥机进行真空冷冻干燥;用冻干存活率的大小表示保护剂对菌体保护效果的好坏。冻干存活率计算公式为[11]
冻干存活率=(冻干后每克制剂中活菌总数×制剂质量)/(冻干前每毫升菌液活菌总数×菌液总体积)×100%。
(2)乳酸菌活菌总数测定。采用MRS固体培养基,把培养皿置于36℃±1℃培养箱中厌氧培养48h±2 h,活菌计数。参见GB/T 4789.35-2010。
(3)酵母菌活菌总数测定。采用孟加拉红培养基,把培养皿置于28℃±1℃培养箱中培养5 d,活菌计数。参见GB/T 4789.15-2010。
(4)枯草芽孢杆菌测定。按国标配置好枯草芽孢杆菌培养基,灭菌后使用。把培养皿置于37℃±1℃培养箱中培养48h±2 h,活菌计数。参见GB/T 26428-2010。
1.2.5 冻干保护剂的优化
将单因素筛选出的保护效果较好的冻干保护剂脱脂乳粉、海藻糖和甘油做响应面实验,以脱脂乳粉、海藻糖和甘油为实验因素,用Box-behnken设计法设计3因素3水平的响应面实验,用存活率作为检测指标,实验因素与水平如表2所示。

表2 响应面实验因素与水平
1.2.6 活菌变化实验
冷冻干燥得到的益生菌复合微生态制剂置于4℃冰箱中储存。每隔一个月按照乳酸菌国标计数方法对乳酸菌进行平板计数,做平行实验三次;按照酵母菌国标计数方法对酵母菌进行平板计数,做平行实验三次;按照枯草芽孢杆菌国标计数方法对枯草芽孢杆菌进行平板计数,做平行实验三次。计算益生菌复合微生态制剂所含乳酸菌、酵母菌及枯草芽孢杆菌的活菌总数。
2 结果与分析
2.1 各种冻干保护剂单因素实验结果
表3为微生态制剂冻干保护剂单因素实验结果。由表3可以看出,加入保护剂后,存活率都有所提高,只是提高程度的大小不同。在几种保护剂中可以看出脱脂乳、海藻糖、吐温-80及甘油的保护效果要好于谷氨酸钠。其中脱脂乳为高分子保护剂,且保护效果最好,存活率最低为61%,最高为70.3%。保护剂质量分数从6%增加到14%时存活率也增大,在保护剂质量分数14%时达到最大值,继续增大保护剂质量分数会抑制菌体的生长。海藻糖、吐温-80及甘油的都属于低分子保护剂,这三种保护剂的保护效果差异不大,且甘油对枯草芽孢杆菌的保护效果最优,海藻糖在高温、高寒条件下起到显著的保护作用,海藻糖和甘油的最高冻干存活率分别为57.7%和64.4%。谷氨酸钠的保护效果明显低于其余几种保护剂的保护效果,最高冻干存活率仅为40.6%。
本研究制备的复合微生态制剂包括乳酸菌、酵母菌以及枯草芽孢杆菌三种菌株。综合起来考虑,脱脂乳、海藻糖和甘油三种物质对乳酸菌、酵母菌及枯草芽孢杆菌都有较好的保护作用,因此选择这三种物质组成复配保护剂,深入研究复配保护剂的比例。
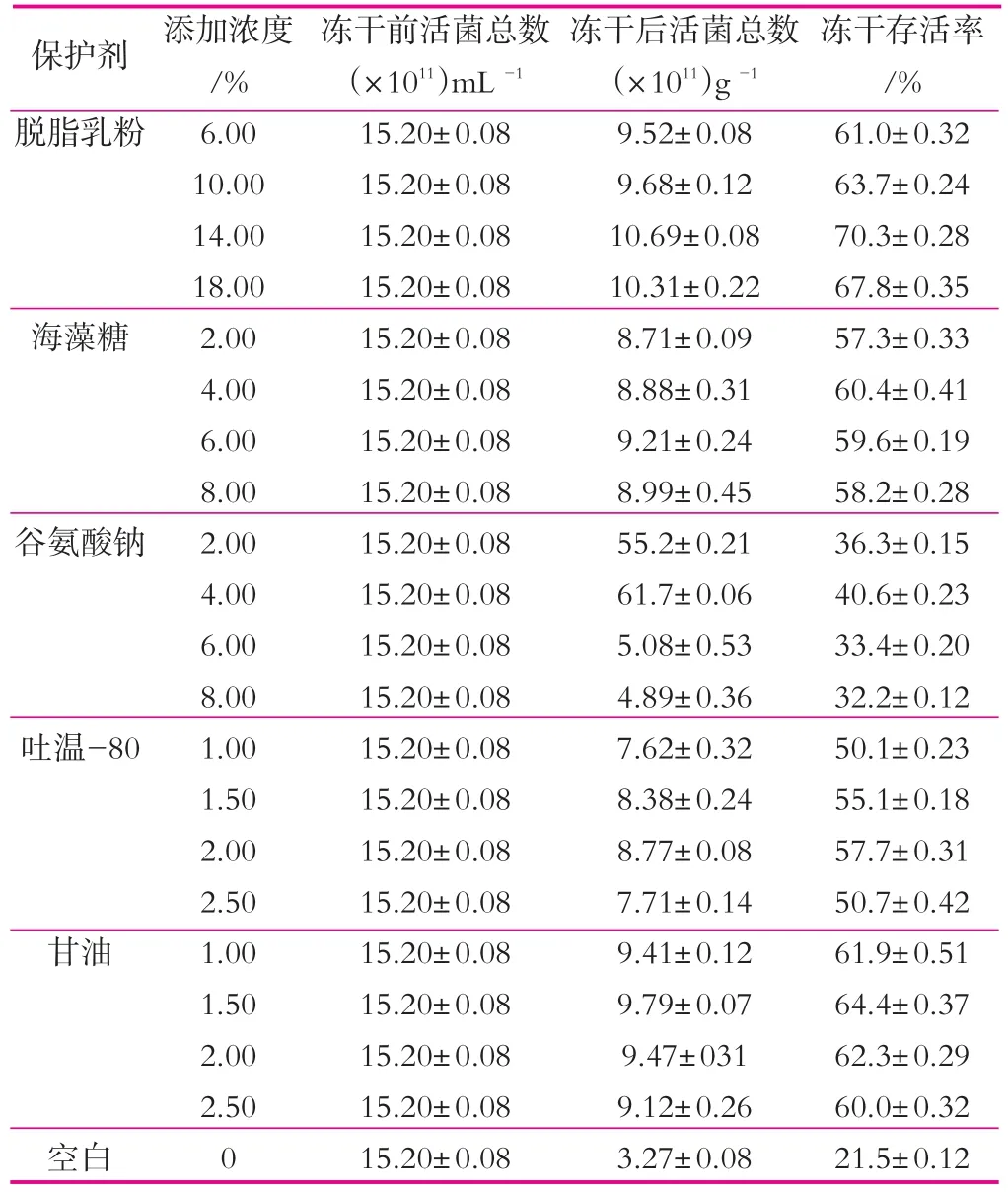
表3 微生态制剂冻干保护剂单因素实验结果
2.2 响应面结果与分析
在前面单因素分析结果的基础上进一步进行科学系统的探讨,单因素对实验的最终结果影响并不全面,每个单因素间还存在着协同或抑制的关系,因此选择响应面分析法对影响微生态制剂中活菌存活率的冻干保护剂进行探讨。
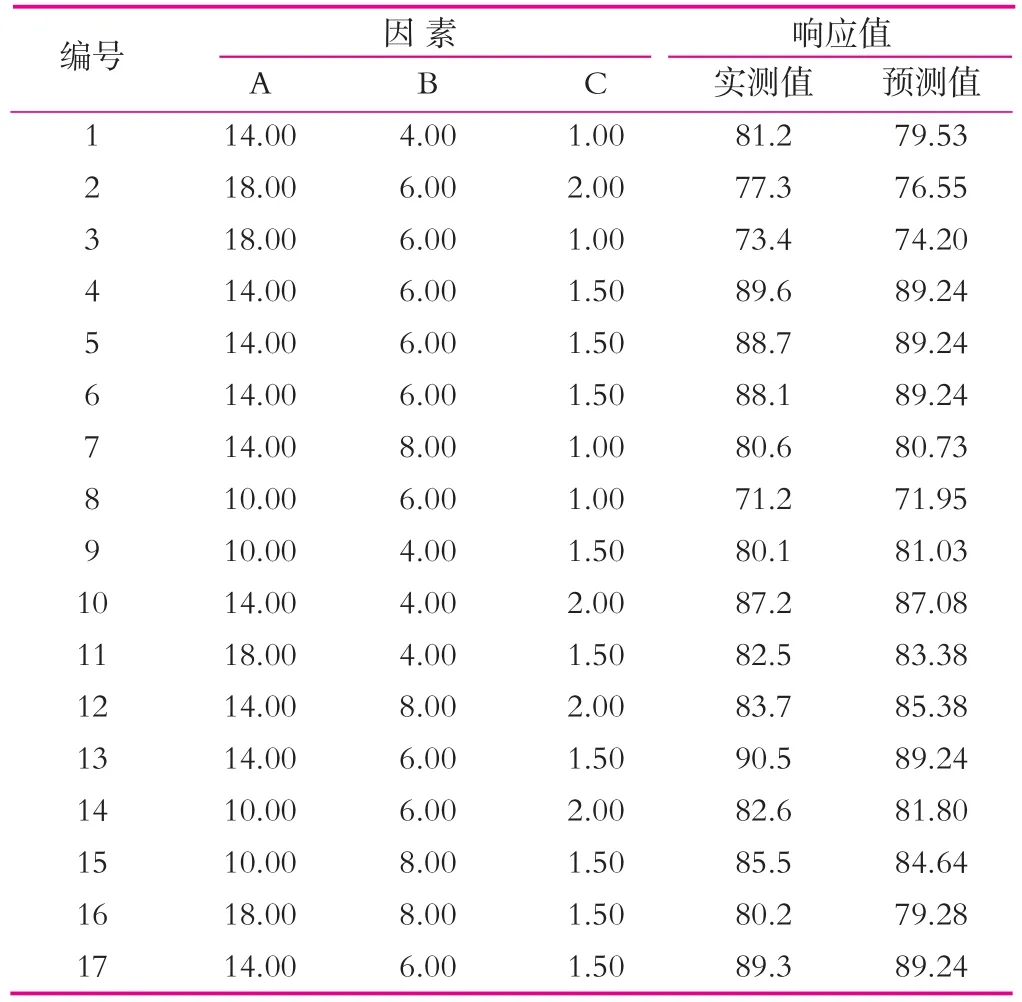
表4 Box-Behnken 实验设计与结果
借助于Design Expert软件,对复合微生态制剂保护剂的最优复配比例进行科学分析,结果如表4所示。由表4可知实验因子对响应值的影响可用回归方程表示为
Y=89.24-0.75A-0.13B+3.05C-1.92AB-1.88AC-0.72BC-7.11A2-0.057B2-6.01C2,
式中:Y为存活率;A,B,C分别为脱脂乳粉、海藻糖、甘油单位体积内溶质的质量浓度。
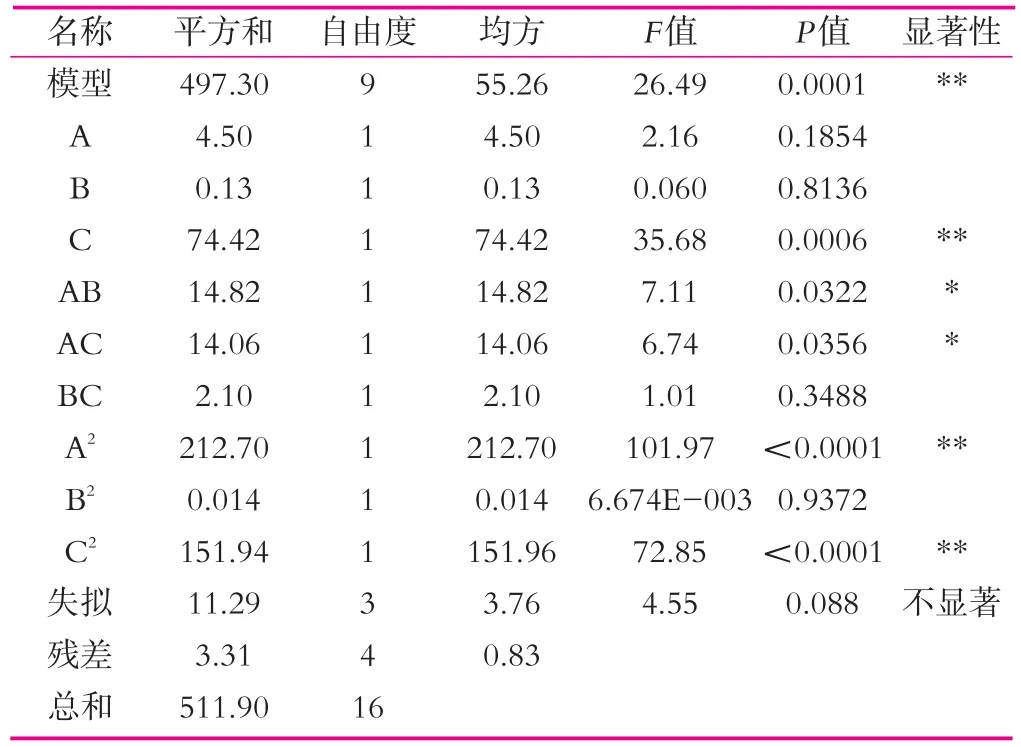
表5 回归模型方差分析
表5为回归模型方差分析。由表5可以看出,模型组P<0.01,所以模型显著。在方差分析表中,当P<0.05时表明模型中变异源显著,方差分析结果表明,A2、C2、C、AB及AC影响都是显著的;当P>0.05时则表示不显著,从方差分析表可以看出模型失拟项为0.088,此值大于0.05,所以失拟项不显著,这说明模型拟合程度很好,可以用于分析使用。
通过软件初步分析,从模型可以看出脱脂乳和甘油对复合微生态制剂中微生物的存活率的结果影响较大,主要采用响应面图表示影响作用的程度,如图1~图3所示。

图1 脱脂乳粉和海藻糖对冻干存活率的交互影响
由图1可以看出,脱脂乳粉和海藻糖的交互作用显著,随着脱脂乳粉质量分数的增大,冻干存活率呈现先上升后下降的趋势,随着海藻糖质量分数的增大,冻干存活率增大但增大幅度较平缓,当脱脂乳粉的浓度在12.00%~16.00%,海藻糖的浓度在4.00%~6.00%时,存活率在此范围内达到最大值。
由图2可以看出,脱脂乳粉和甘油的交互作用显著,随着脱脂乳粉和甘油质量分数的增大,冻干存活率都呈现先上升后下降的趋势,当脱脂乳粉的质量分数在12.00%~16.00%,甘油的质量分数在1.25%~1.75%时,存活率在此范围内达到最大值。
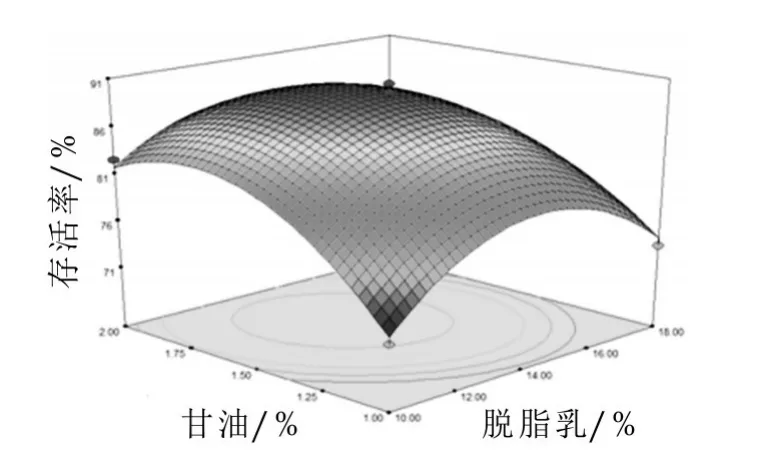
图2 脱脂乳粉和甘油对冻干存活率的交互影响

图3 海藻糖和甘油对冻干存活率的交互影响
由图3可以看出,海藻糖和甘油的交互作用不显著,随着海藻糖质量分数的增大冻干存活率增大较缓慢,随着甘油质量分数的增大,冻干存活率呈现先上升后下降的趋势,当海藻糖的质量分数在4.00%~6.00%,甘油的质量分数在1.25%~1.75%,存活率在此范围内达到最大值。
通过响应面实验,确定了复合微生态制剂保护剂的最佳配方为脱脂乳14.17%,海藻糖4.00%和甘油1.65%,在此条件下制得的微生态制剂益生菌存活率最高,可达到89.91%,其中乳酸菌数为5.60×1011g-1,酵母菌数为3.90×1011g-1,枯草芽孢杆菌数为4.20×1011g-1。
2.3 微生态制剂活菌变化实验结果
表6为微生态制剂贮藏过程中活菌总数变化。由表6可以看出,微生态制剂的活菌存活率在贮藏期间呈下降趋势,但6个月后仍有较高的活菌数。冷冻干燥技术制备的微生态制剂在6个月后活菌总数为6.0×109g-1。本研究制备的复合微生态制剂耐储存,在储存期内可以发挥免疫的功效,具有商业价值。

表6 微生态制剂贮藏过程中活菌总数变化 g-1
3 结论
通过单因素和响应面实验,确定了复合微生态制剂保护剂的最佳配方为脱脂乳14.17%,海藻糖4.00%和甘油1.65%,在此条件下制得的微生态制剂益生菌存活率最高,可达到89.91%,其中乳酸菌数为5.60×1011g-1,酵母菌数为3.90×1011g-1,枯草芽孢杆菌数为4.20×1011g-1。制备的复合微生态制剂活菌总数高达1.37×1012g-1。储藏期内活菌变化可知,微生态制剂的活菌存活率在贮藏期间呈下降趋势,但6个月后为6.0×109g-1。
[1]石现瑞,高峰.抗生素添加剂的负面效应及其代替品的研究[J].饲料博览,2000(3):24-26.
[2]金升藻,金巍,李红梅.微生态制剂研究进展与应用前景[J].湖北畜牧兽医,2005(3):51-53.
[3]滕颖,陈先国.动物微生态制剂的研究进展[J].中国兽药杂志,2005,39(11):43-46.
[4]许振英,张子仪.动物营养研究进展[M].北京:中国农业出版社,1994.239-249.
[5]ZDENEK H.Protectants used in the crypreservation of microorganisms[J].Cryobiology,2003,46:205-229.
[6]E.Costa J.Effect of Protective agents,rehydration media and initial cell concentration on viability of pantoea agglomerans strain CPA-2 subiected to freeze-drying[J],Journal of AppliedMicrobiology,2000,89:793-800.
[7]林丽萍,杨文娟,胡聪颖,等.藏灵菇耐胃肠道环境酵母菌和乳酸菌的筛选[J].中国乳品工业,2014,42(2):18-21.
[8]王和平,王锂韫,李少刚,等.类开菲尔粒中乳酸菌和酵母菌的分离鉴定及生物学特性[J].中国乳品工业,2004(12):3-6.
[9]杜鹏,刘芳,霍贵成.离心条件对双歧杆菌存活力的影响[J].山东大学学报(理学版),2008,43(7):40-43.
[10]林云.双歧杆菌冻干保护剂条件的研究[J].科学试验与研究,2002(6):3-6.
[11]袁亚宏,岳田利,高振鹏,等.冻干高活力乳酸菌粉保护剂的研究[J].西北农林科技大学学报,2003(31):82-85.
