热处理对牦牛乳酪蛋白胶束中酪蛋白及无机盐的影响
2015-12-16李启明马莺李琳何胜华
李启明,马莺,李琳,何胜华
(哈尔滨工业大学食品科学与工程学院,哈尔滨150090)
0 引言
热处理在乳的加工过程中起着很重要的作用,不仅能提高乳的加工特性,还能延长货架期[1]。酪蛋白胶束是由酪蛋白和磷酸盐连接的一种复合物[2]。然而,在一定温度条件下,酪蛋白从酪蛋白胶束上解聚下来进入乳清中,同时导致酪胶束中无机盐的变化,影响酪蛋白胶束的稳定性。
酪蛋白的解聚与乳的pH值和温度有关,酪蛋白解聚的量随着pH值和温度的升高而增加[3]。目前利用RP-HPLC分析热处理牦牛乳酪蛋白胶束上蛋白的解聚及湿法消解法/电感耦合等离子体发射光谱法(ICP-OES)测定无机盐的变化较少,本文采用RP-HPLC分析热处理牦牛乳酪蛋白胶束上蛋白的解聚及湿法消解法/电感耦合等离子体发射光谱法(ICP-OES)测定无机盐的变化,探讨牦牛乳在热处理过程中酪蛋白胶束的稳定性。
1 实验
1.1 材料
本研究所用的实验材料是采集于四川省红原县的牦牛乳样品,采集的样品加入质量分数为0.03%的叠氮化钠并在-18℃冷冻,并迅速送回实验室进行牦牛乳热稳定性的研究。
1.2 仪器设备
Agilent 1100高效液相色谱仪;全谱直读电感耦合等离子器(Perkin-Elmer,美国);离子色谱仪(ICS-3000,Dionex)。
2 方法
2.1 牦牛乳的热处理
取10 mL牦牛乳于25 mL具塞试管中,于油浴锅在120℃加热10 min或140℃加热2 min,边加热边振荡,加热完成后,冷却至室温。
2.2 膜过滤
将热处理和未热处理的牦牛乳经过分子量30 ku的膜过滤,膜被固定在一个平板和框架系统里(Consep 3000系列),利用高压泵来提供循环的操作压力,酪蛋白胶束被截留,乳清及乳清蛋白透过滤膜成为滤液。
2.3 乳蛋白分析
牦牛乳蛋白分析参考Li等人的方法[4]。选用Sigma公司的牛乳酪蛋白和乳清蛋白质标准品。50 mgκ-酪蛋白 (纯度 >80%),125 mgαs-酪蛋白 (纯度>85%),50 mgβ-酪蛋白 (纯度> 90%)。牦牛乳样品用流水解冻,于4℃下3 000×g离心10 min,去除脂肪。取1 mL牦牛脱脂乳分散到4 mL缓冲液中(浓度为8 mol/L尿素,165 mmol/L Tris,44 mmol/L柠檬酸钠和体积分数为0.3%的二巯基乙醇)。
RP-HPLC系统:Agilent 1100。柱类型及规格:Jupiter C4 column(250 mm×4.6 mm,300A-sized pores,5-μm sized particles)。检测波长为 220 nm,温度为30℃,进样量为20μL,洗脱液流速为0.8 mL/min。洗脱液:A和B两种洗脱液,A为色谱纯的水(加质量分数为0.1%的三氟乙酸),B为色谱纯的乙腈(加质量分数为0.1%的三氟乙酸)。洗脱条件为:上样前先用A液平衡,上样后0~40 min B液浓度从30%升到50%;40~42 min B液浓度从50%升到100%;42~43 min B液浓度为100%;43~46 min B液浓度从100%降到30%,然后再用起始洗脱液洗脱5 min。总洗脱时间为51 min。分离牦牛脱脂乳中的αs-CN,β-CN,κ-CN,α-La,β-Lg(A和B)。
2.4 钙、镁和磷元素的分析
牦牛乳中钙、镁和磷质量分数的分析按照Bocca等人的方法[5]。
2.4.1 湿法硝解
取待硝解样品4.00 g于150 mL三角瓶中,加10 mL HNO3,于电热板上徐徐加热至浓烟冒尽后,滴加H2O2至溶液无色或微淡黄色,定容至10 mL,摇匀,静止待测。(若硝解不彻底,可加少量高氯酸,若浓度太大,可稀释10倍再测)
2.4.2 样品中各元素质量分数
硝解好的样品经美国Perkin-Elmer Optima 5 300 PV全谱直读电感耦合等离子发射光谱仪测定样品中各元素质量分数。
仪器工作条件:RF功率1.3 kW,等离子气流量15 L/min,辅助气流量0.2 L/min,雾化气流量0.8 L/min,蠕动泵流速1.5 mL/min,样品冲洗时间60 s,积分时间5 s,观测方向为轴向。
2.5 磷酸盐和柠檬酸盐质量分数
2.5.1 离子色谱前处理
用HCL将牦牛乳原样的pH值调至4.6,用离心机于4 000 r/min离心20 min,取上清液3 mL,用有机系0.45 um滤膜过滤,滤出液用超纯水稀释10倍,稀释后的样品过Diomex OnGuard RP柱除去样品中的脂肪,去脂肪后的样品待测。
取未热处理样品透过液、经120℃热处理的样品透过液、经140℃热处理的样品透过液各5 g(5 mL),在冰箱中4℃沉降10 min,取上清液3 mL,用有机系0.45 um滤膜过滤,用超纯水稀释10倍,稀释后的样品过Diomex OnGuard RP柱除去样品中的脂肪,去除脂肪的样品待测。
2.5.2 样品中柠檬酸和磷酸盐质量分数的测定
将前处理好的4个样品用离子色谱仪(ICS-3000,Dionex)进行检测,测定样品中柠檬酸和磷酸盐质量分数。检测仪器工作条件:
(1)流速为1 mL/min,进样量为100 ug,离子液为KOH,柱子为IONPAC AS11-HC,温度为25℃。
(2)洗涮条件:0 min为 20 mmol;15 min为 30 mmol;25 min为20 mmol;30 min为20 mmol。
(3)计算公式:标样质量浓度(10 mg/L)/标样峰面积=样品浓度/样品峰面积。
3 结果与分析
3.1 不同温度下牦牛乳酪蛋白胶束中酪蛋白的变化
牦牛乳分别经过140℃加热2 min(120℃)加热10 min和未加热3种不同处理方式,将热处理和未热处理的脱脂乳用分子量为3×104u的膜超滤,利用RP-HPLC分析截留液中各蛋白组分的质量分数,分析不同温度下牦牛乳酪蛋白胶束的解聚和乳清蛋白的变性作用。
图1为不同温度下牦牛乳酪蛋白胶束中酪蛋白的变化,在未热处理时,牦牛乳中κ-CN的质量浓度为6.42 g/L,而分别经过140℃(2 min)和120℃(10 min)进行热处理后,牦牛乳中κ-CN的质量浓度分别为4.02 g/L和4.55 g/L,热处理后的牦牛乳酪蛋白胶束中κ-CN的质量浓度明显低于(P<0.05)未热处理牦牛乳中κ-CN质量浓度,说明有部分κ-CN在热处理情况下从酪蛋白胶束上解聚下来进入乳清中,κ-CN从酪蛋白解聚后与热变性的乳清蛋白通过二硫键形成可溶性κ-CN/乳清蛋白复合物[6]。未加热牦牛乳中αs2-CN的质量浓度为3.78 g/L,而分别经过140℃(2 min)和120℃(10 min)进行热处理后,牦牛乳中αs2-CN的质量浓度分别为1.93 g/L和2.57 g/L,热处理后的牦牛乳酪蛋白胶束中αs2-CN的质量浓度明显低于(P<0.05)未热处理牦牛乳中αs2-CN质量浓度,说明有部分αs2-CN在热处理情况下也从酪蛋白胶束上解聚下来进入乳清中。另外αs1-CN和β-CN也出现类似的情况。
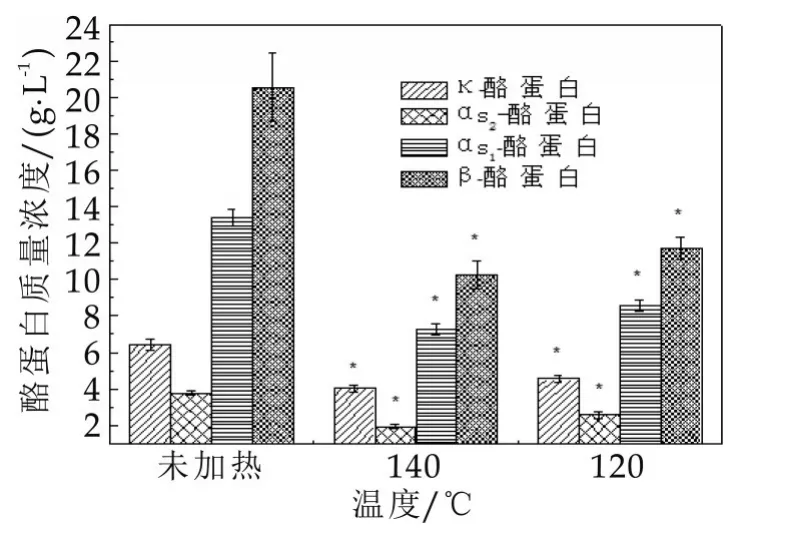
图1 不同温度下牦牛乳酪蛋白胶束中酪蛋白的变化
3.2 不同热处理牦牛乳无机盐质量分数的变化
牦牛乳分别在140℃(2 min)和120℃(10 min)进行热处理,分别将热处理和未热处理的脱脂乳用分子量为3×104u的膜超滤。表1为采用湿法消解法/电感耦合等离子体发射光谱法(ICP-OES)测定不同热处理牦牛乳中Ca、Mg和P的质量分数。热处理牦牛乳超滤液中的Ca质量分数比未加热牦牛乳中Ca质量分数要低,这主要是在热处理过程中一些游离Ca参与了乳清蛋白与酪蛋白胶束的热诱导聚合作用,导致超滤液中Ca质量分数降低。
P也是与酪蛋白结合在一起,未加热牦牛乳超滤液中P的质量分数比加热牦牛乳中P的质量分数要高,可溶性P的质量分数高,牦牛乳也越稳定,牦牛乳经热处理后,可溶性P在受热情况下与酪蛋白发生了结合,从而降低了可溶性P的质量分数导致牦牛乳在加热情况下变得不稳定。未加热牦牛乳可溶性Ca/P比为0.74,而分别经140℃(2 min)和120℃(10 min)热处理的牦牛乳的Ca/P比为1.08和1.07,因此Ca/P比较低的乳热稳定性高。
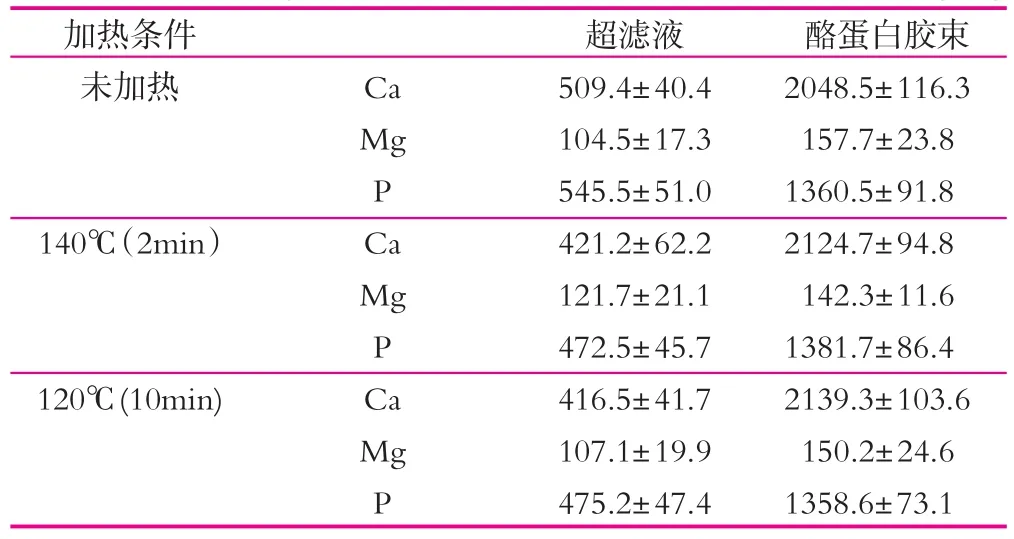
表1 Ca,Mg和P在不同热处理牦牛乳中的分配 mg/kg
3.3 不同热处理牦牛乳磷酸盐及柠檬酸盐质量分数的变化
磷酸盐和柠檬酸盐也是酪蛋白胶束稳定性的重要组成成分,牦牛乳中无机盐采用ICS-3000离子色谱测定。乳中磷酸盐和柠檬酸盐与Ca和Mg结合在一起。乳中可溶性柠檬酸钙和柠檬酸镁比磷酸钙和磷酸镁结合的强度高,因此在pH值恒定或变化不大时,可溶性Ca和Mg与柠檬酸直接相关。表2为磷酸盐和柠檬酸盐在不同热处理牦牛乳中的分配。由表1可以看出,未加热牦牛乳中柠檬酸盐比加热牦牛乳中柠檬酸盐质量分数要高,而加热牦牛乳酪蛋白胶束中的磷酸盐质量分数比未加热要高,这可能是在加热情况下,游离的Ca与磷酸盐一起与酪蛋白发生了结合。

表2 磷酸盐和柠檬酸盐在不同热处理牦牛乳中的分配 mg/kg
4 结论
(1)利用RP-HPLC分析了不同温度下牦牛乳酪蛋白胶束蛋白的变化,经过140℃(2 min)和120℃(10 min)进行热处理后,牦牛乳酪蛋白胶束中κ-CN,αs2-CN,αs1-CN和β-CN发生了不同程度的解聚。
(2)采用湿法消解法/电感耦合等离子体发射光谱法(ICP-OES)测定不同热处理牦牛乳中Ca、Mg和P的质量分数。热处理牦牛乳超滤液中的Ca质量分数比未加热牦牛乳中Ca质量分数要高,可溶性钙高,则表现出牦牛乳由于受热作用开始不稳定。
(3)牦牛乳中无机盐采用ICS-3000离子色谱测定,加热牦牛乳酪蛋白胶束中的磷酸盐质量分数比未加热要高,这可能是在加热情况下,游离的Ca与磷酸盐一起与酪蛋白发生了结合。
[1]MCKINNON I R,YAP S E,AUGUSTIN M A,et al.Diffusing-wave spectroscopy investigation of heated reconstituted skim milks containing calcium chloride[J].Food Hydrocolloids,2009,23:1127-1133.
[2]KNUIF C G,HUPPERTZ T,URBAN V S,et al(2012).Casein micelles and their internal structure[J].Advances in Colloid and Interface Science,2012:171-172,36-52.
[3]ANEMA S G,KLOSTERMEYER H.Heat-induced,pH-dependent dissociation of casein micelles on heating reconstituted skim milk at temperatures below 100℃[J].Journal of Agricultural and Food Chemistry,1997,45:1108-1115.
[4]LI H M,MA Y,DONG A J,et al.Protein composition of yak milk[J].Dairy Science and Technology,2010,90:111-117.
[5]BOCCA B,ALIMONTI A,CONI E,et al.Determination of the total content and binding pattern of elements in human milk by high performance liquid chromatography inductively coupled plasma atomic emission spectrometry[J].Talanta,2000,53:295-303.
[6]SINGH H,FOX P F.Heat stability of milk:pH-dependent dissociation of micellar κ-casein on heating milk at ultra high temperatures[J].Journal of Dairy Research,1985,52:529-538.
