新辅助放化疗后手术时机选择对进展期直肠癌患者预后影响的研究进展
2015-12-16综述审校
张 斌 综述,汪 昱 审校
上海交通大学附属第六人民医院普外科,上海 200233
新辅助放化疗后手术时机选择对进展期直肠癌患者预后影响的研究进展
张 斌 综述,汪 昱 审校
上海交通大学附属第六人民医院普外科,上海 200233
进展期直肠癌行新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT)后的延期手术可以增加根治切除机会,降低局部复发,同时改善患者总体生存率。常规的术前放化疗与手术之间的时间间隔为4~6周,延长手术时间间隔可以增加肿瘤退缩的程度,但是超过6~8周也可能会增加手术难度、手术并发症发生率及肿瘤复发或转移的风险。回顾分析相关文献,从肿瘤缓解率、预后、患病率和死亡率等方面对nCRT后延期手术时机选择对预后影响的研究进展进行综述。
新辅助治疗;手术时机;局部进展期直肠癌
直肠癌是我国最常见的恶性肿瘤之一,近年来其发病率和死亡率均保持上升趋势,严重威胁国人的健康和生命。由于结直肠癌早期症状不明显,多数病例就诊时已是进展期,单纯依靠外科手术治疗已经无法达到理想的治疗效果,越来越多的新治疗方案应用于进展期直肠癌,新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT)后行延期手术就是目前研究较多的新方法之一。nCRT是相对于传统术后辅助治疗而言,又称为术前辅助治疗,指对于可切除的恶性肿瘤患者为更加有效的进行手术,而在术前进行的治疗。美国癌症综合网(National Comprehensive Cancer Network,NCCN)2013版指南指出,对于大部分的Ⅱ期(淋巴结阴性,肿瘤穿透肠壁肌层)和Ⅲ期(淋巴结阳性,无远处转移)直肠癌患者,推荐nCRT。晚期直肠癌的患者治疗的主要目的是实现R0切除和尽可能保留肛门括约肌以提高患者的生活质量。对于局部进展期肿瘤,nCRT可以缩小肿瘤体积,实现肿瘤降级的作用,从而提高肿瘤患者局部控制率和生存率。nCRT方案的选择主要取决于治疗目标、既往治疗的类型和时限以及治疗方案构成中各种药物不同的毒副作用谱等因素,因此在制定方案时要遵循个体化、安全化的原则。目前在进展期直肠癌的治疗中使用着多
种有效的药物,主要包括5-FU/LV、奥沙利铂、伊立替康、卡培他滨、贝伐单抗、西妥昔单抗和帕尼单抗等。NCCN指南推荐首选5-FU持续注射联合放疗,也可以选择5-FU、LV联合放疗或卡培他滨联合放疗。而放疗在国际上尚没有统一的标准方案,在美国多使用长程放疗,即总剂量45.0~50.4 Gy,25~28次分割,共进行5周。欧洲国家则使用短程放疗方案,即总剂量25.0 Gy,5次分割。而我国抗癌协会大肠癌专业委员会推荐术前放疗使用20.0~25.0 Gy/2~5周。
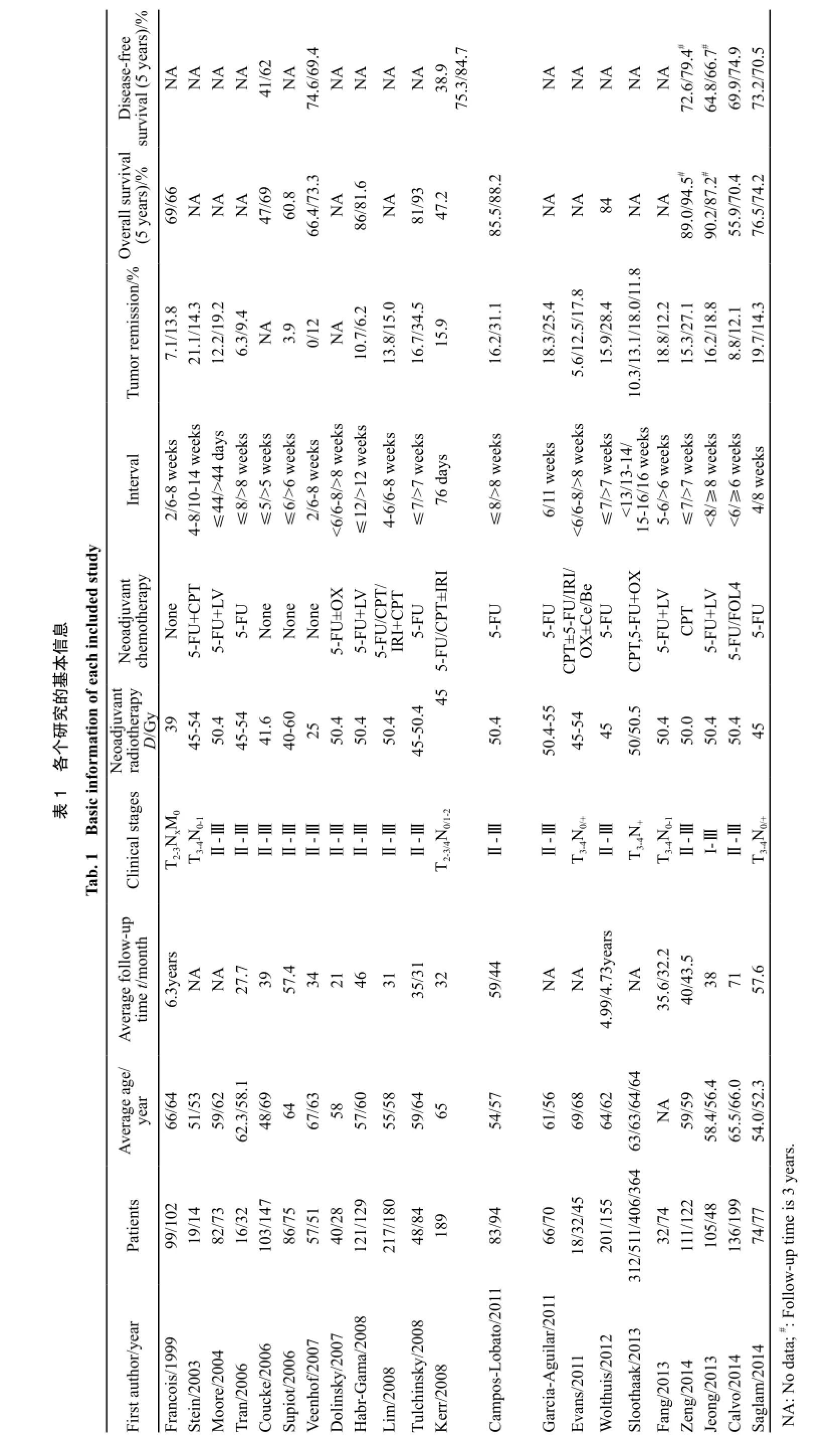
传统的nCRT后,常常在6周以内实施手术[1]。这样既可以提高肿瘤的反应性,也可以让患者从放化疗引起的不良反应中部分恢复。然而,还有研究认为,如果将手术时间再往后延长,疾病的病理缓解率可能会更高[2]。这就使得部分研究者认为延长nCRT与延期手术之间的时间间隔,将会提高人群肿瘤根治性切除率。因此,我们通过对数据库进行检索,共筛选出22篇文献进行分析(表1)。从肿瘤缓解率、预后、患病率和死亡率等方面对目前nCRT后延期手术时机选择对预后影响的研究进展进行综述。
1 肿瘤的缓解率
为了更好地了解延期手术的影响,研究者们做了队列研究来比较常规时间间隔与延长时间间隔对于肿瘤降期的影响,其中最著名的随机临床试验就是1999年的Lyon R90-01试验[3],该试验结果证实,与2周的间隔时间相比,nCRT后6~8周的时间间隔不仅能够降低肿瘤的分期,而且有较好的病理缓解率。Tulchinsky等[4]对132例患者分析后发现,延长间隔时间至7周以上,直肠癌患者获得了更好的完全缓解率和近完全缓解率(17%和35%,P=0.03)。其他研究[5-7]也得出相似的结果。其主要原因可能是由于放疗和化疗之间的协同作用,可以增强二者的治疗效应。然而,部分研究也未能得到肿瘤降期的疗效,在降期效果较好的研究中,相比淋巴结的数目,肿瘤体积的改变可能是一个更加明显的效果。Stein等[8]对33例患者进行分析发现,时间较短组的肿瘤降期率为43%,而时间较长组为58%,尽管后者降期效果明显好于前者,但差异无统计学意义(P=0.61),且病理完全缓解率反而降低(21%和14%,P=0.97)。Moore等[9]对155例患者综合分析后,也未能发现延长nCRT后手术时间会出现明显的肿瘤降期效果(P=0.11)。随后,有大量的研究者进行这方面的研究,时间间隔也各不相同,最长的超过16周[10]。近期Fang等[11]和Jeong等[12]均发现延长nCRT后,手术间隔时间均未明显改善肿瘤完全缓解率。最近的荟萃分析也显示,从病理完全缓解率方面来看,延长了治疗间隔时间的患者,病理完全缓解率明显要高于时间间隔短的患者(95%CI:1.19~1.68)[13]。
出现这种不一致性的原因有很多。首先,在阴性结果的试验中,单纯地定义一个时间间隔并不能完全准确地反映出肿瘤组织对治疗的反应情况,即出现时间-效应曲线,如5 d[14]、44 d[9]、6周[15]或8周[16]。因为时间间隔越长,肿瘤坏死的程度也就越高。而在具有阳性结果的研究中,往往都对时间间隔有着清晰的划分。如Evans等[17]将直肠癌患者手术间隔时间分为6周以内、6~8周和8周以上,病理完全缓解率分别达到了5.6%、12.5%和17.8%,从该研究中可以看出随着时间的延长,病理完全缓解率也逐渐增加。Sloothaak等[10]将1 593例直肠癌患者手术时间间隔分为13周以内、13~14周、15~16周及16周以上,该研究结果发现nCRT后15~16周,患者出现了最高的病理完全缓解率(18.0%,P=0.013)。这也验证了Evans的研究结果。其次,是研究的样本量的大小。在任何一个试验中,样本量的多少与统计学的结果密切相关,这也可以直接反映在研究的效应量上。如Stein等[8]和Tran等[16]的样本仅有33例和48例,而一些具有阳性结果的试验的样本量均较大。但是,也有样本量较大的试验得出了阴性的结果,如Lim等[18]对397例患者进行研究,发现两组患者的T分期降低十分接近(47.5%和44.4%),差异无统计学意义(P>0.05)。第三,是治疗措施的影响。对于单独应用5-FU的治疗措施而言,联合多药的治疗措施往往有更好的病
理缓解率。但是并不绝对,如Tulchinsky等[4]单用5-FU后获得了较高的病理缓解率。因此,通过目前的文献情况,我们基本可以得出:对于nCRT与手术之间的时间间隔如果能够达到8~16周,就可能在减少直肠癌肿瘤体积方面获得更好的效果。
2 围手术期患病率和死亡率
增加时间间隔对手术实施难度、术后的患病率和死亡率都有较大的影响。间隔时间太长可能会导致组织的纤维化,增加手术切除的难度。Tran等[16]发现时间间隔>8周的患者对比较短时间间隔(≤8周)的患者,手术时间会相对延长(280 min vs 210 min)。延期手术的患者的平均住院时间也会延长(7.7 d vs 9.9 d)。但是多数研究认为,两者之间差异无统计学意义[4,9,19-21],死亡率和并发症发生率(包括术中失血、术后感染及吻合口并发症)没有显著增加。多项研究统计结果显示,两组之间手术中出血量差异无统计学意义[8-9,16],而且延长手术间隔时间并不会增加术后30 d的死亡率[3,19]。此外,较长的时间间隔也可能使患者可以从nCRT的不良反应中恢复。因此,基于现有的数据来说,延期手术被认为可能是安全的。但是除了延期手术,其他因素也可以影响并发症和死亡率,需要多因素分析来验证当前的结论。
3 预后
nCRT后局部进展期直肠癌患者预后的主要影响因素是能否发现残留的肿瘤细胞,也就是肿瘤“种子”或称为直肠系膜“微灶”[22-23],这些细胞可能是术后复发或转移的“种子”。因此,有学者质疑,术前较长时间间隔是否会导致肿瘤细胞“种子”的复苏、增殖和播散。针对预后的结果主要集中在5年总生存期(overall survival,OS)和无病生存期(disease-free survival,DFS)两方面。对纳入的文献进行统计可以发现,Tulchinsky等[4]和Coucke等[14]的研究认为OS和DFS在两组之间差异有统计学意义(P均<0.05),Calvo等[24]认为两组的OS差异有统计学意义(55.9% vs 70.4%,P=0.014),而DFS和5年的局部控制率差异无统计学意义(69.9% vs 74.9%,P=0.223;90.4% vs 94.5%,P=0.123)。其余的研究均未能获得两者的阳性结果[11,13-14,25-26]。此外,来自伊斯坦布尔的Saglam等[27]证实了手术切缘阳性的患者OS更低(78.8% vs 53.0%,P=0.04)。因此在目前,这种质疑缺乏依据,相反,延期手术提高了肿瘤根治切除率,反而使患者获得了生存期的延长。
但是应该要注意到两个重要的问题。第一,目前的延期手术研究采用的时间间隔基本在6~12周,进一步延长时间窗(例如12周以上)是否存在隐患。因为有研究发现,从确诊到手术之间过长的时间间隔(12~16周)也会导致DFS缩短[15]。第二,目前研究的平均随访时间≤5年,但据报道nCRT对于肿瘤细胞生长的自然病程会有一个长期抑制效应,与未接受nCRT的患者相比,接受nCRT的患者转移或复发通常会延迟,有20%~30%的患者复发和转移出现在5年以后。因此为了更准确地评估延期手术的效果,可能需要延长随访时间。
4 讨论
局部进展期直肠癌nCRT后手术时机的选择近年来受到了研究者的极大关注。目前大数据研究将手术时间定在nCRT后4~6周内进行。这样,不仅肿瘤的缓解率可以维持在40%~60%,R0切除率也能有所提高。在临床实际工作中,手术时机的选择主要依赖于手术医师的观念和临床经验。但是,随着手术间隔时间的延长,有一部分患者会获得较明显的肿瘤反应性。目前,针对手术时间间隔的研究主要是回顾性研究,随机对照性研究开展较少。因此,在这些获得的研究结果中,各类研究偏倚的存在就是不可避免的。如研究人员在当时给予患者治疗时,手术时间间隔并不是他们的首要目标。此外,在回顾性选择数据时,研究者也往往会选择那些结果阳性的病例进行报道。因此,大样本的随机对照研究十分必要。近期已经有研究人员报道了他们的RCT研究方案[28]。相信随着研究人员对局部进展期直肠癌的诊治措施的理解以及患者需求的增加,针对该疾病的手术时
机选择也会更加受到重视。
[1] KIM N K, BAIK S H, SEONG J S, et al. Oncologic outcomes after neoadjuvant chemoradiation followed by curative resection with tumor specific mesorectal excision for fixed locally advanced rectal cancer: impact of postirradiated pathologic downstaging on local recurrence and survival [J]. Ann Surg, 2006, 244(6): 1024-1030.
[2] GLEHEN O, CHAPET O, ADHAM M, et al. Long-term results of the Lyons R90-01 randomized trial of preoperative radiotherapy with delayed surgery and its effect on sphinctersaving surgery in rectal cancer [J]. Br J Surg, 2003, 90(8): 996-998.
[3] FRANCOIS Y, NEMOZ C J, BAULIEUX J, et al. Influence of the interval between preoperative radiation therapy and surgery on downstaging and on the rate of sphincter-sparing surgery for rectal cancer: the Lyon R90-01 randomized trial[J]. J Clin Oncol, 1999, 17(8): 2396-2402.
[4] TULCHINSKY H, SHMUELI E, FIGER A, et al. An interval>7 weeks between neoadjuvant therapy and surgery improves pathologic complete response and disease-free survival in patients with locally advanced rectal cancer [J]. Ann Surg Oncol, 2008, 15(10): 2661-2667.
[5] VEENHOF A A, KROPMAN R H, ENGEL A F, et al. Preoperative radiation therapy for locally advanced rectal cancer: a comparison between two different time intervals to surgery [J]. Int J Colorectal Dis, 2007, 22(5): 507-513.
[6] DOLINSKY C M, MAHMOUD N N, MICK R, et al. Effect of time interval between surgery and preoperative chemoradiotherapy with 5-fluorouracil or 5-fluorouracil and oxaliplatin on outcomes in rectal cancer [J]. J Surg Oncol, 2007, 96(3): 207-212.
[7] ZENG W G, ZHOU Z X, LIANG J W, et al. Impact of interval between neoadjuvant chemoradiotherapy and surgery for rectal cancer on surgical and oncologic outcome [J]. J Surg Oncol, 2014, 110(4): 463-467.
[8] STEIN D E, MAHMOUD N N, ANNE P R, et al. Longer time interval between completion of neoadjuvant chemoradiation and surgical resection does not improve downstaging of rectal carcinoma [J]. Dis Colon Rectum, 2003, 46(4): 448-453.
[9] MOORE H G, GITTLEMAN A E, MINSKY B D, et al. Rate of pathologic complete response with increased interval between preoperative combined modality therapy and rectal cancer resection [J]. Dis Colon Rectum, 2004, 47(3): 279-286.
[10] SLOOTHAAK D A, GEIJSEN D E, VAN LEERSUM N J, et al. Optimal time interval between neoadjuvant chemoradiotherapy and surgery for rectal cancer [J]. Br J Surg, 2013, 100(7): 933-939.
[11] FANG C B, GOMES C M, FORMIGA F B, et al. Is the delayed surgery after neoadjuvant chemoradiation beneficial for locally advanced rectal cancer? [J]. Arq Bras Cir Dig, 2013, 26(1): 31-35.
[12] JEONG D H, LEE H B, HUR H, et al. Optimal timing of surgery after neoadjuvant chemoradiation therapy in locally advanced rectal cancer [J]. J Korean Surg Soc, 2013, 84(6): 338-345.
[13] PETRELLI F, SGROI G, SARTI E, et al. Increasing the interval between neoadjuvant chemoradiotherapy and surgery in rectal cancer: a meta-analysis of published studies [J]. Ann Surg, 2013, 56(7): 921-930.
[14] COUCKE P A, NOTTER M, MATTER M, et al. Effect of timing of surgery on survival after preoperative hyperfractionated accelerated radiotherapy (HART) for locally advanced rectal cancer (LARC): is it a matter of days? [J]. Acta Oncol, 2006, 45(8): 1086-1093.
[15] SUPIOT S, BENNOUNA J, RIO E, et al. Negative influence of delayed surgery on survival after preoperative radiotherapy in rectal cancer [J]. Colorectal Dis, 2006, 8(5): 430-435.
[16] TRAN C L, UDANI S, HOLT A, et al. Evaluation of safety of increased time interval between chemoradiation and resection for rectal cancer [J]. Am J Surg, 2006, 192(6): 873-877.
[17] EVANS J, TAIT D, SWIFT I, et al. Timing of surgery following preoperative therapy in rectal cancer: the need for a prospective randomized trial? [J]. Dis Colon Rectum, 2011, 54(10): 1251-1259.
[18] LIM S B, CHOI H S, JEONG S Y, et al. Optimal surgery time after preoperative chemoradiotherapy for locally advanced rectal cancers [J]. Ann Surg, 2008, 248(2): 243-251.
[19] DE CAMPOS-LOBATO L F, GEISLER D P, DA LUZ MOREIRA A, et al. Neoadjuvant therapy for rectal cancer: the impact of longer interval between chemoradiation and surgery[J]. J Gastrointest Surg, 2011, 15(3): 444-450.
[20] GARCIA-AGUILAR J, SMITH D D, AVILA K, et al. Optimal timing of surgery after chemoradiation for advanced rectal cancer: preliminary results of a multicenter, nonrandomized phase II prospective trial [J]. Ann Surg, 2011, 254(1): 97-102.
[21] KERR S F, NORTON S, GLYNNE-JONES R. Delaying surgery after neoadjuvant chemoradiotherapy for rectal cancer may reduce postoperative morbidity without compromising prognosis [J]. Br J Surg, 2008, 95(12): 1534-1540.
[22] GAVIOLI M, LUPPI G, LOSI L, et al. Incidence and clinical impact of sterilized disease and minimal residual disease after preoperative radiochemotherapy for rectal cancer [J]. Dis Colon Rectum, 2005, 48(10): 1851-1857.
[23] RUBIO C A. Arrest of cell proliferation in budding tumor cells ahead of the invading edge of colonic carcinomas. A preliminary report [J]. Anticancer Res, 2008, 28(4C): 2417-2420.
[24] CALVO F A, MORILLO V, SANTOS M, et al. Interval between neoadjuvant treatment and definitive surgery in locally advanced rectal cancer: impact on response and
oncologic outcomes [J]. J Cancer Res Clin Oncol, 2014, 140(10): 1651-1660.
[25] HABR-GAMA A, PEREZ R O, PROSCURSHIM I, et al. Interval between surgery and neoadjuvant chemoradiation therapy for distal rectal cancer: does delayed surgery have an impact on outcome? [J]. Int J Radiat Oncol Biol Phys, 2008, 71(4): 1181-1188.
[26] WOLTHUIS A M, PENNINCKX F, HAUSTERMANS K, et al. Impact of interval between neoadjuvant chemoradiotherapy and TME for locally advanced rectal cancer on pathologic response and oncologic outcome [J]. Ann Surg Oncol, 2012, 19(9): 2833-2841.
[27] SAGLAM S, BUGRA D, SAGLAM E K, et al. Fourth versus eighth week surgery after neoadjuvant radiochemotherapy in T3-4/N0+ rectal cancer: Istanbul R-01 study [J]. J Gastrointest Oncol, 2014, 5(1): 9-17.
[28] LEFEVRE J H, ROUSSEAU A, SVRCEK M, et al. A multicentric randomized controlled trial on the impact of lengthening the interval between neoadjuvant radiochemotherapy and surgery on complete pathological response in rectal cancer (GRECCAR-6 trial): rationale and design [J]. BMC Cancer, 2013, 12(13): 417.
Study of impact of operation time interval after neoadjuvant chemoradiotherapy for locally
progressed rectal patients’ outcome
ZHANG Bin, WANG Yu (Department of General Surgery, Shanghai
Jiao Tong University Affiliated Sixth People’s Hospital, Shanghai 200233, China)
WANG Yu E-mail: wangyu11122@yahoo.cn
Neoadjuvant chemoradiotherapy (nCRT) is used to downstage locally advanced rectal cancer before surgery, in order to increase the chance of radical resection, reduce local recurrence, and improve overall survival. Accumulating data suggest that tumor response to nCRT is time dependent. A delay between nCRT and surgery may increase the proportion of patients that achieve a favorable response, and 4-6 weeks are considered to be a universal interval. However, delayed surgery beyond 6-8 weeks may increase the technical difficulty, and the risks of surgical complications and recurrence or metastasis. This article briefly reviews the relevant literature to evaluate the efficiency and safety of delayed surgery.
Neoadjuvant chemoradiotherapy; Operation time interval; Locally progressed rectal carcinoma
10.3969/j.issn.1007-3969.2015.08.013
R735.3+7
A
1007-3639(2015)08-0635-06
2015-02-06
2015-04-15)
汪昱 E-mail:wangyu11122@yahoo.cn
