藏红花酸预处理对大鼠心肌缺血再灌注损伤中炎症反应和细胞凋亡的影响及其机制
2015-12-15孙经武王艳艳房灿
孙经武, 王艳艳, 房灿
藏红花酸预处理对大鼠心肌缺血再灌注损伤中炎症反应和细胞凋亡的影响及其机制
孙经武, 王艳艳, 房灿
目的:探讨藏红花酸预处理对大鼠心肌缺血再灌注损伤中炎症反应和细胞凋亡的影响及其机制。
方法:将30只Wistar 雄性大鼠随机分为假手术组,缺血再灌注组,藏红花酸组,每组10只,术前7天分别给予相应处理。采用结扎冠状动脉左前降支的方法建立心肌缺血再灌注模型,缺血45 min后再灌注3 h。实验结束后用酶联免疫吸附法(ELISA) 检测大鼠血清肌酸激酶MB同工酶(CK-MB)、肿瘤坏死因子-α(TNF-α)和白细胞介素-10(IL-10) 的含量,脱氧核苷酸末端转移酶介导的dUTP缺口末端标记法(TUNEL) 检测心肌细胞的凋亡指数。
结果:与假手术组相比,缺血再灌注组及藏红花酸组血清CK-MB和TNF-α含量明显上升(P<0.01),藏红花酸组IL-10含量明显上升(P<0.01),差异均有统计学意义。与缺血再灌注组相比,藏红花酸组的血清CK-MB、TNF-α含量及心肌细胞凋亡指数明显降低(P<0.01),差异有统计学意义;而血清IL-10含量明显升高(P<0.01),差异有统计学意义。
结论:藏红花酸预处理在心肌缺血再灌注损伤中可以通过负性调节TNF-α,正性调节IL-10来减轻炎症反应并抑制心肌细胞的凋亡,发挥心肌保护作用。
藏红花酸;心肌缺血再灌注损伤;炎症;凋亡
Methods: A total of 30 male Wistar rats were randomly divided into 3 groups: Sham group, the rats received intragastric sodium carboxymethyl cellulose (CMC-Na) for 7 days followed by the operation without occlusion. I/R group, the rats received intragastric CMC-Na for 7 days followed by left anterior descending (LAD) coronary artery occlusion for 45 min with subsequent reperfusion for 3 hours. CRO group, the rats received intragastric crocetin 50 mg/ (kg.day) for 7 days followed by I/R procedure. n=7 in each group. The levels of creatine kinase-MB (CK-MB), tumor necrosis factor-α (TNF-α) and infammation cytokine interleukin-10 (IL-10) were examined by ELISA, the myocardial apoptosis index was determined by TUNEL staining.
Result: Compared with Sham group, I/R group and CRO group had increased levels of CK-MB, TNF-α, and CRO group had increased IL-10 level, all P<0.01. Compared to I/R group, CRO group showed decreased levels of CK-MB, TNF-α and myocardial apoptosis index, while increased IL-10 level, all P<0.01.
Conclusion: Crocetin pretreatment could down-regulate TNF-α expression, up-regulate IL-10 expression and therefore reducing the infammatory reaction in experimental rats to protect myocardial apoptosis
(Chinese Circulation Journal, 2015, 30:172.)
急性心肌梗死目前在心血管疾病中属于高发病率和高死亡率中的一员。早期再灌注治疗无论是溶栓或急诊经皮冠状动脉(冠脉)介入治疗是心肌挽救最实用和最广泛采用的方法[1]。虽然这些治疗方法已被大大改善,患者的恢复仍然不尽人意,缺血再灌注损伤是影响患者康复的最重要因素之一,因此如何减轻心肌缺血再灌注损伤显得尤为重要。近年来,研究发现细胞凋亡是急性心肌缺血再灌注损伤中的心肌细胞死亡的重要机制之一[2,3]。此外炎症反应也是引起心肌缺血再灌注损伤的重要机制之一[4]。
藏红花酸是藏红花提取物的主要活性成分之一,既往的相关研究已经证实其对脑、肺、肾、肝的缺血再灌注损伤有保护作用[5-7],其机制可能涉及抑制氧化应激、炎症反应、细胞凋亡等方面。但尚未有其对心肌缺血再灌注损伤相关作用的研究报告,本研究通过建立大鼠心肌缺血再灌注模型,进一步揭示藏红花酸在心肌缺血再灌注损伤中的保护作用机制。
1 材料与方法
动物: 2013-04至2013-05选择健康成年Wistar雄性大鼠30只,体重(220±20)g,由山东大学实验动物中心提供,在本实验室适应性喂养3天后用于实验。
药品与试剂:藏红花酸购自济南浩化实业有限责任公司,批号为20121123,为砖红色粉末,使用前以0.5%羧甲基纤维素钠(0.5% CMC-Na)制成0.5%的悬浮液。肌酸激酶MB同工酶(CK-MB)、肿瘤坏死因子-α(TNF-α)及白细胞介素-10(IL-10)酶链免疫收附法(ELISA)试剂盒购自厦门慧嘉生物有限公司,脱氧核苷酸末端转移酶(TdT)介导的dUTP缺口末端标记法(TUNEL) 试剂盒购自南京凯基生物有限公司。
分组与给药方法:将健康成年Wistar雄性大鼠30只随机分为假手术组,缺血再灌注组,藏红花酸组,每组l0只。按如下方案给药:
假手术组:大鼠先灌服0.5% CMC-Na, 10 ml/(kg·d),7天后开胸,只穿线不结扎冠脉。缺血再灌注组:大鼠先灌服0.5% CMC-Na, 10 ml/(kg·d),7天后开胸结扎冠脉前降支45 min,再灌注液体180 min,建立缺血再灌注损伤模型。藏红花酸组:造模前一周给予0.5%藏红花酸50 mg/(kg·d)灌胃,余同缺血再灌注组。
模型建立: 采用结扎左前降支的方式建立心肌缺血再灌注损伤(MIRI)模型[8]。 Wistar大鼠术前禁食6 h。20%乌拉坦按8 ml/kg对大鼠实施腹腔注射麻醉,仰卧位固定,打开电脑及Medlab信号采集系统,连接心电图记录Ⅱ导联心电图,气管插管连接小动物呼吸机进行机械通气。在胸骨左缘0.5 cm处剪开胸部皮肤,于3~4肋间,剪断第4肋并分离肋间肌,刺破胸膜暴露心脏,剪开心包膜,将心脏挤出胸腔,于左心耳与肺动脉圆锥交界处下约3~4 cm处穿线,结扎冠脉左前降支,同时将一根直径2 mm的聚乙烯管置于结扎线与冠脉之间,拉紧结扎线使管压迫冠脉引起冠脉闭塞,造成急性心肌缺血模型,观察心电图,以出现ST段显著抬高(抬高0.1 mV)为结扎成功标志。在缺血45 min后,取出聚乙烯管再灌注液体,以心脏表面颜色转红、抬高的ST段下降在1/2以上为再灌注成功标志,再灌注180 min。假手术组的动物手术过程与缺血再灌注组相同,但只穿线不结扎冠脉。
血清CK-MB、TNF-α和IL-10含量测定:再灌注3 h后,经腹主动脉穿刺抽血3 ml,离心分离出血清,按照CK-MB,TNF-α和IL-10的ELISA试剂盒说明书操作,用酶标仪在 450 nm处测吸光度(OD)值。根据标准品的浓度和OD值计算出标准曲线的回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品血清CK-MB、TNF-α和IL-10的实际浓度[9-11]。
TUNEL法检测细胞凋亡指数:再灌注3 h后迅速剪下心脏,置于磷酸盐缓冲液(PBS)中洗净残血,分离左心室前壁,于4%的多聚甲醛固定12 h,石蜡包埋。应用TUNEL 凋亡检测试剂盒,严格按照试剂盒说明书进行操作。主要流程如下: 切片脱蜡脱水;1%TritonX-100通透液促渗;3%H2O2封闭液封闭内源性过氧化酶(POD) 10 min;蛋白酶K通透30 min;加50 μl TdT反应液,37℃,1 h;加50 μl Streptavidin-FITC工作液,37℃避光反应30 min;加POD-conjugated Anti-FITC 50 μl ,37℃避光反应30 min;二氨基联苯胺(DAB)显色、苏木精复染、水洗、脱水透明、封片、镜检。每次试剂反应后均用PBS冲洗,每次5 ml,洗3次。上述步骤不加TdT 为阴性对照。光镜下正常心肌细胞核呈蓝色,凋亡细胞核为深浅不一的棕褐色,每张切片于缺血部位随机选取8 个高倍视野(×400 ) ,分别记数凋亡心肌细胞数和心肌细胞总数并进行汇总,以凋亡心肌细胞数占心肌细胞总数的百分比作为凋亡指数(AI)。

2 结果
藏红花酸对大鼠缺血再灌注后血清CK-MB、TNF-α与IL-10含量的影响: 与假手术组相比,缺血再灌注组及藏红花酸组CK-MB和TNF-α含量均明显升高(P<0.01),藏红花酸组IL-10含量也明显升高(P<0.01);而与缺血再灌注组相比,藏红花酸组CK-MB和TNF-α含量明显降低,IL-10含量明显升高(P<0.01)。表1
表1 各组大鼠血清CK-MB、TNF-α和IL-10含量比较
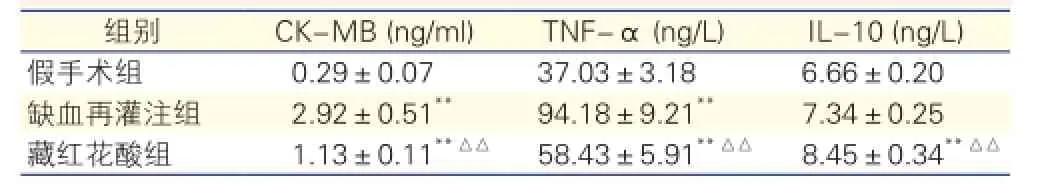
表1 各组大鼠血清CK-MB、TNF-α和IL-10含量比较
注: 与假手术组比较**P<0.01; 与缺血再灌注组比较△△P<0.01。 CK-MB:肌酸激酶MB同工酶 TNF-α:肿瘤坏死因子-α IL-10:白细胞介素-10
?
藏红花酸对缺血再灌注后心肌细胞凋亡的影响: TUNEL染色结果显示,与假手术组相比,缺血再灌注组及藏红花酸组心肌细胞凋亡指数明显增加(P<0.01);与缺血再灌注组相比,藏红花酸组凋亡指数明显降低(P<0.01),差异均有统计学意义。图1

图1 脱氧核苷酸末端转移酶介导的dUTP缺口末端标记检测大鼠心肌细胞凋亡
3 讨论
由于缺血性心脏病发病率和死亡率逐年增加,因此其关注度也逐年增加。心肌细胞凋亡和炎症反应已被认为是心肌缺血再灌注损伤的主要机制,最近的研究证据表明,缺血开始即启动心肌细胞凋亡,再灌注将其放大并部分有助于整体心肌的死亡[11]。阻断细胞凋亡过程可能会阻止收缩细胞的损失,最小化由缺血再灌注引起的心肌损伤,并延缓心肌顿抑和心力衰竭的发生[13,14]。同样,降低局部缺血损伤后再灌注过程中的炎症反应在许多研究中已被证实是有益的[15,16]。
在本研究中,与假手术组相比,缺血再灌注组和藏红花酸组的血清CK-MB浓度水平均升高,说明缺血再灌注可致心肌损伤,也说明我们的模型是成功的;而与缺血再灌注组相比,藏红花酸组的CK-MB浓度则显著降低,说明藏红花酸可以减轻采用结扎左前降支方法建立的大鼠心肌梗死模型的心肌缺血/再灌注损伤。其机制可能与抑制心肌细胞凋亡,减弱炎症反应可能有助于藏红花酸的心脏保护作用。
细胞凋亡是组织损伤继发于短暂缺血再灌注损伤的重要机制。在本研究中,TUNEL法被用来研究心肌细胞凋亡,通过DNA片段出现的多少来判断心肌细胞凋亡的多少。在缺血再灌注组缺血3小时后心肌细胞凋亡指数类似于先前研究报道的关于缺血再灌注损伤大鼠心肌细胞凋亡指数的数据[16]。经50 mg/kg藏红花酸预处理的藏红花酸组大鼠心肌的凋亡指数显著低于缺血再灌注组,这表明藏红花酸在再灌注的早期阶段的抗凋亡作用可能有助于以后心肌坏死的衰减。
急性心肌梗死后心肌坏死引起补体活化和自由基的产生,触发TNF-α从梗死心肌中释放。所分泌的TNF-α进一步刺激促炎细胞因子,如IL-1β、IL-6、趋化因子、黏附分子从浸润的白细胞和内皮细胞中释放,引发细胞因子级联反应。 促炎细胞因子,如IL-1β,IL-6和TNF-α,已成为心肌功能障碍的主要损害因子[17,18]。促炎细胞因子进一步促进炎症细胞粘附和浸润到心肌,并导致毛细血管阻塞、血管活性物质及细胞毒性成分的释放,最终引起急性组织损伤[19]。 但同时炎症也是心脏损伤修复的重要因素。IL-10 是一种分子量相当于18~21 kD的细胞因子;属于辅助性T细胞2类因子(Th2),
由各种淋巴细胞产生,在缺血再灌注损伤过程中,IL-10抑制活化的单核细胞,巨噬细胞合成多种细胞因子[IL-1、TNF-a、IL-6、粒细胞集落刺激因子(GM-CSF)及IL-8],调节中性粒细胞功能,诱导肥大细胞生长, 在下调炎症反应中发挥关键作用[20],是目前非常受关注的抗炎介质之一。
在本研究中,我们可以发现,与假手术组相比,藏红花酸组和缺血再灌注组的血清TNF-α和IL-10水平均显著增高,说明缺血再灌注可以激活机体的炎症反应。与缺血再灌注组比较,藏红花酸组血清TNF-α水平则显著降低,而IL-10的含量则显著升高,说明藏红花酸可以抑制TNF-α,促进IL-10的产生来减弱炎症反应,减轻其带来的炎症损害。因此,抑制炎症反应可能是藏红花酸保护心肌对抗缺血再灌注损伤的机制之一。
总之,本研究的突出发现是藏红花酸对缺血再灌注大鼠心肌有保护作用,其机制可能为抑制心肌细胞的凋亡和炎症反应能力。因此,藏红花酸的这一对缺血再灌注心肌的显著保护作用,具有很大的应用前景,值得进一步研究。
[1] Hausenloy DJ, Yellon DM. Myocardial ischemia-reperfusion injury: a neglected therapeutic target. J Clin Invest, 2013, 123: 92-100.
[2] Xie Z, Koyama T, Suzuki J, et al. Coronary reperfusionfollowingisehemia: different expression of bcl-2 and bax proteins, and cardimyoeyte apoptosis. Jpn Heart J, 2001, 42: 759-770.
[3] 赵亚玲, 敖虎山.心肌缺血再灌注损伤的研究进展.中国循环杂志, 2011, 5: 396-398.
[4] Steffens S, Montecucco F, Mach F. The inflammatory response as a target to reduce myocardial ischaemia and reperfusion injury. Thromb Haemost, 2009, 102: 240-247.
[5] Xiang M, Yang M, Zhou C, et al. Crocetin prevents AGEs-induced vascular endothelial cell apoptosis. Pharmacol Res, 2006, 54: 268-274.
[6] Yang R, Yang L, Shen X, et al. Suppression of NF-κB pathway by crocetin contributes to attenuation of lipopolysaccharide-induced acute lung injury in mice. Eur J Pharmacol, 2012, 674: 391-396.
[7] Wang Y, Yan J, Xi L, et al. Protective effect of crocetin on hemorrhagic shock-induced acute renal failure in rats. Shock, 2012, 38: 63-67.
[8] Cao F, Sun D, Li C, et al. Long-term myocardial functional improvement after autologous bone marrow mononuclear cells transplantation in patients with ST-segment elevation myocardial infarction: 4 years follow-up. Eur Heart J, 2009, 30: 1986-1994.
[9] Chang G, Zhang D, Yu H, et al. Cardioprotective effects of exenatide against oxidative stress-induced injury. Int J Mol Med, 2013, 32: 1011-1020.
[10] Fang J, Fan L, Chen L, et al. Coronary effluent from postconditioned hearts promotes survival of mesenchymal stem cells under hypoxia. Scand Cardiovasc J, 2014, 48: 120-127.
[11] Pavione MA, Carmona F, de Castro M, et al. Late remote ischemic preconditioning in children undergoing cardiopulmonary bypass: a randomized controlled trial. J Thorac Cardiovasc Surg, 2012, 144: 178-183.
[12] Fliss H, Gattinger D. Apoptosis in ischemic and reperfused rat myocardium. Circ Res, 1996, 79: 949-956.
[13] Anselmi A, Abbate A, Girola F, et al. Myocardial ischemia, stunning, inflammation, and apoptosis during cardiac surgery: a review of evidence. Eur J Cardiothorac Surg, 2004, 25: 304-311.
[14] 高妮妮, 王芳, 廉哲勋. P13K-Akt-eNOS信号通路在三磷酸腺苷后处理减轻兔心肌缺血再灌注损伤中的作用, 中国循环杂志, 2014, 29: 59-63.
[15] Bao W, Hu E, Tao L, et al. Inhibition of Rho-kinase protects the heart against ischemia/reperfusion injury. Cardiovasc Res, 2004, 61: 548-558.
[16] Sun D, Huang J, Zhang Z, et al. Luteolin limits infarct size and improves cardiac function after myocardium ischemia/reperfusion injury in diabetic rats. PLoS One, 2012, 7: e33491.
[17] Ahn J, Kim J. Mechanisms and consequences of inflammatory signaling in the Myocardium. Curr Hypertens Rep, 2012, 14: 510-516.
[18] Woldbaek PR, Tonnessen T, Henriksen UL, et al. Increased cardiac IL-18 mRNA, pro-IL-18 and plasma IL-18 after myocardial infarction in the mouse; a potential role in cardiac dysfunction. Cardiovasc Res, 2003, 59: 122-131.
[19] Liu X, Shen J, Jin Y, et al. Recombinant human erythropoietin (rhEPO) preconditioning on nuclear factor-kappa B (NF-kB) activation & proinflammatory cytokines induced by myocardial ischaemiareperfusion. Indian J Med Res, 2006, 124: 343-354.
[20] Frangogiannis NG, Mendoza LH, Lindsey ML, et al. IL-10 is induced in the reperfused myocardium and may moduiate the reaction to injury. J Immunoi, 2000, 165: 798-808.
Effect of Crocetin Pretreatment on Inflammatory Reaction and Apoptosis of Myocardial Ischemiareperfusion Injury in Experimental Rats
SUN Jing-wu, WANG Yan-yan, FANG Can.
Department of Cardiology, Affliated Yantai Hospital of Binzhou Medical College, Yantai (264100), Shandong, China
Objective: To explore the effect and mechanism of crocetin (CRO) pretreatment on inflammatory reaction and apoptosis of myocardial ischemia-reperfusion (I/R) injury in experimental rats.
Crocetin; Myocardial ischemia reperfusion injury; infammation; Apoptosis
2014-05-26)
(编辑:常文静)
264100 山东省烟台市 , 滨州医学院烟台附属医院 心内科(孙经武、王艳艳),消化内科(房灿)
孙经武 主任医师 教授 硕士研究生导师 主要从事心血管疾病的基础与临床研究 Email: bysjw@163.com 通讯作者:孙经武
R54
A
1000-3614(2015)02-0172-04
10.3969/j.issn.1000-3614.2015.02.019
