水稻OsGASR4基因及其启动子的克隆与表达分析
2015-12-14刘秋华彭建宗王小菁
刘秋华,罗 曼,彭建宗,王小菁*
(1.广东省植物发育生物工程重点实验室,华南师范大学生命科学学院,广州510631;2.广东新安职业技术学院,深圳518052)
GAST(GA-stimulated transcript)是受GA 诱导的一类植物基因家族. 该基因家族编码蛋白的氨基酸序列具有3个区域:(1)N 端信号肽区域,长度约18~29 AA;(2)中间长度不等的亲水区域;(3)C 端高度保守的GASA 区域(在固定位置包含12个半胱氨酸),长度约60 AA[1]. Shi 等[2]首次在番茄(Solanumlycopersicum)GA-缺失突变体中发现GAST1,之后陆续从拟南芥(Arabidopsis thaliana)[3-6]、矮牵牛(Petunia hybrida)[7-8]、马铃薯(Solanumtuberosum)[9-10]、草 莓(Fragariaananassa)[11-12]、非 洲 菊(Gerbera hybrida)[13-14]、水稻(Oryza sativa)[15-16]、玉米(Zea mays)[17]等植物中克隆得到GAST1 同源基因. 已知,拟南芥GASA 家族有14个成员[5].GAST 的时空表达和调控呈现多样、复杂的特征,在植物生长发育和调控中发挥着重要的作用[18].
水稻是世界上重要的粮食作物和单子叶模式植物,研究GAST 在水稻中的功能为认识赤霉素信号转导途径及其调控水稻的生长发育分子机制,指导水稻分子育种,具有重要的科学理论和生产实践意义.实验室前期工作从水稻中克隆了一个GAST 基因家族新成员OsGASR4,本文分析了OsGASR4 的时空表达模式转录调控模式,为深入阐明OsGASR4 在水稻中的生物学功能提供有用信息和线索.
1 材料与方法
1.1 材料与处理
实验材料为水稻日本晴品种(Oryza sativa Japonica Group)和赤霉素缺乏突变体d-18[19],种子由中国水稻所钱前老师提供.
选取14 d 水稻幼苗的根、茎节、叶,成熟期的旗叶、叶鞘,以及抽穗前期和抽穗后5 d 的颖花和花梗等,用于总RNA 提取,检测OsGASR4 基因时空表达.
1.2 GA3 处理
挑选种子,在25 ℃培养箱中萌发,选取15 d 龄的水稻野生型和d-18 突变体幼苗,分别用含有50 μmol/L GA3的木村B 培养液培养2 h,用液氮冷冻保存,用于总RNA 提取.
1.3 序列分析
在NCBI 利用BLAST 检索OsGASR4 的同源蛋白质序列,采用DNAMAN 软件进行多重序列比对和同源性分析. 克隆OsGASR4 启动子序列,利用植物顺式作用元件数据库PLACE(http://www. dna. affrc. go. jp/PLACE)分析启动子区域中的顺式作用元件.
1.4 OsGASR4 基因表达检测
按照华越洋生物科技有限公司提供的小量植物RNA 提取试剂盒提取样品RNA,分别取1 μg 总RNA 进行反转录,反转录体系和操作参照Prime-ScriptTMRT Reagent Kit 说明书. 引物合成由上海生物工程公司完成.OsGASR4 及Actin 内参基因引物序列:OsGASR4-F:5'-CACTCATCTCCTCACCGTGTTTGTTAG-3';OsGASR4-R:5'-CAACGCTATCAATCACACTACTACCACG-3';OsActin-F:5'-GATGACCCAGATCATGTTTG-3';OsActin-R:5'-TCCTTGCTCATCCTGTCAG-3'.其他常规试剂均为国产分析纯.
PCR 反应体系为10 μL,PCR 反应程序:94 ℃变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,循环30 次(OsActin 扩增循环25 次);72 ℃延伸10 min,PCR 产物用1%琼脂糖凝胶电泳进行检测.
1.5 OsGASR4 启动子克隆及农杆菌介导转化水稻
根据序列比对和预测的结果,设计引物:F:5'-CCTTCAGTTTAGCTTGCAAAGACAGGTAATACACACCATATTTCC-3';R:5'-AGATCTACCATGGTCAAGCTTCTCTTGATCCTTTTGAGCTCTAACAAAC-3'. 以水稻基因组DNA 为模板,以高保真的Taq 酶进行PCR扩增,扩增参数为:94 ℃预变性3 min;94 ℃变性45 s;55 ℃退火45 s;72 ℃延伸1 min,30个循环;72 ℃延伸10 min. 琼脂糖凝胶回收PCR 扩增产物直接送生工生物工程(上海)股份有限公司测序.后转接到pCAMBIA1301 载体上,表达载体结构如图1.应用农杆菌介导水稻遗传转化,以胚性愈伤为转化受体材料,农杆菌(OD≈1.0)侵染30 min,共培养3 d 后潮霉素连续筛选2 次(2 周为1 次),转移抗性愈伤进行预分化、分化、生根并移栽再生苗.
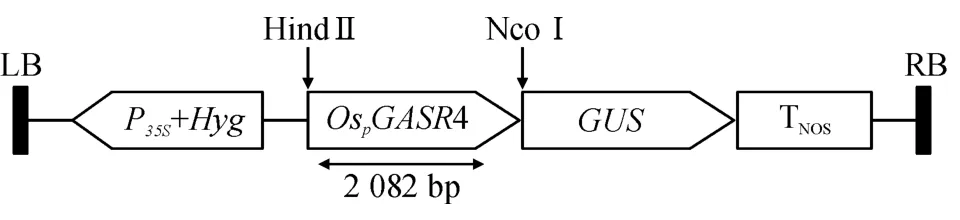
图1 OsPGASR4::GUS 表达载体的构建Figure 1 Structure of OsPGASR4::GUS expression vector
1.6 GUS 基因表达的组织化学检测
选取OsPGASR4::GUS 转基因水稻各个生长时期的组织材料,放入15 mL 离心管中,加入GUS 染色液(50 mmol/L 磷酸盐缓冲液,pH 7.0;10 mmol/L Na2EDTA;0.1% Triton X100;0.85 g/L 亚铁氰化钾;0.65 g/L 铁氰化钾;100 mg/L 氯霉素;1 g/L Xgluc),37 ℃放置过夜,然后用体积分数为75%酒精脱色,观察拍照.
2 结果与分析
2.1 GASA 类蛋白系统进化树
将OsGASR4 的蛋白质序列与已报道的GASA类蛋白进行多重比对,表明OsGASR4 蛋白具有典型的GASA 结构域(图2).利用DNAMAN 软件将上述蛋白质进行系统进化分析,进化树如图3 所示.在已研究的GAST 家族成员中,其中OsGASR4 则与Os-GASR1、SNAKIN-1 同源性最高,处于同一个小分枝上,与SNAKIN-1 相似性最高,为41.75%.

图2 GASA 类蛋白相似性分析Figure 2 Similarity analysis of GASA-like proteins
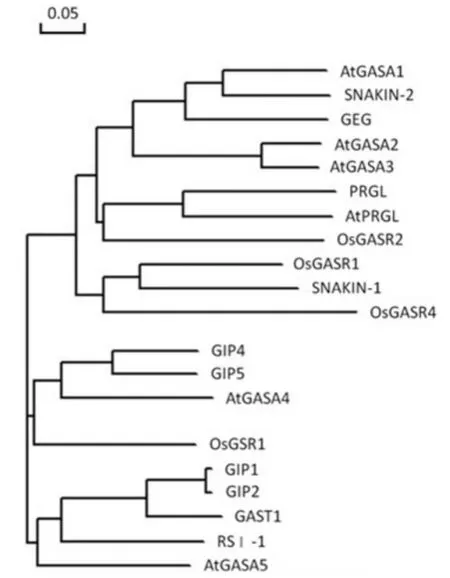
图3 GASA 类蛋白系统进化树Figure 3 The phylogenetic tree of GASA-like proteins
2.2 GA3 影响水稻幼苗OsGASR4 表达
用50 μmol/L 的GA3处理野生型和d-18 突变体水稻幼苗2 h,检测OsGASR4 基因表达水平,结果(图4)显示,在野生型和d-18 幼苗中OsGASR4 表达均受到GA 抑制,GA3处理后表达量均分别下调了40%和42%.
2.3 OsGASR4 在水稻的时空表达
选取水稻日本晴不同发育时期的组织和器官,包括14 d 幼苗的根、茎、叶,成熟期的旗叶、叶鞘,以及抽穗前期(BH,Before Heading)和抽穗后5 d(5 DAH,5 Days After Heading)的颖花和花梗,用于总RNA 提取,检测基因的表达水平(图5).
在水稻营养生长阶段,OsGASR4 在营养生长期14 d 苗的茎节中表达较强. 水稻进入生殖生长期后,OsGASR4 在抽穗前期(孕穗期)的颖花和花梗中都有表达,抽穗后期(5 DAH)只在颖花中表达.以上结果说明OsGASR4 基因的表达在时空上存在特异性.
2.4 OsGASR4 启动子序列分析与克隆
为了更进一步探究OsGASR4 的转录调控模式,我们克隆了OsGASR4 的启动子(ATG 起始密码子上游2 082 bp).利用数据库PLACE 分析启动子区域的顺式作用元件(表1),发现OsGASR4 启动子含有启动子基本元件CAAT BOX,但不含TATA BOX.另外,除了保守的顺式元件,OsGASR4 基因启动子内还有一些其他顺式元件,如GA、ABA 响应元件、核心序列为TGAC 的WRKY710S 元件、种子特异性元件、植物组织相关元件、光、干旱、寒冷、机械损伤、热激等环境因素相关元件等.
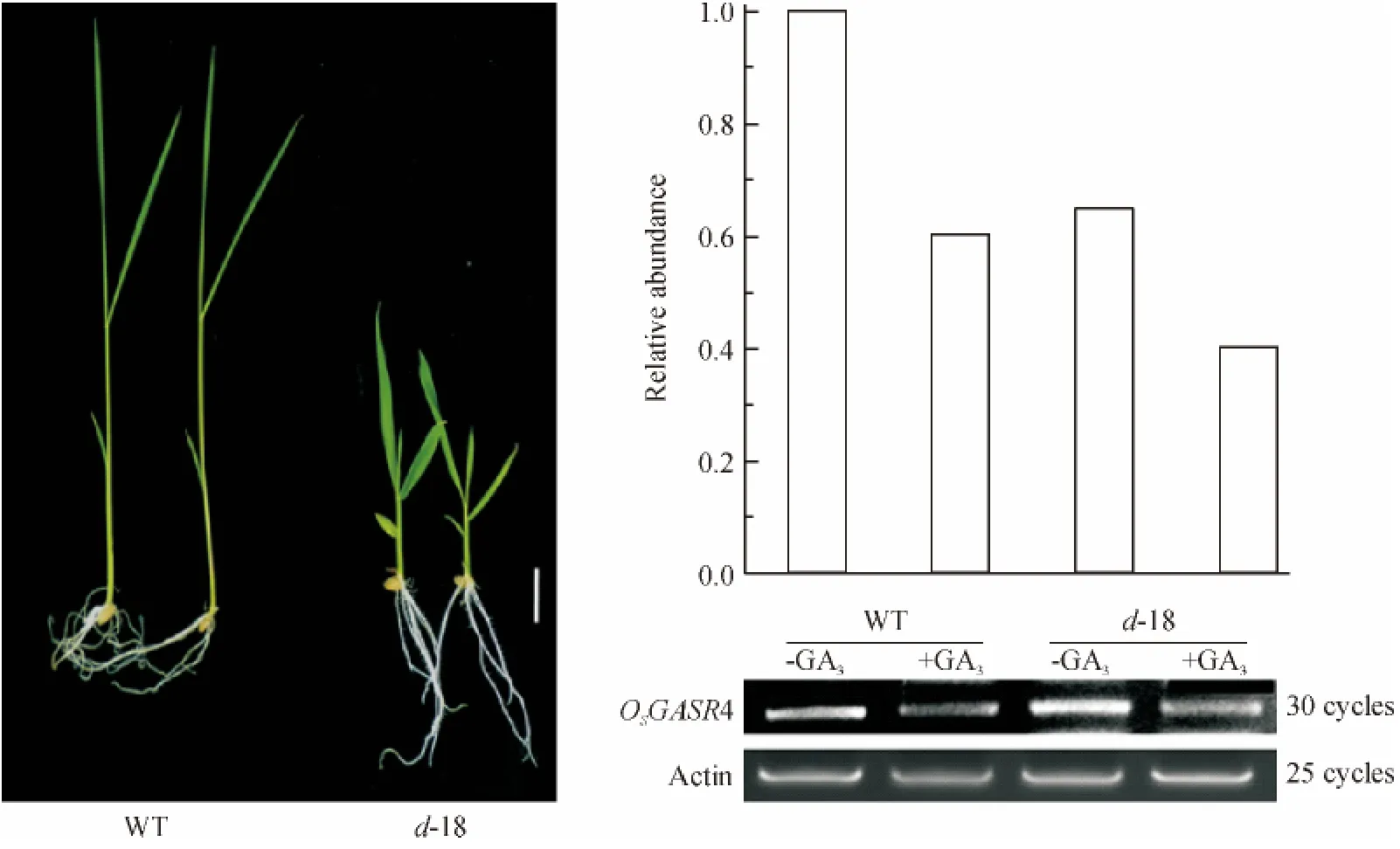
图4 GA3 处理野生型和d-18 突变体幼苗2 h OsGASR4 表达分析Figure 4 Expression of OsGASR4 in seedlings of wild-type and mutant d-18 of rice treated by GA3 for 2 h

图5 OsGASR4 在水稻中的表达模式Figure 5 Expression pattern of OsGASR4 in rice
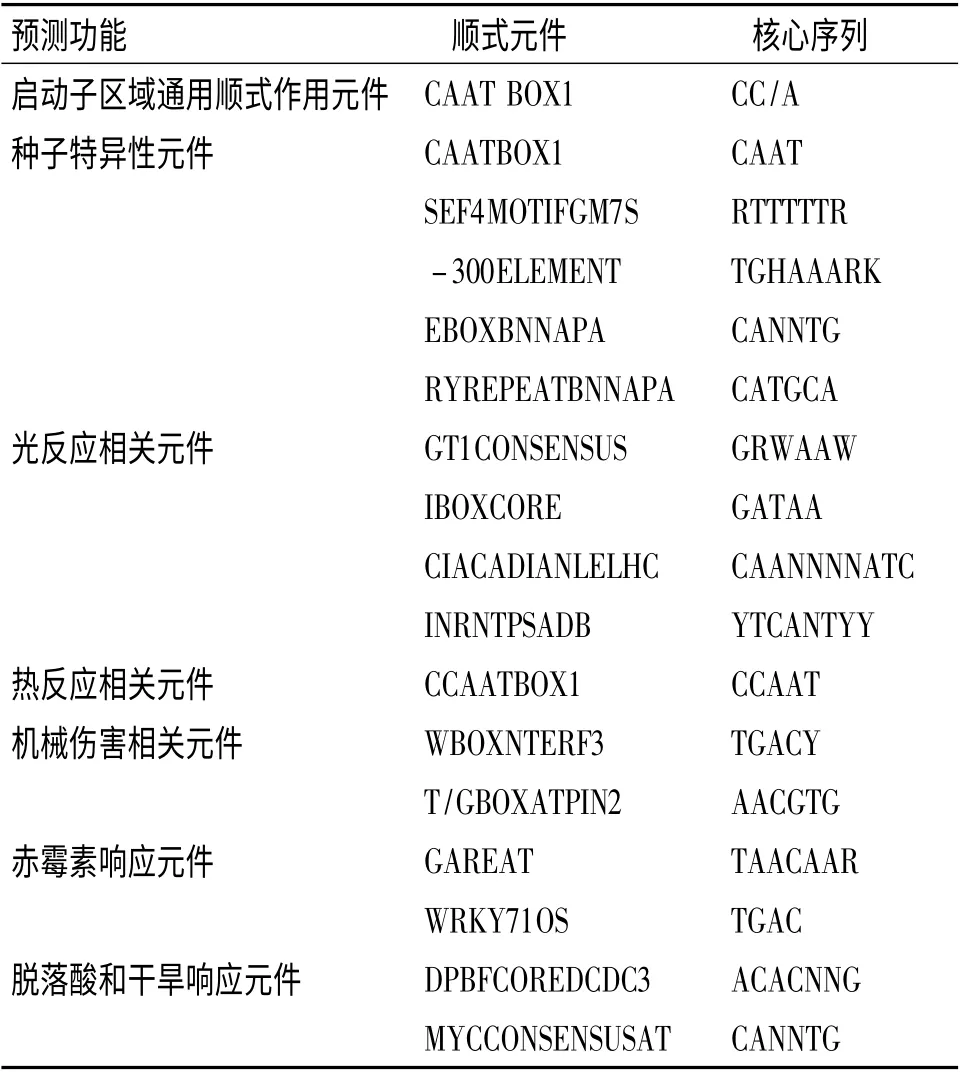
表1 水稻OsGASR4 启动子中的顺式原件预测Table 1 Predicted cis-elements in the promoter of rice OsGASR4
以水稻基因组DNA 为模板,PCR 扩增后回收扩增片段,测序结果显示,获得了长度为2 082 bp 的OsGASR4 上游调控序列.
2.5 OsGASR4 启动子驱动GUS 基因在水稻中的表达
利用农杆菌介导水稻日本晴遗传转化,共获得30 株OsPGASR4::GUS T0转基因植株,PCR 检测后25 株为阳性. 以阴性植株为对照,分别选取阳性植株和阴性植株的的根、茎、叶、鞘、穗,分析GUS 组织化学染色情况(图6). 结果表明,水稻OsGASR4 启动子在侧根、茎、叶、叶鞘、花丝、幼穗的枝梗和颖壳中都有表达,其中在茎和幼穗中的表达较强.
3 讨论

图6 转OspGASR4 基因植株GUS 组织化学检测Figure 6 Histochemical GUS staining of tissues from transgenic rice expressing OspGASR4
GAST 家族蛋白在多种双子叶植物和单子叶植物中均有报道.例如,番茄中RSI-1 基因参与了根的发育[22].AtGASA4 在拟南芥的花芽中表达,可能与细胞分裂有关[1]. 草莓中FaGAST 基因在成熟的果实 中大量表达[11]. 玉米ZmGSL1 参与了侧根的生成[17].从OsGASR4 蛋白质与报道的GAST 类蛋白进行多重序列比对结果看出(图2),GAST 蛋白的C末端含有保守的、典型的GAST 结构域,在进化过程中该区域内的12 半胱氨酸位置高度保守,可能决定了该类蛋白在结构或功能的生化方面角色;GAST蛋白的N 末端,氨基酸组成和数目多变,可能是促成GAST 蛋白功能多样性的结构基础. 在系统发育树上OsGASR1 和马铃薯SNAKIN-1 与水稻OsGASR4位于同一亚组,同源性最高.OsGASR1 参与了细胞的增殖,在水稻叶及茎的分生组织和穗部表达水平高[15],结合图OsGASR4 表达模式(图5)和转Osp-GASR4 基因植株GUS 组织化学染色(图6)可以看出OsGASR4 在茎和幼穗中表达量相对较高.植物病原菌可以诱导马铃薯SNAKIN-1 的表达[10],而Os-GASR4 也可能参与了水稻的抗病信号转导途径. 因此推测OsGASR4 可能在水稻圆锥花序发育及水稻病虫害防御中发挥作用.
GAST 基因家族成员表达受外源GA 调控,出现3 种情况,拟南芥AtGASA1、AtGASA4、AtGASA6、AtGASA7、AtGASA8、AtGASA13 和AtGASA14[4-6],山毛榉FsGASA4[20],矮牵牛GIP1、GIP2、GIP4 和GIP5[7],水稻OsGSR1、OsGASR1 和OsGASR2[15-16]和 玉 米ZmGSL1[17]基因转录水平受GA 诱导上调.第2 种情况是,GA 处理下调拟南芥AtGASA5,AtGASA9,AtGASA11[6]和马铃薯SNAKIN-2[9]基因的表达. 而AtGASA10 和AtGASA12 基因表达不受GA 处理的影响[6].
另外ABA 处理诱导AtGASA2、AtGASA3 和AtGASA14 基因表达,AtGASA9 转录水平则受ABA 抑制[21].OsGSR1 转录水平同时受GA 和BR 影响,介导了GA 信号途径和BR 信号途径的交叉[16]. Os-GASR4 启动子顺式元件存在GA 响应元件,野生型和GA 缺失的d18 突变体经GA 处理后OsGASR4 转录水平出现下降(图4),表明该基因表达与内源GA水平无关,其编码蛋白可能作为负调控因子参与GA 信号途径的调控. OsGASR4 启动子中同时存在ABA 响应元件、光调控响应元件以及伤害诱导响应元件等,暗示其可能调节多种信号转导通路并以此调控水稻多个生长发育过程.水稻OsGASR4 基因的功能有待于利用正向和反向遗传学技术并结合生物化学和细胞生物学方法进一步验证.
[1]Aubert D,Chevillard M,Dorne A M,et al. Expression patterns of GASA genes in Arabidopsis thaliana:The GASA4 gene is up-regulated by gibberellins in meristematic regions[J]. Plant Molecular Biology,1998,36:871 -883.
[2]Shi L,Gast R T,Gopalraj M,et al. Characterization of a shoot-specific,GA3-and ABA-regulated gene from tomato[J]. Plant Journal,1992,2:153 -159.
[3]Peng J Z,Lai L J,Wang X J. PRGL:A cell wall proline-rich protein containning GASA domain in Gerbera hybrida[J]. Science in China Series C-life Sciences,2008,51:520 -525.
[4]Herzog M,Dorne A M,Grellet F. GASA,a gibberellinregulated gene family from Arabidopsis thaliana related to the tomato GAST1 gene[J]. Plant Molecular Biology,1995,27:743 -752.
[5]Roxrud I,Lid S E,Fletcher J C,et al. GASA4,one of the 14-member Arabidopsis GASA family of small polypeptides,regulates flowering and seed development[J].Plant Cell Physiology,2007,48:471 -483.
[6]Sun S,Wang H,Yu H,et al. GASA14 regulates leaf expansion and abiotic stress resistance by modulating reactive oxygen species accumulation[J]. Journal of Experimental Botany,2013,64:1637 -1647.
[7]Ben-Nissan G,Lee J Y,Borohov A,et al. GIP,a Petunia hybrida GA-induced cysteine-rich protein:a possible role in shoot elongation and transition to flowering[J].Plant Journal,2004,37:229 -238.
[8]Ben-Nissan G,Weiss D. The petunia homologue of tomato gast1:transcript accumulation coincides with gibberellin-induced corolla cell elongation[J]. Plant Molecular Biology,1996,32:1067 -1074.
[9]Berrocal-Lobo M,Segura A,Moreno M,et al. Snakin-2,an antimicrobial peptide from potato whose gene is locally induced by wounding and responds to pathogen infection[J]. Plant Physiology,2002,128:951 -961.
[10]Segura A,Moreno M,Madueno F,et al. Snakin-1,a peptide from potato that is active against plant pathogens[J]. Molecular Plant-microbe Interactions,1999,12:16-23.
[11]De La Fuente J I,Amaya I,Castillejo C,et al. The strawberry gene FaGAST affects plant growth through inhibition of cell elongation[J]. Journal of Experimental Botany,2006,57:2401 -2411.
[12]Moyano-Canete E,Bellido M L,Garcia-Caparros N,et al. FaGAST2,a strawberry ripening-related gene,acts together with FaGAST1 to determine cell size of the fruit receptacle[J]. Plant Cell Physiology,2013,54:218 -236.
[13]Kotilainen M,Helariutta Y,Mehto M,et al. GEG participates in the regulation of cell and organ shape during corolla and carpel development in gerbera hybrida[J].Plant Cell,1999,11:1093 -1104.
[14]Peng J Z,Lai L J,Wang X J. PRGL:A cell wall proline-rich protein containning GASA domain in Gerbera hybrida[J]. Science in China Series C-life Sciences,2008,51:520 -525.
[15]Furukawa T,Sakaguchi N,Shimada H. Two OsGASR genes,rice GAST homologue genes that are abundant in proliferating tissues,show different expression patterns in developing panicles[J]. Genes & Genetic Systems,2006,81:171 -180.
[16]Wang L,Wang Z,Xu Y Y,et al. OsGSR1 is involved in crosstalk between gibberellins and brassinosteroids in rice[J]. Plant Journal,2009,57:498 -510.
[17]Zimmermann R,Sakai H,Hochholdinger F. The gibberellic acid stimulated-like gene family in maize and its role in lateral root development[J]. Plant Physiology,2010,152:356 -365.
[18]Nahirñak V,Almasia N,Hopp H E,et al. Snakin/GASA proteins:Involvement in hormone crosstalk and redox homeostasis[J]. Plant Signal Behavior,2012,7:1004-1008.
[19]Itoh H,Ueguchi-Tanaka M,Sentoku N,et al. Cloning and functional analysis of two gibberellin 3 beta-hydroxylase genes that are differently expressed during the growth of rice[J]. Proceedings of the National Academy of Sciences,2001,98:8909 -8914.
[20]Alonso-Ramirez A,Rodriguez D,Reyes D,et al. Evidence for a role of gibberellins in salicylic acid-modulated early plant responses to abiotic stress in Arabidopsis seeds[J]. Plant Physiology,2009,150:1335 -1344.
[21]Zhang S C,Wang X J. Expression pattern of GASA,downstream genes of DELLA,in Arabidopsis[J]. Chinese Science Bulletin,2008,53:3839 -3846.
