锂源对固相合成LiNi0.5Co0.2 Mn0.3 O2正极材料性能的影响
2015-12-14赵瑞瑞杨子莲陈占军李爱菊陈红雨
赵瑞瑞,杨子莲,杜 鹏,陈占军,李爱菊,陈红雨
(华南师范大学化学与环境学院,广州510006)
Li[Ni0.5Co0.2Mn0.3]O2是近年来镍钴锰三元正极材料中的热点材料,具有高比容量、良好循环性能和高安全性等优点,其Ni 含量较高,Co、Mn 含量相对较低,在材料成本方面较传统的LiNi1/3Co1/3Mn1/3O2三元材料有竞争优势,在EV 和HEV 等高功率锂离子电池应用中具有良好前景. 正极材料的电化学性能从很大程度上依赖于材料微观结构,如:过渡金属离子的分布情况、颗粒形貌、大小等. 不同的合成方法对产物的结晶度、相纯度、颗粒形貌、晶粒尺寸、表面积、离子分布的影响也不同.目前文献报道合成正极材料Li[Ni0.5Co0.2Mn0.3]O2的方法主要有固相法、共沉淀法、水热法、溶胶凝胶法等,其中共沉淀法合成的材料性能良好、均一稳定,是实验室和工业生产中常用的最佳合成方法.
此外,共沉淀法后续的高温煅烧工艺条件影响着最终合成产物的晶形结构、组成、形貌和电化学性能.合适的锂源对制备Li[Ni0.5Co0.2Mn0.3]O2具有非常重要的意义[1-4],本章采用氢氧化物共沉淀法合成前驱体Ni0.5Co0.2Mn0.3(OH)2,并通过固相高温烧结制得正极材料Li[Ni0.5Co0.2Mn0.3]O2,探讨了高温烧结工艺中锂源、对材料结构、形貌及电化学性能的影响,并对其影响机理进行了探究.
1 实验部分
1.1 材料制备
分别称取一定量的NiSO4·6H2O、CoSO4·7H2O、MnSO4·H2O 按物质的量计量比5∶2∶3 配成1 mol/L 的混合盐溶液,以2 mol/L 的NaOH 为沉淀剂,氨水为络合剂,在1 000 r/min、50 ℃下连续反应,控制pH 在11.0 左右,共沉淀反应生成前驱体悬浊液.经陈化10 h 后用循环真空泵抽滤,并用蒸馏水洗涤3 次,置放于电热恒温鼓风干燥箱中在80 ℃下干燥12 h,即得到前驱体Ni0.5Co0.2Mn0.3(OH)2.
使用LiOH·H2O、Li2CO3和CH3COOLi 分别作为锂源,按照锂源与共沉淀制得的前驱体Ni0.5Co0.2Mn0.3(OH)2物质的量比为1.04 的比例混合,球磨均匀,置于马弗炉中,500 ℃预烧5 h,830 ℃高温烧结15 h 后合成产物Li[Ni0.5Co0.2Mn0.3]O2,所得样品分别记为NCM-Q、NCM-T、NCM-C.
1.2 材料表征
采用元素分析(ICP)确定材料中元素含量,利用Bruker D8 Advance 型X 射线粉末衍射仪对材料的晶体结构进行表征,采用ZEISS Ultra 55 型场发射扫描电子显微镜观察粉末试样的微观形貌和粒子粒径大小.
1.3 电化学性能测试
将材料组装成扣式电池进行电化学测试,其中正极片的制备采用活性物质、乙炔黑以及PVDF 按照8∶1∶1 的比例.电解液采用三元材料专用电解液,隔膜采用多孔聚丙烯隔膜(Celgard 2400),采用恒流/恒压和恒流放电的充放电制度对材料进行充放电测试,充放电电压范围为2.5 ~4.3 V.
2 结果与讨论
采用ICP 元素分析的方法测试以氢氧化锂为锂源时得到产物(表1).3 种金属元素Ni、Co、Mn 物质量的比值接近5∶2∶3,因此可以将前驱体化学式确定为Ni0.5Co0.2Mn0.3(OH)2.

表1 产物中3 种金属元素含量Table 1 The contents of the three metal elements in the final product
图1 表明所有样品均为典型α-NaFeO2型结构,空间群为Rm,六方晶格. 其中样品NCM-Q 的主要衍射峰(003)、(101)、(006)、(102)、(104)、(105)、(107)、(108)、(110)、(113)与α-NaFeO2的衍射峰相符,无杂质峰出现,且(006)/(102)、(108)/(110)衍射峰分裂完全,表明以LiOH·H2O 为锂源合成的Li[Ni0.5Co0.2Mn0.3]O2结晶良好[1]. 相比之下,样品NCM-T 和NCM-C 的衍射峰不及样品NCMQ 的尖锐,样品NCM-T 的谱图中出现了微量的杂质峰,样品NCM-C 的(006)/(102)衍射峰分裂不是很明显,说明以LiOH·H2O 为锂源合成的产物与以Li2CO3和CH3COOLi 为锂源合成的产物相比,其层状结构发育较为完整.

图1 不同锂源制备的Li[Ni0.5Co0.2Mn0.3]O2 的XRDFigure 1 X-ray diffraction patterns of Li[Ni0.5 Co0.2 Mn0.3]O2 prepared using different lithium salts
图2 表明,利用扫描电镜观察样品的表面形态,发现所有样品大都是由一次粒子团聚形成的类球形颗粒,一次粒子间的紧密堆积,不仅有利于加快充放电时锂离子在固相中的扩散速率,减少极化,提高材料的可逆容量和倍率性能,而且还有利于提高材料的振实密度[2].样品采用LiOH·H2O 为锂源制备的样品与其他样品相比表面更致密,预示着该材料的振实密度较高.
样品NCM-Q(即使用LiOH·H2O 制备的Li[Ni0.5Co0.2Mn0.3]O2)与其他样品相比,具有较高的充放电比容量(图3),首次放电比容量为172.7 mAh/g,库伦效率达89.08%. 而样品NCM-T(以Li2CO3为锂源)和NCM-C(以CH3COOLi 为锂源)的首次放电比容量与库伦效率分别为162.2 mAh/g(84.32%)、156.4 mAh/g(88.08%). 以CH3COOLi为锂源制备的样品的放电容量较低可能是因为样品的晶型结构不佳所造成的.

图2 不同锂源制备的Li[Ni0.5Co0.2Mn0.3]O2 的形态Figure 2 Shape of Li[Ni0.5Co0.2Mn0.3]O2prepared using different lithium salts

图3 不同锂源制备的Li[Ni0.5 Co0.2 Mn0.3]O2 在0.1C 倍率下的首次充放电曲线Figure 3 First charge/discharge curves at 0. 1C of Li[Ni0.5 Co0.2Mn0.3]O2prepared using different lithium salts
图4 和表2 分别呈现不同锂源制备的Li[Ni0.5Co0.2Mn0.3]O2在0.5C、1C 倍率下的循环性能曲线和数据. 无论是在0.5C 还是1C 倍率下,各样品的容量保持率为NCM-Q >NCM-T >NCM-C. 以样品NCM-Q(以LiOH·H2O 为锂源)的容量保持率最高,在1C 倍率下的首次充放电容量为154.0 mAh/g,循环50 次后其放电比容量为136.2 mAh/g(保持率为93.03%).而样品NCM-T 和NCM-C 循环后的放电比容量分别为91.7 mAh/g(保持率为75.29%)、87.9 mAh/g(保持率为75.06%). 综合而言,以LiOH·H2O 为锂源制备的样品的电化学性能较好.
在循环伏安曲线中(图5).使用不同锂源制备的Li[Ni0.5Co0.2Mn0.3]O2的所有样品在3.6 ~4.0 V 之间出现了1 对氧化还原峰,对应于Li[Ni0.5Co0.2Mn0.3]O2材料内的锂离子脱嵌过程中Ni2+/Ni4+的氧化还原反应[5-6].在循环伏安曲线中,氧化峰对应于锂离子的脱出,还原峰对应于锂离子的嵌入,氧化峰和还原峰之间的电压差反映了反应过程的可逆程度和极化作用的强弱,差值越小,极化作用越弱.电压差用ΔE表示,在图中列有具体数值. 图中样品NCM-Q(以LiOH·H2O 为锂源)的氧化还原峰峰强较大,电压差最小,ΔE=Epa-Epc=0.17 V,电化学反应过程中发生的极化最小,样品NCM-T 和NCM-C 的ΔE 分别为0.24、0.33 V.因而说明样品NCM-Q 可逆程度较高,具有较好的电化学性能.

图4 不同锂源制备的Li[Ni0.5Co0.2Mn0.3]O2 在不同倍率下的循环性能Figure 4 Cycling performance at different C-rate of Li[Ni0.5Co0.2Mn0.3]O2 prepared using different lithium salts

表2 不同锂源制备的Li[Ni0.5Co0.2Mn0.3]O2 电化学性能Table 2 Electrochemical performance comparison of Li[Ni0.5Co0.2Mn0.3]O2prepared using different lithium salts
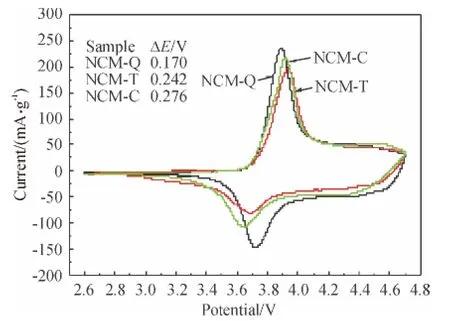
图5 不同锂源制备的Li[Ni0.5Co0.2Mn0.3]O2 循环电流Figure 5 CV curves of Li[Ni0.5 Co0.2 Mn0.3]O2 prepared using different lithium salts
图6 所示为不同锂源制备的Li[Ni0.5Co0.2Mn0.3]O2在1C 循环前和循环50 次后的交流阻抗谱图.一般来说交流阻抗图分为3个部分,由2个半圆弧和1 条斜线组成:高频区半圆弧反映Li+在界面膜中迁移,对应于Li+通过界面膜(SEI 膜)的阻抗;中频区半圆弧反映Li+在表面膜和活性物质的界面发生电子交换,对应于电荷传递阻抗以及电极/溶液界面的双电层电容;低频区的斜线反映Li+在固体中的扩散,对应着锂离子在固体晶格中的扩散能力,即Warburg 阻抗[7-10].

图6 不同锂源制备的Li[Ni0.5Co0.2Mn0.3]O2 的交流阻抗图:(A、B)循环测试前;(C、D)1C 倍率下循环50 次后(其中,B、D分别是A、C 的低频放大部分)Figure 6 Electrochemical impedance spectra (EIS)spectra of Li[Ni0.5 Co0.2 Mn0.3]O2 prepared using different lithium salts:before the electrochemical test (A、B);after 50 cycles of 1C cycling capability test (C、D)
图6 中,交流阻抗曲线由高频区的半圆和低频区的斜线组成,分别对应着电解液-电极界面的电荷转移过程以及锂离子在电极本体中的扩散. 其中高频区半圆半径代表了电荷转移电阻. 所有样品的阻抗在循环测试后变小,这可能是因为在深度充放电循环后锂金属表面钝化层遭到破坏,更有利于锂离子的传导[11-12]. 图中可以很明显的得出,无论是循环测试前还是1C 倍率循环50 次后,材料的阻抗大小顺序为:NCM-Q >NCM-T >NCM-C,以样品NCM-Q(以LiOH·H2O 为锂源)的电阻最小,预示着样品具有良好的电化学性能,这也与前文的充放电测试结果保持一致.
3 结论
采用氢氧化物共沉淀法合成前驱体Ni0.5Co0.2Mn0.3(OH)2,并使用高温固相法烧结制得正极材料LiNi0.5Co0.2Mn0.3O2,通过XRD、SEM、电化学性能测试、CV、EIS 等测试手段,探讨高温烧结工艺中不同锂源对材料结构、形貌及电化学性能的影响,结果表明使用LiOH·H2O 与使用Li2CO3和CH3COOLi 作为锂源合成的材料相比,具有较好的层状结构和电化学性能:阳离子混排程度较少,在0.1C 倍率下的首次充放电容量和库伦效率较高(172.7 mAh/g,89.08%),在0.5C、1C 倍率下循环50 次后,材料的放电容量仍保持在144.5 mAh/g 和136.2 mAh/g.
[1]Liu T,Zhao S X,Wang K,et al. CuO-coated Li[Ni0.5Co0.2Mn0.3]O2cathode material with improved cycling performance at high rates[J]. Electrochimica Acta,2012,85:605-611.
[2]Song H G,Park K S,Park Y J. The effects of LaPO4coating on the electrochemical propertiesof Li[Ni0.5Co0.2Mn0.3]O2cathode material[J].Solid State Ionics,2012,225:532-537.
[3]Kim W S,Kim S B,Jang I C,et al. Remarkable improvement in cell safety for Li[Ni0.5Co0.2Mn0.3]O2coated with LiFePO4[J]. Journal of Alloys and Compounds,2010,492(2010):L87-L90.
[4]Liu W,Wang M,Gao X l,et al. Improvement of the high-temperature,high-voltage cycling performance of LiNi0.5Co0.2Mn0.3O2cathode with TiO2coating[J]. Journal of Alloys and Compounds,2012,543:181-188.
[5]Jin Y,Li N,Chen C H,et al. Electrochemical characterizations of commercial LiCoO2powders with surface modified by Li3PO4nanoparticles[J]. Electrochemical and Solid-State Letters,2006,9(6):A273-A276.
[6]Seki S,Kobayashi Y,Miyashiro H. Fabrication of highvoltage,high-capacity all-solid-state lithium polymer secondary batteries by application of the polymer electrolyte/inorganic electrolyte composite concept[J]. Chemistry of Materials,2005,17:2041-2045.
[7]Li X,Yang R,Cheng B,et al. Enhanced electrochemical properties of nano-Li3PO4coated on the LiMn2O4cathode material for lithium ion battery at 55 ℃[J].Materials Letters,2012,66(1):168-171.
[8]Zhao S X,Ding H,Wang Y C,et al. Improving rate performance of LiFePO4cathode materials by hybrid coating of nano-Li3PO4and carbon[J].Journal of Alloys and Compounds,2013,566:206-211.
[9]Miyashiro H,Seki S,Kobayashi Y,et al. All-solid-state lithium polymer secondary battery with LiNi0.5Mn1.5O4by mixing of Li3PO4[J]. Electrochemistry Communications,2005,7(11):1083-1086.
[10]Zhang Z,Li G,Peng H,et al. Hierarchical hollow microspheres assembled from N-doped carbon coated Li4Ti5O12nanosheets with enhanced lithium storage properties[J]. Journal of Materials Chemistry A,2013,1(48):15429-15434.
[11]Kobayashi T,Kobayashi Y,Tabuchi M,et al. Oxidation reaction of polyether-based material and its suppression in lithium rechargeable battery using 4V class cathode,LiNi1/3Mn1/3Co1/3O2[J]. ACS Applied Materials and Interfaces,2013,5:12387-12393.
[12]Jiang K C,Wu X L,Yin Y X,et al. Super hybrid cathode material containing lithium-excess layered material and graphene for lithium-ion batteries[J],ACS Applied Materials and Interfaces,2012,4:4858-4863.
