顶空固相微萃取-气相色谱-质谱法检测大豆根中茉莉酸甲酯水平
2015-12-14赵桂兰庞世敏
袁 敏 ,赵桂兰,庞世敏
(1.华南师范大学实验中心,广州510006;2.华南师范大学化学与环境学院,广州510006)
高等植物体内存在着茉莉酸甲酯(methyl jasmonate,MeJA),是一类具有防御机制的生长调节物质和重要的信号转导分子. MeJA 能够诱导植物防御基因的表达,抵御病原菌、真菌及昆虫等生物的侵害.同时,MeJA 还能调控对机械伤害、盐害及紫外线照射等非生物胁迫的反应[1-3]. 茉莉酸甲酯在植物组织中含量的自然基准水平为10 ~100 ng/g[4].
茉莉酸甲酯在植物体中微量存在,很容易被植物中大量挥发物掩盖导致无法测出,所以需要研究探讨不同类型植物中茉莉酸甲酯的测定方法. 有报道采用酶联免疫吸附测定法(ELISA)测定小麦、黑麦草颖花中及烟草叶中茉莉酸甲酯含量[5,6],这些方法需经过繁琐的前处理过程. 有文献报道应用气相色谱-化学电离-质谱联用(GC-CI-MS)[7]测定茉莉花瓣中的茉莉酸甲酯,用反相液相色谱-气相色谱联用(RPLC-GC)[8]分离鉴定柠檬精油中的茉莉酸甲酯,这2 种方法要对植物样品进行提取、纯化、浓缩.固相微萃取(SPME)是集萃取、浓缩、进样为一体的一种新型萃取技术,所需样品量少、损耗小,适用于复杂体系中痕量挥发性有机化合物的测定[9-11].虽然有文献报道固相微萃取(SPME)作为前处理方式分离鉴定茉莉鲜叶中的茉莉酸甲酯及测定拟南芥叶、西红柿叶中茉莉酸甲酯的含量[12-13]],但由于不同植物所含挥发组分不同,大豆根样品水分含量高,挥发性组分较多,茉莉酸甲酯含量较少且易挥发,常规的前处理方法难以测定. 本实验采用HS-SPME-GC-MS 定性、HS-SPME-GC 定量测定大豆根中微量茉莉酸甲酯,并通过优化萃取时间、萃取温度、解吸温度及离子强度等实验参数提高检测灵敏度,建立了一套快速、灵敏、高效检测大豆根中内源茉莉酸甲酯含量的新方法.该方法无需溶剂,所需样品量少,前处理方法简便,能有效测定在大豆根中微量内源茉莉酸甲酯含量,为研究植物根中内源茉莉酸甲酯的变化提供了很好的测试手段.
1 实验部分
1.1 仪器与材料
FINNIGAN Trace GC Ultra-Trace DSQ 气质联用仪(Thermo ELECTRON CORPORATION). 9890 A气相色谱仪,氢火焰离子化检测器(FID)(上海灵华仪器有限公司),SE-54 石英毛细管柱(30 m ×0.25 mm×0.25 μm,中国科学院兰州化学物理研究所色谱技术研究开发中心),千谱2000 色谱数据工作站(上海千谱软件有限公司),手动固相微萃取装置(50/30 μm DVB/CAR/PDMS 萃取头,美国Supelco 公司),15 mL 顶空瓶(自备),顶空瓶专用硅橡胶隔垫(安捷伦科技有限公司).
茉莉酸甲酯标准品1 000 mg/L (ALORICH),甲醇配,使用时按需要稀释).出芽8、10、12、14、16 d 的大豆植株系列,由华南师范大学生命科学学院(种子生物学实验室)提供,所有试剂均为分析纯.
1.2 实验方法
1.2.1 顶空固相微萃取 先将固相微萃取纤维头在GC 进样口老化1 h (250 ℃),取新鲜大豆植株洗净吸干表面水分,剪取大豆根准确称量0.500 0 g,剪碎后装入15 mL 顶空瓶(瓶中预先加入0.9 mL质量分数为30% NaCl,用专用顶空硅橡胶隔垫封口.快速损伤会产生茉莉酸甲酯,所以新鲜大豆根样品剪碎后立即进行测定. 样品在90 ℃预热20 min后在90℃水浴恒温下用手动固相微萃取装置顶空萃取20 min,在GC 进样口(250 ℃)脱附2 min,同时进行GC-MS、GC-FID 检测.
1.2.2 色谱、质谱条件 色谱柱温度:40 ℃保持5 min,以30 ℃/min 升至100 ℃,再以5 ℃/min 升至230 ℃,进样口温度230 ℃,检测器温度300 ℃,载气N2线速度:25 cm/s,H2:30 mL/min,空气:300 mL/min,He 气流速1 mL/min,扫描电压:70 MeV,离子源温度:250 ℃,传输线温度:230 ℃.
2 结果与讨论
2.1 萃取条件的优化
固相微萃取过程是一个富集平衡的过程,萃取时间、萃取温度、解吸时间及离子强度等都是影响萃取效率的重要因素.在本实验中,大豆根的水分含量高,挥发物较复杂,蒸发出来的水分会影响萃取效率,所以优化实验参数是实验成败的关键. 选用50/30μm DVB/CAR/PDMS 型的萃取纤维头,按照2.2.2 色谱条件测试不同萃取时间、萃取温度、解吸时间以及离子强度对大豆根中茉莉酸甲酯萃取量的影响.
2.1.1 萃取温度的影响 提高萃取温度可以加速分子运动,使被萃取物质较快脱离基质形成气态,有利于萃取.但温度过高会使被萃取物质发生高温反应和解吸效应,本实验室观察到大豆根中水分蒸发过多降低萃取效率. 选择不同萃取温度(60、70、80、90、95 ℃)对大豆根材料中的MeJA 水平测定,结果表明(图1),60 ~90 ℃时,随着萃取温度的升高,色谱峰面积增加,90 ℃达到最高值,超过90 ℃,萃取效率开始下降,样品中挥发组分析出量增多,水分溢出急剧增加,影响微萃取头的吸附,同时萃取头的解吸效应提高,使萃取效率降低,因此选择最适宜的萃取温度为90 ℃.

图1 萃取温度对大豆样品的MeJA 萃取效率的影响Figure 1 Effects of extraction temperature on extraction efficiency of methyl iasmonate in soybeans
2.1.2 萃取时间的影响 分配平衡常数、试样体积和涂层体积、萃取时间影响涂层萃取量,在未达到分析平衡前,涂层萃取量随时间增加而增加.图2 显示20 min 前,随着萃取时间延长,萃取量增加. 萃取时间到达20 min 后萃取效率逐渐降低,说明萃取头有一定的饱和度,当达到平衡时,延长萃取时间萃取头不但不吸附,反而会使萃取头的吸附物损失,因此选择20 min 为最佳萃取时间.

图2 萃取时间对大豆样品的MeJA 萃取效率的影响Figure 2 Effects of extraction time on extraction efficiency of methyl jasmonate in soybeans
2.1.3 解吸时间的影响 解吸时间为2 min 时峰面积达到最大值,2 min 后,峰面积逐渐下降趋于平衡(图3),说明解吸时间2 min 已完全解吸萃取头中的提取物,因此选择2 min 为最佳解吸时间.

图3 解吸时间对大豆样品的MeJA 萃取效率的影响Figure 3 Effects of desorption time on extraction efficiency of methyl jasmonate in soybeans
2.1.4 离子强度的影响 为了考察不同加盐量对萃取量的影响,研究不同质量分数的NaCl 溶液对大豆根材料中MeJA 的影响(图4). 在加入0 ~30%NaCl 时,样品峰面积随着无机盐量的增加而增加.因为无机盐有一定的溶解度,因此选择30% NaCl溶液为实验条件.
2.2 大豆根部内源MeJA 检测
2.2.1 实际样品定性测定 按照2.2 实验方法对生长期为8、10、12、14 和16 d 的系列大豆植株根部内源茉莉酸甲酯进行GC-FID 测定(图5),并用GCMS 进行了确证(图6).从图5 可以看到大豆根中挥发组分比较复杂,茉莉酸甲酯含量很少.所以必须要选择合适的萃取条件和分离条件,才能检出大豆根中的内源MeJA.

图4 离子强度对大豆样品的MeJA 萃取效率的影响Figure 4 Effects of ionic strength on extraction efficiency of methyl jasmonate in soybeans
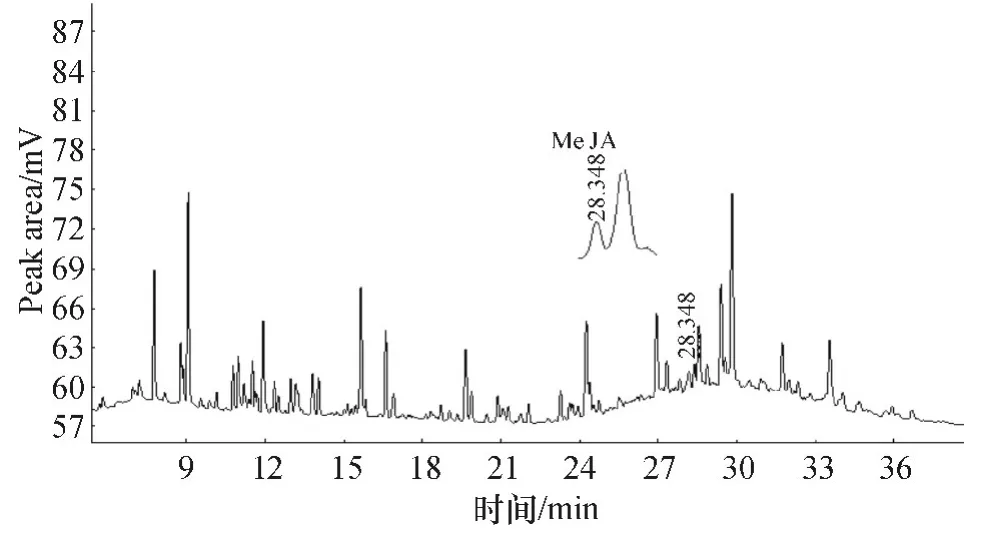
图5 大豆根中MeJA 的气相色谱图Figure 5 Gas chromatogram of methyl jasmonate in roots of soybeans
2.2.2 线性范围、检出限及实际样品定量测定 配制0.5、1、5、10、25、50 μg/L 茉莉酸甲酯的标准溶液,进行色谱分析,以峰面积y、质量浓度x 得到线性回归方程为:y =2 104x +1 627.2,R2=0.993 8,测出线性范围为0.7 ~25 μg/L,最低检测限为0.5 μg/L.按照公式(1)换算得出实际样品的线性范围是2.1 ~750 ng/g,最小检测量是1.5 ng/g. 植物组织中茉莉酸甲酯含量的自然基准水平是在10 ~100 ng/g 之间,故本实验的线性范围完全满足实际样品的测定.换算样品中茉莉酸甲酯的含量的公式如下:

其中x 表示标准曲线中茉莉酸甲酸的质量浓度(μg/L).
根据线性回归方程及茉莉酸甲酯含量的计算公式,得出大豆植株在生长期为8、10、12、14、16 d 时根部受损内源产生的茉莉酸甲酯的含量,3 次平行实验所得结果的平均值(图7)显示,大豆根样品中内源茉莉酸甲酯的含量随着生长天数增加呈现出下降-上升-下降-上升的波动趋势.

图6 大豆根中茉莉酸甲酯的质谱图及茉莉酸甲酯的结构Figure 6 The mass spectrum and chemical structure of methyl jasmonate in roots of soybeans

图7 茉莉酸甲酯测定结果Figure 7 Determination results of methyl jasmonate
2.2.3 精密度及回收率实验 准确称量0.500 0 g样品各10 份,1 份作为空白对照,另9 份采用添加法在实际样品中添加不同浓度的茉莉酸甲酯标准溶液,进行了精密度和加标回收实验. 结果(表1)表明:茉莉酸甲酯的加入量小于500 ng 时,回收率比较高,但加入量增加到1 000 ng 时,回收率明显下降,说明微萃取头吸附量是有限的,当被萃取物浓度超过其萃取量时,会由于样品不能完全吸附导致出峰面积下降.

表1 加标回收实验结果Table 1 Results of recovery rates experiments
3 结论
本实验选用50/30 μm DVB/CAR/PDMS 型的萃取纤维头,对大豆根样品中微量茉莉酸甲酯进行富集,样品使用量可减少到0.5 g. 选择合适的色谱分离条件可使MeJA 在复杂的有机挥发物中得到有效分离检测,选用GC-MS 鉴定MeJA,GC 进行优化,HS-SPME 定量分析的测定.
优化实验参数是提高检测灵敏度的重要手段.本实验对影响HS-SPME 的参数进行优化选择,选出萃取温度为90 ℃、萃取时间为20 min、解吸时间为2 min、质量分数为30% NaCl 溶液为最佳萃取条件.
采用HS-SPME-GC 技术能有效测定大豆根样品损伤后所分泌的挥发性物质茉莉酸甲酯,方法最小检测量为0.5 μg/L(在植物中为1.5 ng/g),线性范围为0.7 ~25 μg/L(在植物中为2.1 ~750 ng/g),完全满足植物组织中含量的自然基准水平为10 ~100 ng/g.
采用该方法对大豆根样品进行测定,发现大豆根样品中内源茉莉酸甲酯的含量随着生长周期的变化而变化.
[1]Roy S,Banerjee A,Tarafdar J,et al. Superior bio-efficacy of acombined formulation of carbend azim and mancozeb in inducing defense responses in chilli seedlings against Sclerotium rolfsii Sacc. in comparis on with methyl jasmonate[J].Crop Protection,2010,29(2):163-167.
[2]薛仁镐,金圣爱.茉莉酸甲酯:一种重要的植物信号转导分子[J].生物技术通讯,2006,17(6):985-988.Xue R G,Jin S A. Methyl Jasmonate:A vital signaling molecule[J].Letters in Biotechnology,2006,17(6):985-988.
[3]徐伟,严善春.茉莉酸在植物诱导防御中的作用[J].生态学报,2005,25(8):2074-2082.Xu W,Yan S C. The function of Jasmonic acid in induced plant defence[J]. Acta Ecologica Sinica,2005,25(8):2074-2082
[4]Meyer R,Rautenbach G F,Dubery I A. Identification and quantification of Methyl Jasmonate in leaf volatiles of Arabidopsis thaliana using solid-phase microextractionin combination with Gas Chromatography and Mass Spectrometry[J]. Phytochemical Analysis,2003,14(2):155-159.
[5]甘立军,夏凯,王才林,等. 抗茉莉酸甲酯单抗制备及小麦和黑麦草颖花中茉莉酸含量的测定[J]. 实验生物学报,2004,37 (5):359-370.Gan L J,Xia K,Wang C L,et al. Preparation of a monoclonal antibody against Methyl Jasmonate and quantification of Jasmonic acid in florets of wheat and Italian ryegrass[J]. Acta Biologiae Experimentalis Sinica,2004,37(5):359-370.
[6]Deng A X,Tan W M,He S P,et al. Monoclonal antibody-based enzyme linked lmmunosorbent assay for the analysis of Jasmonates in plants[J].Journal of Integrative Plant Biology,2008,50 (8):1046-1052.
[7]Koo Y J,Yoon E,Song J T,et al. An advanced method for the determination of carboxyl methyl Esterase activity using Gas Chromatography-Chemical Ionization-Mass Spectrometry[J]. Journal of Chromatography B,2008,863(1):80-87.
[8]Caja M D M,Blanch G P,Castillo M L R D. Online RPLC-GC via TOTAD method to isolate(+)-methyl epijasmonate from Lemon (Citrus limon Burm.)[J]. Journal of Agricultural and Food Chemistry,2008,56(14):5475-5479.
[9]Mo X L,Xu Y,Fan W L. Characterization of Aroma compounds in Chinese rice wine Qu by solvent-assisted flavor evaporation and headspace solid-phase microextraction[J]. Journal of Agricultural and Food Chemistry,2010,58:2462-2469.
[10]Zadra C,Borgogni A,Marucchini C. Quantification of Jasmonic acid by SPME in tomato plants stressed by ozone[J]. Journal of Agricultural and Food Chemistry,2006,54(25):9317-9321.
[11]Castillo M L R D,Blanch F P. Enantiomeric purity of(+ /- )-Methyl Jasmonate in fresh leaf samples and commercial fragrances[J]. Journal of Separation Science,2007,30(13):2117-2122.
[12]Fang W,Cheng J H,Liu S Y,et al. A robust sampling approach for identifi cation and quantifi cation of Methyl Jasmonate in leaf tissue of Oilseed Rape for analysis of early signaling in sclerotinia sclerotiorum resistance[J].Phytochemical Analysis,2010,21(3):290-297.
[13]Zadra C,Borgogni A,Marucchini C. Quantification of Jasmonic acid by SPME in tomato plants stressed by Ozone[J]. Journal of Agricultural and Food Chemistry,2006,54:9317-9321.
