茶多酚对胶原性关节炎大鼠免疫调节作用研究
2015-12-14陈永顺梁建梅蒋建平贾晓栋
李 静,陈永顺,梁建梅,蒋建平,贾晓栋
(1.商丘医学高等专科学校,河南 商丘 476100;2.广西医科大学,广西南宁 530021)
类风湿性关节炎(rheumatoid arthritis,RA)是一种以滑膜炎症、骨骼和软骨破坏及滑膜组织增殖为特征的自身免疫性疾病,极易致残,研究显示,炎性因子、细胞因子和促炎因子等在类风湿性关节炎发病及进展过程中发挥着重要作用,但是现代医学对其病因及发病机理阐述迄今尚未完全明确[1-4]。RA作为一种临床常见疾病,可在任何年龄阶段发病,以中年女性较多。据统计,在我国类风湿性关节炎患者有近1 000万[5-6]。本实验以Ⅱ型胶原乳化剂诱导大鼠类风湿性关节炎模型,通过测量大鼠足趾容积,分析大鼠免疫器官胸腺和脾脏指数,酶联免疫法检测大鼠血清促炎因子IL-6、TNF-α的表达水平,分析上述指标与RA的相关性,从免疫的角度探讨茶多酚对胶原诱导性关节炎大鼠的治疗作用,为其进一步的研究开发提供实验和理论依据。
1 仪器与试药
1.1 主要试剂 鸡Ⅱ型胶原、弗氏完全佐剂(Sigma公司),茶多酚(西安瑞林生物,纯度≥98%,医药食品级),地塞米松片(河南新乡常乐制药公司),IL-6、TNF-α检测试剂盒(南京建成生物公司)。
1.2 主要仪器 电子天平JA2003(上海精密仪器厂),足趾容积测量仪(北京凯云仪有限公司),酶联免疫检测仪(Bio-Rad)。
1.3 实验动物 SPF级SD大鼠40只,雌雄各半,体重(160±20)g,由商丘医学高等专科学校实验动物中心提供(许可证号SQYZ-2014-A05)。
2 方法
2.1 胶原乳化剂的制备 取鸡Ⅱ型胶原蛋白10 mg,加入 0.1 mol·L-1醋酸 5 mL,充分溶解,配成 2 g·L-1溶液,4℃过夜,备用。取弗氏完全佐剂5 mL,胶原5 mL溶液混合,制成胶原乳化液,4℃冷藏备用。
2.2 试验设计
2.2.1 分组 大鼠40只随机分为4组:空白组(正常空白对照组)、模型组(类风湿性关节炎模型对照组)、地塞米松组(地塞米松对照组)、茶多酚组(茶多酚治疗组)。
2.2.2 模型建立及处置 空白组大鼠右后足垫皮内注射生理盐水0.1 mL,其余各组大鼠注射胶原乳化剂0.1 mL。1周后相同剂量于尾根部皮内注射加强免疫1次。加强免疫后次日,空白组和模型组灌胃等体积蒸馏水,茶多酚治疗组大鼠每天灌胃茶多酚200 mg·kg-1,地塞米松对照组每天灌胃地塞米松 2 mg·kg-1,持续 21 d。
2.2.3 观测项目 分别在治疗的第1、7、14、21天测量大鼠体重和使用足跖容积测量仪测量大鼠右后足跖容积,计算足跖肿胀率,肿胀率(%)=致炎前后足跖容积之差/致炎前的足跖容积×100%。
2.3 指标检测 给药结束后,测量记录各组大鼠体重,测量大鼠足趾体积。处死大鼠,取血清,严格按照试剂盒的说明,ELISA法检测大鼠血清IL-6、TNF-α水平;取胸腺和脾脏计算胸腺指数和脾脏指数,脏器指数=脏器重量(mg)/动物体重(g)。
2.4 统计学处理 使用SPSS19.0软件进行数据处理。观测资料中的计量数据,以均值±标准差描述之,均行正态性检验。多组间的比较为单因素方差分析,组间两两比较为LSD法;多组多时点的观测资料则行两因素重复测量方差分析;其它计数资料,多组间的比较为整体+分割卡方检验。显著性水准 α =0.05。
3 结果
3.1 大鼠饮食和体重的变化 各组受试大鼠各时点体重数据列于表1。经两因素重复测量方差分析:整体看组间差异不显著,时点间的变化、分组和时间的交互作用均有显著性意义(P<0.05)。遂继续进行精细比较,并结合观测现象来看:空白组大鼠精神好,饮食好,活泼,其余各组大鼠约从造模第5天开始,食欲不振。分别给予地塞米松、茶多酚后,大鼠饮食有改善,体重增长有所加速,在第21天,与模型组大鼠体重比较,差异有统计学意义(P<0.05),结果详见表1。
表1 大鼠体重资料比较(g,n=10,±s)

表1 大鼠体重资料比较(g,n=10,±s)
注:两因素重复测量方差分析,空白组不加入分析。
A1:茶多酚组 A2:地塞米松组 A3:模型组 A4:空白组T1:1 d 173.5 ±16.9 175.7 ±16.6 174.5 ±14.1 176.5 ±14.2 T2:7 d 182.6 ±19.3 179.1 ±20.4 171.2 ±16.2 183.5 ±17.5 T3:14 d 187.2 ±16.3 189.5 ±13.7 176.7 ±14.3 192.8 ±21.7 T4:21 d 193.2 ±21.7 194.5 ±16.9 180.3 ±14.5 200.2 ±17.3整体分析F,P (HF系数:0.8012)组间比较 0.172,0.843时点间比较 3.207,0.047组 × 时点 9.084,0.000组间比较t,P A1 vs A2 A1 vs A3 A2 vs A3 T1 0.590,0.562 0.439,0.666 0.238,0.815 T2 0.906,0.377 0.804,0.432 2.062,0.054 T3 1.840,0.082 0.489,0.631 1.242,0.230 T4 0.592,0.561 2.198,0.044 2.530,0.021时点比较t,P A1 A2 A3 T2 vs T1 1.386,0.199 1.531,0.160 0.040,0.969 T3 vs T1 1.826,0.101 0.656,0.528 1.017,0.336 T4 vs T1 0.289,0.779 0.983,0.351 2.410,0.039
3.2 茶多酚对大鼠足趾肿胀的影响 各组大鼠足趾肿胀率资料列于表2。显然,肿胀率最低的为空白组,其次为地塞米松组。经整体+分割卡方检验,第14及21天时,茶多酚组、地塞米松组及模型组等3组间的整体差异显著(P<0.05)。结合两两组间比较及实验观测情况来看:空白组足趾无明显肿胀。模型组大鼠右后足趾肿胀明显,足垫增厚,活动明显受限,而地塞米松对照组及茶多酚治疗组大鼠右后足踝肿胀明显减轻、活动能力较模型组大鼠有所增强,见表2。
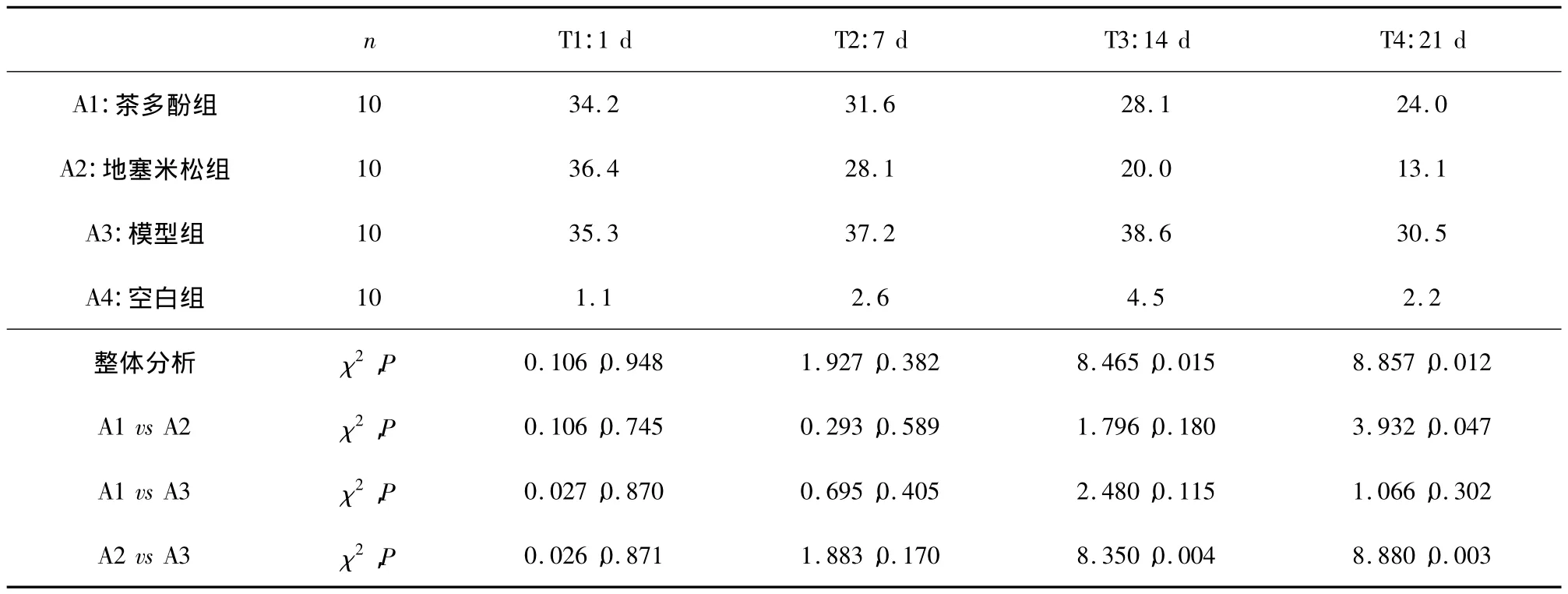
表2 大鼠足趾肿胀率资料比较/%
3.3 茶多酚对大鼠胸腺、脾脏指数的影响 各组大鼠胸腺、脾脏指数的资料列于表3。经对茶多酚组、地塞米松组及模型组等3个组的资料做单因素方差分析,整体比较均为显著(P<0.05)。两两比较并结合数据来看:模型组大鼠胸腺、脾脏指数较空白组明显升高,地塞米松对照组、茶多酚治疗组大鼠胸腺、脾脏指数较模型组明显降低,与模型组比较有显著差异(P<0.05)。

表3 大鼠胸腺、脾脏指数比较(n=10)
3.4 茶多酚对大鼠血清促炎因子IL-6、TNF-α水平的影响 各组大鼠血清的促炎因子IL-6、TNF-α水平数据列于表4。亦经单因素方差分析,IL-6、TNF-α两个指标,茶多酚组、地塞米松组及模型组等3个组间的整体比较,均有显著性差异(P<0.05)。各组之间的两两比较也多有统计学意义(P<0.05)。结合数据来看:给药结束后,地塞米松对照组、茶多酚治疗组大鼠血清IL-6、TNF-α水平明显降低,与模型组比较,有较大的差别,详见表4。

表4 大鼠血清IL-6、TNF-α水平比较 (n=10,μg·L-1)
4 讨论
近年来,化学合成物中发现新药的命中率明显降低,创制成本越来越高,研制周期越来越长。以美国FDA为例,1996年和1997年分别批准了120项以上的新药申请;但2001年批准的新药申请数量减为66项,2009年为26项,2010年锐减为21项,加之化学合成药物的毒副作用显著,使越来越多的新药研究人员把目光转向天然活性产物及其衍生物[7-8]。另据 1995 年美国一项统计结果表明[9],1984年到1995年间,美国使用的药物中含天然活性产物及其衍生物的比例高达60%。因此,天然活性产物及其衍生物在药物的研发及改良中将会发挥越来越重要的作用。
绿茶是世界上很熟知的且受人们喜爱的饮品,茶多酚是绿茶中的主要活性成分,是一类含有多羟基酚类化合物的总称,含量约占茶叶干物质总量的20%~30%。研究表明,茶多酚具有调节免疫、抗氧化、调血脂、抗衰老、抗肿瘤等多种功效,引起广泛关注[10-14]。
大量研究资料认为,RA是在遗传背景的基础上,在环境因素的影响下,免疫系统调节功能紊乱,引起细胞因子失衡所致的炎症反应性疾病[15-18]。IL-6作为前炎症细胞因子,介导炎症反应和免疫反应,在RA患者骨与软骨破坏中起着重要作用,目前已开发IL-6受体抗体Tocilizumab用于RA的临床治疗。TNF-α是RA发病和维持关节滑膜炎症的关键致炎性因子,可作用于RA关节组织中的滑膜细胞、巨噬细胞、软骨细胞和破骨细胞,使这些细胞活化产生金属蛋白酶、胶原酶等,导致滑膜炎症反应和血管翳形成,引起骨和软骨破坏[19-20]。本研究结果显示,茶多酚200 mg·kg-1每天给类风湿性关节炎(CIA)大鼠灌胃,可增加大鼠饮食,大鼠体重增长明显加快,与模型组比较P<0.05;大鼠在给予茶多酚治疗后,足跖肿胀明显减轻,大鼠活动量明显增加,说明茶多酚对CIA大鼠有一定治疗作用。胸腺和脾脏是免疫系统的两大重要脏器,测定大鼠脏器指数显示,茶多酚可明显降低CIA大鼠胸腺、脾脏指数(P<0.05),进一步检测大鼠血清促炎因子IL-6、TNF-α水平显示,茶多酚治疗组明显低于模型组(P<0.05),说明茶多酚对CIA大鼠紊乱的免疫系统有一定的抑制作用,推测其机理可能与调节机体免疫细胞活性、抑制机体免疫细胞过度分泌IL-6、TNF-α引起炎症反应有关,这为深入研究茶多酚治疗RA提供了新的思路。
[1]黄传兵,刘 健,谌 曦,等.新风胶囊治疗类风湿性关节炎疗效观察[J].中国中西医结合杂志,2013,33(12):1599-1602.
[2]孙 波,宋玉国,王 华,等.类风湿性关节炎 IL-17检测的临床应用价值研究[J].中国实验诊断学,2014,18(11):1797-1799.
[3]马 旭,朱 清,邵凤民,等.中西医结合治疗类风湿性关节炎68例疗效观察[J].时珍国医国药,2013,24(10):2528-2529.
[4]姜 辉,申 旺,刘知勤,等.类风湿关节炎的病因病机及治疗研究进展[J].中医药临床杂志,2011,23(5):458-459.
[5]Yamanaka,H.Rheumatoid arthritis[J].Nippon Rinsho,2010,68(10):1896-1899.
[6]Xiang YJ,Dai SM.Prevalence of rheumatic diseases and disability in China[J].RheumatolInt,2009,29(5):481-490.
[7]李 娜,诸黎星,邹 栩.1996年 ~2005年全球上市新药研发趋势及分析[J].药学进展,2007,31(5):228-231.
[8]KolaI,Landis J.Can the pharmaceutical industry reduce attrition rates[J].Nature Reviews Drug Discovery,2004,3(8):711-715.
[9]Cragg GM,Nevman DJ,Snader DM.Natural products in drugs discovery and development[J].JNat Prod,1997,60(1):52-60.
[10]周 薇,戴奇刚,邓 鑫,等.EGCG对人肝癌细胞株HepG2裸鼠移植瘤COX-2、VEGF和bFGF表达的调控[J].中山大学学报(医学科学版),2013,34(3):364-370.
[11]唐袁婷,管小琴,江咏梅,等.茶多酚对酒精性肝损伤过氧化的影响[J].重庆医学,2014,43(21):2736-2738.
[12]夏家杰,薛 蒙,金 梦,等.茶多酚改善胰岛素抵抗的初步研究[J].茶叶科学,2014,34(2):144-148.
[13]朱振丹,茆 翔,刘佰运,等.茶多酚对大鼠创伤性颅脑损伤的脑保护作用[J].安徽医药,2014,18(10):1825-1828.
[14]宁鸿珍,李清钊,刘英莉,等.茶多酚对肥胖大鼠体重的影响及其与瘦素、血脂水平的关系[J].食品科学,2008,29(4):358-360.
[15]Ahmed S,Kwan K,Marotte H,et al.Regulation of Prostaglandin E2(PGE2)-inducedIL-6 production by Epigalloeatechin-3-gallate(EGCG)in rheumatoid arthritis synovial fibroblasts[J].FASEB J,2008,22:298-299.
[16]缪 怡,胡朝英,钱 柳,等.类风湿性关节炎免疫学研究进展[J].上海交通大学学报(医学版),2011,31(7):1035-1040.
[17]费克香,雷元卫.类风湿性关节炎免疫功能异常的研究进展[J].国外医学(免疫学分册),1999,22(6):323-326.
[18]卢 月,曹雅晶,钱瑞琴,等.IL-17在类风湿性关节炎发病机制中的作用[J].中国免疫学杂志,2011,27(9):855-859.
[19]郑红艳,吴学军,刘全海,等.类风湿关节炎分子靶向治疗新药的研究进展[J].世界临床药物,2013,34(5):306-311.
[20]Moller B,Villiger PM.Inhibition ofIL-1,IL-6,and TNFalpha in immune-mediated inflammatory diseases[J].Springer Seminars inImmunopathology,2006,27(4):391-408.
