黄蜀葵花中金丝桃苷及其异构体的分离纯化
2015-12-13龙立梅李小波曹学丽
李 柰,龙立梅,樊 琛,李小波,曹学丽*
(北京工商大学食品学院,食品添加剂与配料北京高校工程研究中心,北京 100048)
黄蜀葵花中金丝桃苷及其异构体的分离纯化
李 柰,龙立梅,樊 琛,李小波,曹学丽*
(北京工商大学食品学院,食品添加剂与配料北京高校工程研究中心,北京 100048)
应用聚酰胺柱层析法和高效制备液相色谱法研究黄蜀葵花(Abelmoschus manihot(L.) Medi cus)中金丝桃苷及其异构体分离制备方法。结果表明:黄蜀葵花粗提物经聚酰胺柱层析分离后,50%乙醇洗脱液中可得到金丝桃苷及其异构体的混合物,将混合物冻干后经高效制备液相色谱分离,高效制备液相柱为Calesil A-120(250 mm×21.2 mm,10 μm),流动相为乙腈-0.2%乙酸(15∶85,V/V),上样量20.0 mg,流速25.0 mL/min,柱温3 0 ℃,检测波长280 nm,得到纯度分布在99%和97%以上的两种纯物质。经核磁共振及质谱分析,鉴定其分别为金丝桃苷和异槲皮苷,二者互为立体异构体。
黄蜀葵花;聚酰胺柱层析;高效制备液相色谱;金丝桃苷;异槲皮苷
黄蜀葵花为锦葵科秋葵属植物蜀葵(Abelmoschus manihot(L.)Medicus)的干燥花朵,具有清利湿 热、消肿解毒之功效[1]。其中的黄酮类活性成分如金丝桃苷、芦丁、槲皮素等具有抗结肠癌[2]、保肝[3-4]、心脑血管保护[5-6]、神经系统保护[7-8]、抗氧化[9]等多种功能,因此受到人们越来越多的关注。金丝桃苷广泛存在于各种植物体内,但在藤黄科金丝桃属植物贯叶连翘和锦葵科秋葵属植物黄蜀葵花中分布较多,其含量分别为1.02%和1.12%[10]。金丝桃苷通常与其众多的结构类似物并存[11-12],给分离纯化带来了一定的困难。目前分离纯化常采用的方法为大孔吸附树脂[13-14]、正相硅胶、反相ODS、Sephadex LH-20等[15-19]反复的柱层析法,这些方法步骤复杂,且得率较低。聚酰胺是由酰胺聚合而成的一类高分子化合物,是分离黄酮类物质的理想吸附剂,其吸附强度主要取决于黄酮类化合物分子中羟基的数目与位置,以及溶剂与黄酮类化合物或与聚酰胺之间形成氢键缔合能力的大小[20]。本研究将聚酰胺柱层析法与高效制备液相色谱法相结合,较简便地分离得到高纯度金丝桃苷及其立体 异构体异槲皮苷。该 方法可为高纯度金丝桃苷及异槲皮苷对照品的制 备及其进一步药理活性研究提供技术支持。
1 材料与方法
1.1 材料与试剂
黄蜀葵花粗提物 宝鸡市方晟生物开发有限公司;层析聚酰胺(100~200 目) 西安朴天生物科技有限公司;无水乙醇(分析纯) 北京化工厂;乙腈(色谱纯) 美国Fisher Scientific公司;冰乙酸(色谱纯)天津市光复精细化工研究所;纯水由Millipore-Q纯水机自制。
1.2 仪器与设备
RE-52A型旋转蒸发仪 上海亚荣生化仪器厂;ALPHA1-4LSC型真空冷冻干燥机 博劢行仪器有限公司;1100型高效液相色谱(high performance liquid chromatography,HPLC)系统(配有可变波长紫外检测器和Rev.A.06.03色谱工作站) 美国Agilent公司;聚酰胺柱层析系统(玻璃层析柱φ3.5 cm×70 cm,BSZ-4型自动部分收集器) 上海沪西分析仪器厂;DHL-A型电脑恒流泵 北京圣益通技术开发有限责任公司;三重四极杆5500TM液相色谱-质谱联用仪 美国AB Sciex公司;AV 600超导核磁共振波谱仪 瑞士Bruker公司;Sprot Prep制备系统(配有V2梯度泵、可变波长检测器) 法国Armen公司;Calesil A-120色谱柱(250 mm×21.2 mm,10 μm;250mm×10 mm,10 μm) 上海Sunyear科技公司。
1.3 方法
1.3.1 HPLC色谱分析条件
色谱柱:ZORBAX SB-C18(250 mm×4.6 mm,5 ☒m);流速:1.0 mL/min;检测波长:280 nm;上样量:10 μL;柱温:30℃;流动相:乙腈(A),0.2%乙酸(B);梯度洗脱:0~10.0 min,15%A;10.0~15.0 min,15%~50%A;15.0~20.0 min,50%~70%A;20.0~25.0 min,70%~90%A;25.0~30.0 min,90%~100%A;30.0~40.0 min,100%A。
1.3.2 聚酰胺柱层析法分离
称取100.0 g层析用聚酰胺,加入1 000 mL无水乙醇浸泡24 h,然后用去离子水洗涤至无醇味。采用湿法装入层析柱(φ3.5 cm×70 cm,柱体积1 BV为450 mL),待柱平衡后以黄蜀葵花粗提物为样品上样,上样量为5.0 g。随后用不同体积分数乙醇进行梯度洗脱,分别为30%乙醇洗脱1 BV、50%乙醇洗脱3 BV、70%乙醇洗脱1 BV、90%乙醇洗脱3 BV。洗脱流速为5.0 mL/min,每5 min收集1 管。将洗脱级分用HPLC分析,绘制黄蜀葵花中金丝桃苷及其异构体的洗脱曲线图,合并收集目标级分,浓缩冻干,以备下一步分离使用。
1.3.3 高效制备液相色谱法分离
首先采用小型高效制备液相柱(250 mm×10 mm,10 μm)对聚酰胺分离出的目标混合物进行洗脱条件的探索。混合物的上样量为5.0 mg,流速5.0 mL/min,洗脱40 min。洗脱体系为乙腈-0.2%乙酸(分别为10∶90、15∶85、20∶80,V/V)。
选取最适的高效制备液相色谱分离方法,采用大型高效制备液相柱(250 mm×21.2 mm,10 μm)进行分离,上样量为20.0 mg,洗脱体系为乙腈-0.2%乙酸(15∶85,V/V),对洗脱流速进行选择,分别为:20.0 mL/min和25.0 mL/min,然后选择一个最适流速进行连续进样。
2 结果与分析
2.1 黄蜀葵花粗提物的HPLC分析

图1 黄蜀葵花粗提物及金丝桃苷标准品的高效液相色谱图Fig.1 HPLC chromatograms of crude extract of Abelmoschus manihot (L.) Medicus and hyperoside standard
由图1可知,黄蜀葵花粗提物中1号物质为金丝桃苷,出峰时间为10.173 min,成分2物质的出峰时间为11.017 min,且其紫外光谱图均显示了黄酮特征。
2.2 聚酰胺柱层析分离黄蜀葵花粗提物
黄蜀葵花粗提物经聚酰胺柱层析后,各洗脱级分经HPLC分析发现,金丝桃苷与另外一个成分2(图1)共同被50%乙醇洗脱出来,且几乎没有分离趋势,其洗脱曲线如图2所示。表明它们的结构类似,具有一定的分离难度。合并收集此部分的级分,冷冻干燥后待进一步分离。

图2 金丝桃苷及其异构体的聚酰胺柱洗脱曲线Fig.2 Polyamide chromatography elution curve of hyperoside and its isomer
2.3 高效制备液相色谱分离金丝桃苷异构体
采用小型高效制备液相柱(250 mm×10 mm,10 μm),用不同比例的流动相进行等度洗脱,波长280 nm,柱温30 ℃,结果如图3所示。

图3 不同流动相比例的小型高效制备液相色谱图Fig.3 Preparative HPLC profiles with different mobile phase proportions
通过不同的流动相比例发现,当洗脱体系乙腈-0.2%乙酸体积比10∶90时,40 min内2 个混合物不能被洗脱出来,所以需适当增加乙腈的比例。但当洗脱体系乙腈-0.2%乙酸体积比20∶80时,金丝桃苷及其异构体被一同洗脱出来,所以最适合的流动相比例为乙腈-0.2%乙酸体积比15∶85。
在大型高效制备液相柱(250 mm×21.2 mm, 10 μm)中考察了流动相流速对分离效果的影响,流速分别为20.0、25.0 mL/min,上样量20.0 mg,体系为乙腈-0.2%乙酸体积比15∶85,波长280 nm,柱温30 ℃,结果如图4所示。

图4 不同流速的大型高效制备液相色谱图Fig.4 Preparative HPLC profiles with different flow rates
当流速为20.0 mL/min时,金丝桃苷及其异构体可以实现基线分离,但存在洗脱时间过久,峰形较宽的问题,所以适当提高洗脱流速。当流速为25.0 mL/min时,金丝桃苷的出峰时间提前了10 min,且得到了比较满意的分离效果,所以采用该洗脱体系及流速进行连续上样,分离制备两个成分,每隔5 min进样1 次,图5为连续2 次上样的制备色谱图。
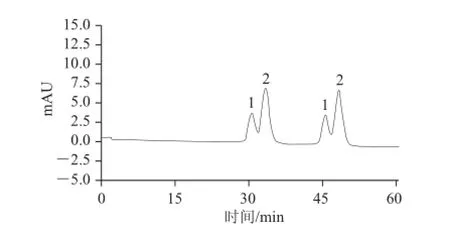
图5 金丝桃苷及其异构体混合物的连续进样制备分离色谱图Fig.5 Preparative HPLC profile with continuous injection
经过高效制备液相色谱可以将成分1、2完全分离,将分离物收集浓缩干燥后,采用HPLC分析,结果如图6所示。成分1(金丝桃苷)的纯度可达99.2%,成分2的纯度可达到97.7%。最后采用核磁共振及质谱对2种物质进行结构鉴定。

图6 混合物及分离后两物质的HPLLCC图Fig.6 HPLC chromatograms of mixture and individuals of two isomers
2.4 结构鉴定
将纯化后的成分1、2进行红外吸收光谱、核磁共振及质谱鉴定。成分1 红外吸收光谱:3 306 cm—1宽峰是羟基伸缩振动峰、1 656 cm—1是羰基伸缩振动峰、1 606 cm—1和1 504 cm—1是苯环骨架伸缩振动峰、1 087 cm—1是苷键伸缩振动峰(图7A)。
C21H20O12,电喷雾电离质谱m/z:465.4 [M+H]+;1H-NMR(DMSO-d6,600 MHz)δ:12.62(1H,s,5-OH)、6.18(1H,d,J=1.2 Hz,H-6)、6.38(1H,d,J=1.2 Hz,H-8)、7.53(1 H,d,J=1.8 Hz,H-2’)、6.81(1H,d,J=7.8 Hz,H-5’)、7.66(1H,dd,J=1.8、7.8 Hz,H-6’)、5.38(1H,d,J=7.2 Hz,H-1”)。13C-NMR(DMSO-d6,150 MHz) δ∶ 156.55(C-2)、133.88(C-3)、177.78 (C-4)、161.65(C-5)、102.37(C-6)、165.52 (C-7)、94.08(C-8)、156.84(C-9)、104.03(C-10)、121.47 (C-1’)、115.64 (C-2’)、145.35(C-3’)、149.08(C-4’)、116.33 (C-5’)、122.42(C-6’)、99.39 (C-1”)、76.29(C-2”)、73.68 (C-3”)、71.68(C-4”)、68.37(C-5”)、60.58(C-6”)。该数据与文献[21-23]一致,确定成分1为金丝桃苷。
成分2 红外吸收光谱:3 214 cm—1宽峰是羟基伸缩振动峰、1 655 cm—1是羰基伸缩振动峰、1 604 cm—1和1 509 cm—1是苯环骨架伸缩振动峰(图7B)。
C21H20O12,电喷雾电离质谱m/z:465.4 [M+H]+;1H-NMR(DMSO-d6,600 MHz)δ:12.63 (1H,s,5-OH)、 6.17(1H,d,J=1.2 Hz,H-6)、6.37(1H,d,J=1.2 Hz,H-8)、7.59(1H,d,J=1.2 Hz,H-2’)、6.83(1H,d,J=7.8 Hz,H-5’)、7.58(1H,dd,J=1.8,7.8 Hz,H-6’)、5.47 (1H,d,J=7.2 Hz,H-1”)。13C-NMR(DMSO-d6,150 MHz)δ∶ 156.91(C-2)、133.73(C-3)、177.78(C-4)、161.52(C-5)、99.64(C-6)、164.71(C-7)、94.01(C-8)、1 5 6.5 4(C-9)、1 0 4.1 2 (C-1 0)、1 2 2.0 2(C-1’)、1 1 5.6 4(C-2’)、145.33 (C-3’)、149.15(C-4’)、116.61 (C-5’)、121.58(C-6’)、101.42(C-1”)、74.52(C-2”)、76.91(C-3”)、70.11(C-4”)、78.02(C-5”)、61.43(C-6”)。该数据与文献[24-26]一致,确定成分2为异槲皮苷。

图7 红外光谱图Fig.7 Infrared spectra of hyperin and isoquercitrin
两种物质的化学结构如图8所示。其结构上的差异仅在3位糖苷连接键的立体位置,二者属于立体异构体。
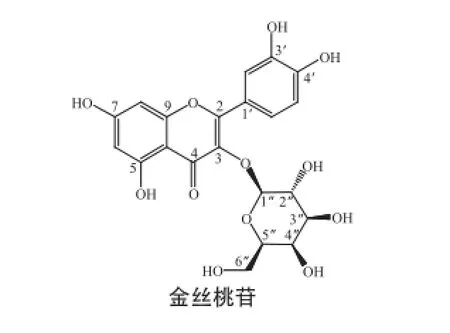

图8 金丝桃苷与异槲皮苷的化学结构Fig.8 Chemical structures of hyperoside and isoquercitrin
3 结 论
本研究采用聚酰胺柱层析分离黄蜀葵花粗提物,从部分50%乙醇洗脱液中得到金丝桃苷与异槲皮苷的混合物,而且两种物质几乎没有分离趋势。将混合样品冻干后采用高效制备液相进行进一步的分离,在小型高效制备液相柱中考察了流动相比例对分离效果的影响,在大型高效制备液相柱中考察了流速的影响,选择最优的分离条件为:选用Calesil A-120色谱柱(250 mm×21.2 mm,10 μm),上样量20.0 mg,流速25.0 mL/min,洗脱体系为乙腈-0.2%乙酸(15∶85,V/V),波长280 nm,柱温30℃,可连续上样,并取得了较好的分离效果。经HPLC分析,金丝桃苷的纯度可达99.2%,异槲皮苷的纯度可达到97.7%,本研究为两种立体异构体的分离提供了一定的方法参考。
[1] 李时珍. 本草纲目: 校点本[M]. 北京: 人民卫生出版社, 1977: 1045.
[2] 王丽敏, 李爽, 张明远, 等. 金丝桃苷对人结肠癌HCT8细胞生长周期、细胞凋亡及对Caspase蛋白活性的影响[J]. 时珍国医国药, 2012, 23(12): 3010-3011.
[3] CHOI J H, KIM D W, YUN N, et al. Protective effects of hyperoside against carbon tetrachloride-induced liver damage in mice[J]. Natural Products, 2011, 74(5): 1055-1060.
[4] XING Haiyan, LIU Yao, CHEN Jianhong, et al. Hyperoside attenuates hydrogen peroxide-induced L02 cell damage via MAPK-dependent Keap1-Nrf2-ARE signaling pathway[J]. Biochemical and Biophysical Research Communications, 2011, 410(4): 759-765.
[5] FAN Yifei, CHEN Zhiwu, GUO Yan, et al. Cellular mechanisms underlying Hyperin-induced relaxation of rat basilar artery[J]. Fitoterapia, 2011, 82(4): 626-631.
[6] LI Zilin, LIU Jincheng, HU Jing, et al. Protective effects of hyperoside against human umbilical vein endothelial cell damage induced by hydrogen peroxide[J]. Ethnopharmacol, 2012, 139(2): 388-394.
[7] HAAS J S, STOLZ E D, BETTI A H, et al. The anti-immobility effect of hyperoside on the forced swimming test in rats is mediated by the D2-like receptors activation[J]. Planta Media, 2011, 77(4): 334-339.
[8] ZHANG Xiaonan, LI Jinmao, YANG Qi, et al. Anti-apoptotic effects of hyperoside via inhibition of NR2B-containing NMDA receptors[J]. Pharmacological Reports, 2010, 62(5): 949-955.
[9] 黄明春, 陈剑鸿, 胡小刚, 等. 金丝桃苷对CCl4诱导大鼠急性肝损伤抗氧化应激研究[J]. 局解手术学杂志, 2013, 22(6): 588-590.
[10] 王燕, 王先荣, 马凤余, 等. 金丝桃苷在植物中的分布及其含量测定[J].安徽医药, 2009, 13(11): 1312-1315.
[11] 张俊松, 王晓利, 罗谦, 等. HPLC测定贯叶连翘及提取物中伪金丝桃素和金丝桃苷的含量[J]. 中成药, 2006, 28(5): 709-712.
[12] 袁丽春, 刘斌, 石任兵. HPLC法测定不同市售荷叶药材中金丝桃苷和异槲皮苷的含量[J]. 药物分析杂志, 2010, 30(1): 41-44.
[13] 于鹤云, 刘汉清, 刘嘉, 等. D-101型大孔吸附树脂纯化黄蜀葵花总黄酮的工艺研究[J]. 中成药, 2014, 36(3): 520-525.
[14] 袁慧, 周亚球, 光琴. 黄蜀葵花总黄酮的大孔树脂纯化工艺[J]. 安徽医药, 2009, 13(2): 136-138.
[15] 李春梅, 王涛, 张祎, 等. 中药黄蜀葵花化学成分的分离与鉴定:Ⅰ[J]. 沈阳药科大学学报, 2010, 27(9): 711-714.
[16] 李春梅, 安雅婷, 王涛, 等. 中药黄蜀葵花化学成分的分离与鉴定: Ⅲ[J].沈阳药科大学学报, 2011, 28(7): 520-525.
[17] 李春梅, 王涛, 张祎, 等. 中药黄蜀葵花化学成分的分离与鉴定:Ⅱ[J]. 沈阳药科大学学报, 2010, 27(10): 803-807.
[18] 张元媛, 贾晓妮, 曹永翔, 等. 黄蜀葵花化学成分研究[J]. 西北药学杂志, 2008, 23(2): 80-82.
[19] 王先荣, 周正华, 杜安全, 等. 黄蜀葵花黄酮成分的研究[J]. 中国天然药物, 2004, 2(2): 30-32.
[20] 张国英. 辣蓼主要成分的提取、分离与鉴定[D]. 南京: 南京林业大学, 2004.
[21] 张忠立, 左月明, 徐璐, 等. 三白草黄酮类化学成分的研究[J]. 中草药, 2011, 42(8): 1490-1493.
[22] 颜朦朦, 肖世基, 丁立生, 等. 北栽秧花化学成分研究[J]. 中草药, 2014, 45(3): 314-317.
[23] XUE Caifu, JIANG Shu, GUO Jianming, et al. Screening for in vitro metabolites of Abelmoschus manihot extract in intestinal bacteria by ultra-performance liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. Chromatography B, 2011, 879(32): 3901-3908.
[24] 伏晓, 樊建领, 张秋颖. 红花檵木叶黄酮类化学成分的分离与鉴定[J].中国药房, 2012, 23(11): 1021-1022.
[25] XIE Zhisheng, HUANG Jieyun, XIE Zhiyong, et al. Isolation and purification of isoquercitrin and quercitrin from hypericum japonicum thunb. ex murray by counter-current chromatography[J]. Separation Science and Technology, 2014, 49(5): 778-782.
[26] WANG Jun, MA Yanlong, WU Xiangyang, et al. Selective hydrolysis by commercially available hesperidinase for isoquercitrin production[J]. Journal of Molecular Catalysis B: Enzymatic, 2012, 81: 37-42.
Separation of Hyperoside and Its Isomers from Abelmoschus manihot (L.) Medicus Flowers
LI Nai, LONG Limei, FAN Chen, LI Xiaobo, CAO Xueli*
(Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, School of Food and Chemical Engineering, Beijing Technology and Business University, Beijing 100048, China)
Polyamide chromatography and preparative high performance liquid chromatography (HPLC) were used for the separation and preparation of two isomers of hyperoside from Abelmoschus manihot (L.) Medicus flowers. The results indicated that the 50% ethanol eluate contained a mixture of hyperoside and its isomers after polyam ide chromatography. Then the freeze-dried mixture was separated by preparative HPLC on Calesil A-120 column (250 mm × 21.2 mm , 10 μm) with a cetonitrile-0.2% aqueous acetic acid (15:85, V/V) as the mobile phase by injecting 20.0 mg of the sample at a flow rate of 25.0 mL/ min; the column temperature was 30 ℃, and detection wavelength was 280 nm. Two isomers were achieved and identified by MS,1H and13C NMR as hyperoside and isoquercitrin with purities of more than 99% and 97%, respectively, and both were stereoisomer.
Abelmoschus manihot (L.) Medicus; polyamide chromatography; preparative high performance liquid chromatography; hyperoside; isoquercitrin
R284
A
1002-6630(2015)04-0131-05
10.7506/spk x1002-6630-201504025
2014-06-26
北京市自然科学基金重点项目(KZ201410011016)
李柰(1989—),女,硕士研究生,研究方向为生物分离工程。E-mail:linai1989@126.com
*通信作者:曹学丽(1967—),女,教授,博士,研究方向为生物分离技术。E-mail:caoxl@th.btbu.edu.cn
