正交试验优化注射用左卡尼汀调配条件
2015-12-13曹教育吴凤芝马旖旎
吴 妍,曹教育,吴凤芝,李 民,刘 圣,马旖旎,唐 琪
(1.安徽省立医院南区,安徽合肥 230036;2.安徽中医药大学,安徽合肥 230012)
左卡尼汀(即左旋肉碱),又称维生素BT,是一种广泛存在于机体组织内的特殊氨基酸,是动物能量代谢必需的体内天然物质[1]。其主要作用是运载长链脂酰辅酶A通过线粒体内膜进入线粒体基质进行 β-氧化,为脂肪酸 β-氧化必不可少的载体[2-3]。注射用左卡尼汀适用于慢性肾衰长期血透病人因继发性肉碱缺乏产生的一系列并发症状,临床表现如心肌病等。在临床应用过程中注射用左卡尼汀溶媒选择差异较大,包括0.9%NS、5%GS、10%GS和GNS[4-5],为了进一步规范注射用左卡尼汀临床应用行为,提高其成品输液质量,拟采用正交试验,优选注射用左卡尼汀最佳溶解方法,并考察左卡尼汀浓溶液与4种常用输液配伍后成品输液在0~8 h内各项指标变化,判断其在各输液中的稳定性,最终确定最佳调配方案,为左卡尼汀静脉用药调配技术提供数据支持,促进临床合理用药。
1 仪器与材料
1.1 仪器 LC-2010A HT岛津高效液相色谱仪(紫外检测器,四元低压泵,自动进样器,LabSolutions Version 5.51色谱工作站);FA2004B电子天平(上海精科天美科学仪器有限公司);PHS-3C型电子pH计(上海雷磁仪器厂);GWF-5JS微粒分析仪(天河医疗仪器有限公司),KJ-202型振荡器(江苏康健医疗用品有限公司)。
1.2 药品与试剂 左卡尼汀对照品(ID:2ASVCRW9,规格400 mg,纯度 99.9%,中国食品药品检定研究院);注射用左卡尼汀(批号14040718,规格1 g,瑞阳制药有限公司);5%GS(批号12122098)、10%GS(批号 14041893)、GNS(批号 12080895)、0.9%NS(批号14072395),均由安徽丰原药业股份有限公司提供;甲醇、乙腈为色谱纯,磷酸为分析纯,水为纯化水。
2 方法与结果
2.1 正交试验设计[6-7]与结果 选择不同溶解溶媒(A)、溶媒量(B)、振荡时间(C)、振荡频次(D)为考察因素,并考察溶媒类型与溶媒量(A×B)、溶媒类型与振荡时间(A×C)、溶媒量与振荡时间(B×C)交互作用,以浓溶液不溶性微粒总数为评价指标。采用L8(27)正交设计试验,因素水平设计见表1,正交设计及结果见表2,交互作用结果见表3~5,方差分析结果见表6,7。

表1 因素水平表
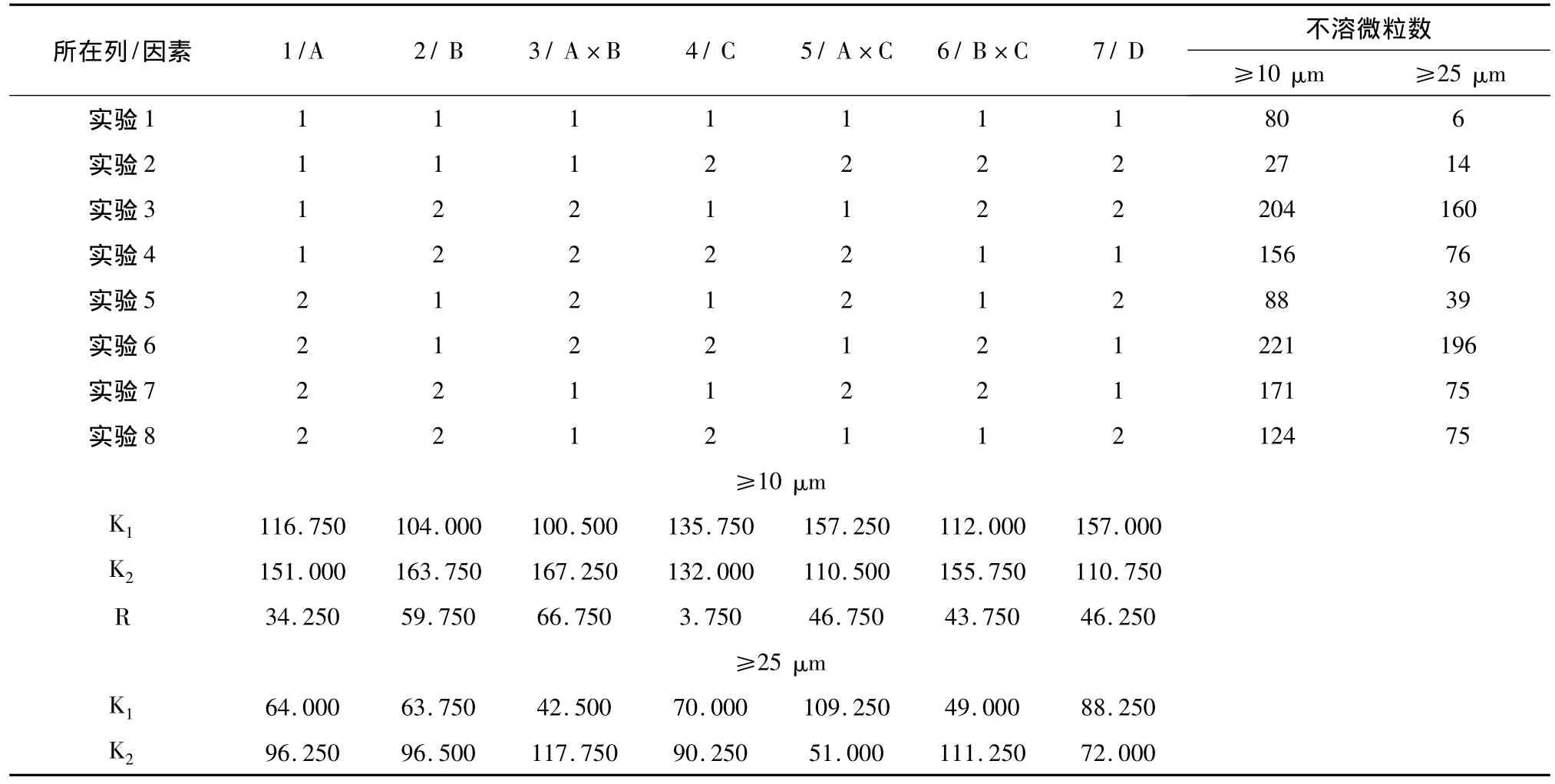
表2 L 8(27)正交设计与结果

表3 A×B交互作用表

表4 A×C交互作用表

表5 B×C交互作用表

表6 ≥10μm不溶性微粒总数的方差分析表
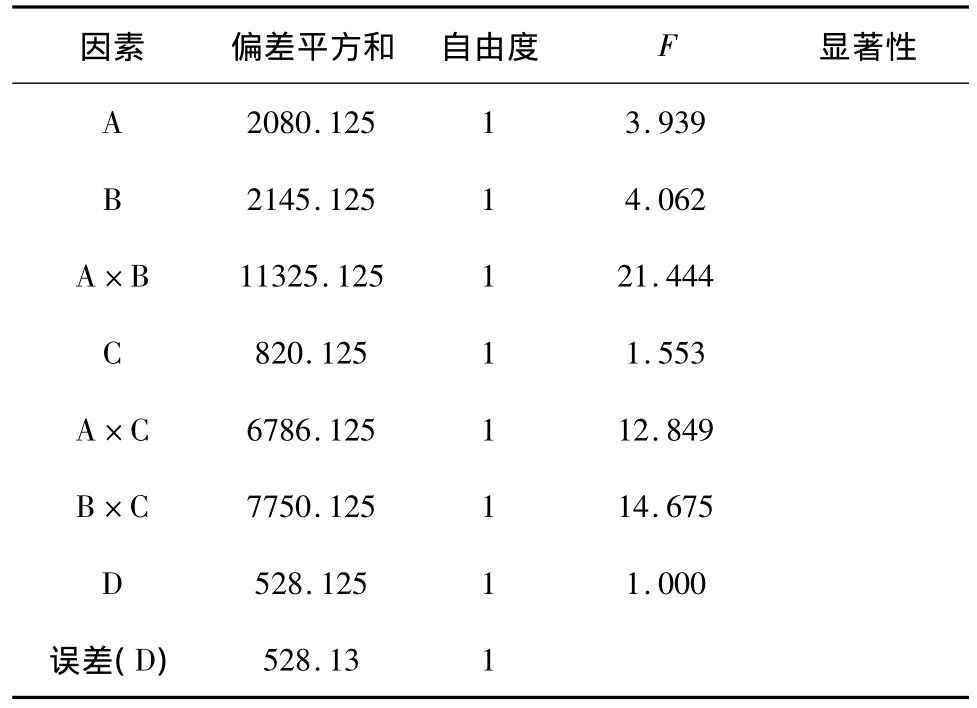
表7 ≥25μm不溶性微粒总数的方差分析表
结果分析:根据影响不溶性微粒≥10μm因素和水平的直观分析、交互作用和方差分析结果,可知各影响因素的主次顺序为:A×B>B>A×C>D>B×C>A>C,其中C因素影响较弱,作为误差估计的来源。溶媒量、溶媒种类与溶媒量的交互作用两个因素具有显著作用,得出最佳调配方法为A1B1C2D2。根据影响不溶性微粒≥25μm因素和水平的直观分析、交互作用和方差分析结果,可知各影响因素的主次顺序为:A×B>B×C>A×C>B>A>C>D,其中D因素影响较弱,作为误差估计的来源,得出最佳调配方法为A1B1C1D2。比较两种最佳调配方法仅C因素存在差别,因C作用不显著,故取C1或C2均可,但从实际工作出发,取C1可相对减少调配时间,提高输液调配效率。故最佳调配方法为A1B1C1D2,即每1 g药粉用8 mL灭菌注射用水溶解,慢频次振荡1 min。
2.2 最佳调配方法验证 按最佳调配方法,取注射用左卡尼汀1支(1 g),加8 mL灭菌注射用水慢频次振荡1 min,置于取样器上,仪器适量抽取4次,第一次数据不计,取后3次测定值,根据取样体积与容器内液体总体积,计算每个容器所含的微粒总数。以上操作平行进行3次,结果见表8。

表8 注射用左卡尼汀调配方法验证试验结果
2010版《中国药典》规定[9]标示装量为100 mL以下的注射用浓溶液的每个供试品容器中含10μm及10μm以上的微粒不得过6 000粒,含25μm及25μm以上的微粒不得过600粒。验证试验结果表明浓溶液中10μm及以上、25μm及以上的微粒总数均符合药典标准,且微粒数较正交试验值小,说明此最佳调配方案可行。
2.3 成品输液的稳定性考察
2.3.1 色谱条件与系统适用性试验 色谱柱:Hypersil ODSC18(4.6 mm ×250 mm-5 μm),流动相:磷酸盐缓冲液溶液(精密称取磷酸二氢钾8.45 g,磷酸氢二钾0.87 g,灭菌注射用水定容成1 000 mL,用磷酸调 pH为3.0)— 甲醇65∶35;检测波长:225 nm;流速:0.8 mL·min-1;柱温:26℃;进样量:20 μL。在此色谱条件下,左卡尼汀对照品溶液,4种不同的空白输液以及4种成品输液分别进样,记录色谱图(图1),左卡尼汀对照品的出峰时间为4.7 min左右,理论塔板数按左卡尼汀计不低于1 200。
2.3.2 溶液的配制 对照品溶液:精密称取左卡尼汀对照品约50 mg,置于1.5 mL离心管中,加1.0 mL流动相定容,即制成浓度为50 g·L-1的对照品贮备液。
供试品溶液:取注射用左卡尼汀(1 g)4支,均加8 mL灭菌注射用水慢频次振荡1 min,静置后,分别用500 mL 5%GS、10%GS、GNS 及 0.9%NS 调配为成品输液,即得。
2.3.3 线性关系考察 50 g·L-1的贮备液依次使用流动相稀释,得系列质量浓度对照品溶液(0.25、0.50、1.0、2.0 、4.0 、6.0、8.0 g·L-1)按“2.3.1”项下条件,测定峰面积,以峰面积(Y)为纵坐标,质量浓度(X)为横坐标,绘制标准曲线,得回归方程Y=204 347X+7 134.3(r=0.999 4)。结果表明,注射用左卡尼汀质量浓度在0.25~8.0 g·L-1范围内与峰面积有良好的线性关系。
2.3.4 精密度试验 取左卡尼汀标准品溶液8.0、2.0、0.25 g·L-1三种浓度,各进样 6 次,记录峰面积,RSD 分别为 0.05%、0.12%、0.85%,表明该方法精密度良好。
2.3.5 回收率试验 精密称取适量注射用左卡尼汀共6份,分别用 5%GS、10%GS、GNS及 0.9%NS溶解成一定浓度,按“2.3.1”项下条件进样20 μL,每种输液平行操作6次。计算4种输液的平均回收率分别为 101.5%、99.1%、98.37%、101.4%(n=6),回收率较好,方法可行。
2.3.6 成品输液左卡尼汀的含量变化 按“2.3.2”项下方法制备4种成品输液,分别按“2.3.1”项下色谱条件于 0、2、4、6、8 h 进样,测定峰面积,计算相对含量,结果见表9。
结果分析:在静脉注射液中大于10%的有效成分被分解,则认为该药品与输液不宜配伍[8]。注射用左卡尼汀与10%GS配伍稳定性最差,2 h含量下降近40%;与GNS配伍稳定性也较差,6 h含量下降超过10%;与5%GS、0.9%NS配伍8 h内稳定含量较稳定,适宜配伍。
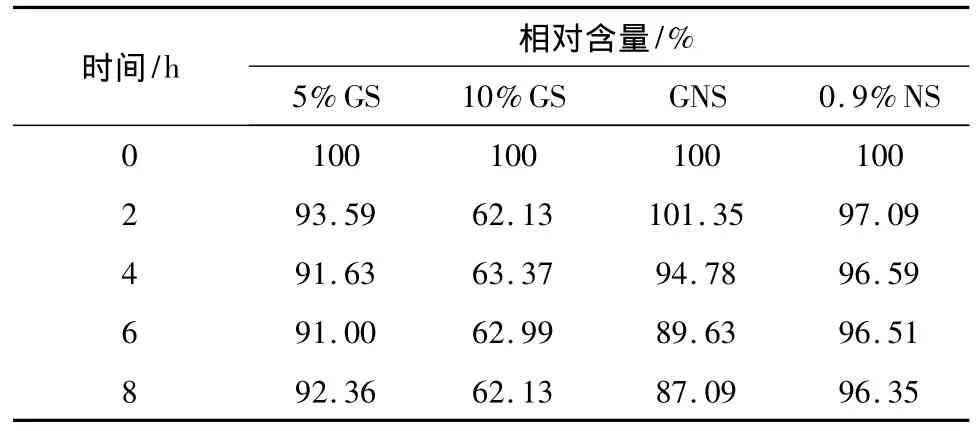
表9 成品输液中左卡尼汀的含量变化
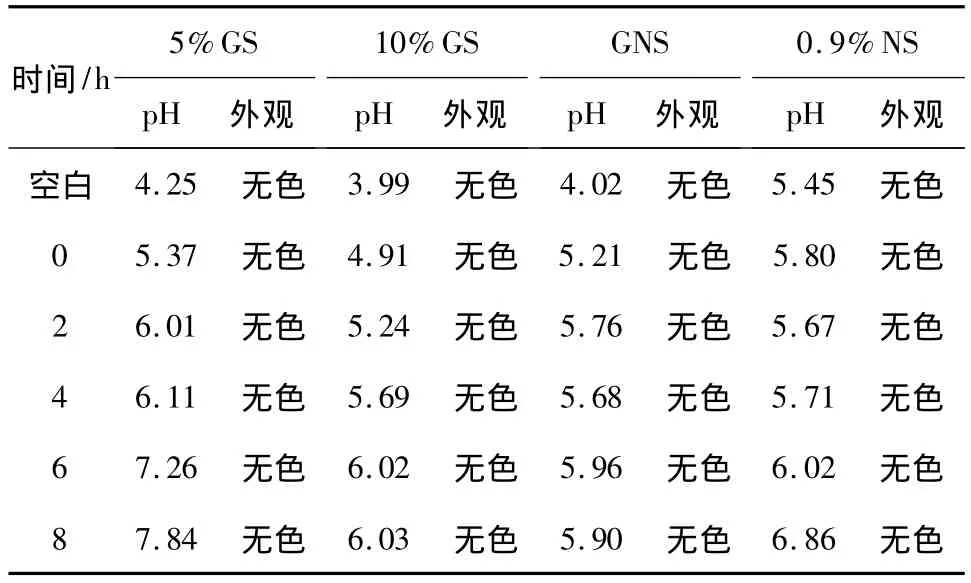
表10 4种成品输液0~8 h p H及外观变化情况
2.3.7 成品输液pH、外观、不溶性微粒检测 在室温(23℃)条件下,依据2010版《中国药典》二部附录ⅥH pH值测定法和附录IX R不溶性微粒检查法分别测定空白输液以及0、2、4、6、8 h的 4种成品输液pH、不溶性微粒数,并观察其外观变化情况,结果见表 10,11。
结果分析:2010版《中国药典》规定[9]标示装量为100 mL或以上的静脉用注射液,除规定外,每1 mL中含10μm及10μm以上的微粒不得过25粒,含25μm及25μm以上的微粒不得过3粒,4种成品输液8 h内不溶性微粒符合规定,且各成品输液pH均在4~9范围内,符合静脉用输液要求。
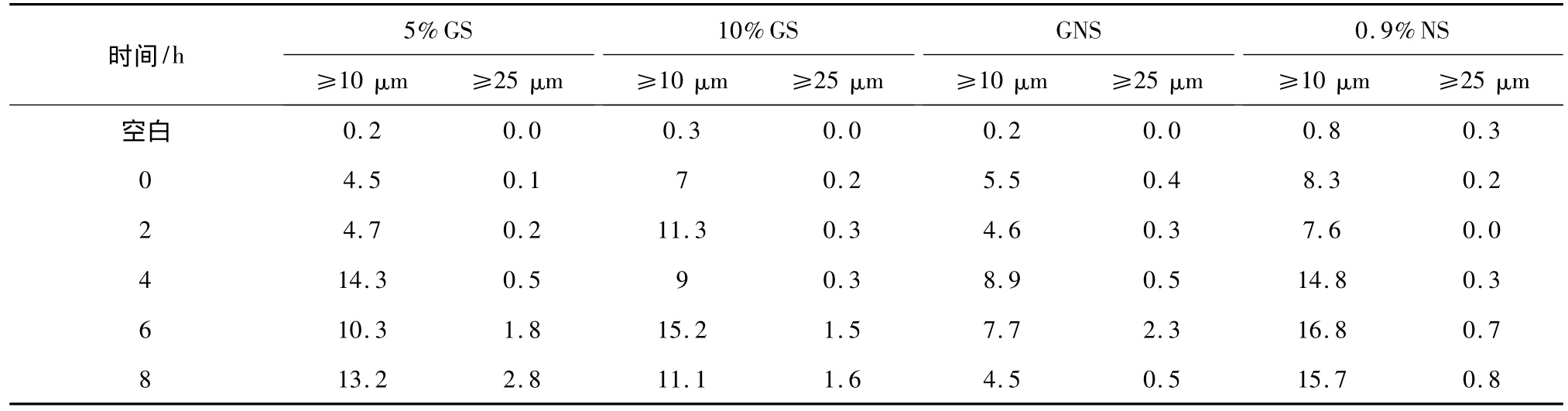
表11 4种成品输液0~8 h不溶性微粒变化情况/mL
3 讨论
左卡尼汀化学名称为(R)-3-羧基-N,N,N-三甲基-1-丙胺氢氧化物,内盐[10],属碱性物质,因此溶于4种不同的空白输液后,成品输液pH均较空白输液有不同程度升高。且依据空白输液pH检测结果,10%GS、GNS 的 pH 相对5%GS、0.9%NS 偏低,因此左卡尼汀在pH稍高的5%GS、0.9%NS输液中稳定性较好。考察成品输液0~8 h不溶性微粒变化情况得知,左卡尼汀在5%GS、0.9%NS输液中不溶性微粒(≥10μm)变化较明显,0~2 h内不溶性微粒(≥10μm)数较小,提示溶解完全,2 h后不溶性微粒(≥10μm)数明显增多,该趋势与同时间段内左卡尼汀含量变化相符,提示临床使用中应尽可能的现配现用。
注射用左卡尼汀说明书推荐其用于静脉滴注的稀释溶媒为0.9%氯化钠或乳酸盐林格注射液,但是对于心血管疾病患者,为了避免增加其心脏负担[11],临床医生更倾向于选用5%GS作为稀释溶媒。因而,本实验在成品输液稳定性方面,为注射用左卡尼汀临床选用5%GS作为稀释溶媒的可行性提供了有效佐证。
根据文献报道[12-14],分别比较磷酸盐溶液(取磷酸二氢钾8.459,磷酸氢二钾0.879,注射用水定容成1 000 mL,磷酸调节pH至3.0)—甲醇(3∶1);磷酸盐缓冲液(取磷酸5.75 mL,加1 mol·L-1氢氧化钠溶液50 mL,加水稀释至1 000 mL,用饱和氢氧化钠溶液调节 pH至2.4)—甲醇—庚烷磺酸钠(980 mL∶20 mL∶0.555 g);0.05 mol·L-1磷酸盐缓冲液(磷酸二氢钾6.81 g,加水溶解并稀释至1 000 mL,磷酸调节pH至4.3)—乙腈(35∶65)等流动相系统,结果发现选择第一种流动相体系时,左卡尼汀峰型最好,旁无杂峰。
本实验优选出注射用左卡尼汀最佳调配方法,即每1 g药粉用8 mL灭菌注射用水溶解,慢频次振荡1 min,溶解后的浓溶液宜使用5%GS或0.9%NS稀释,建议临床注射用左卡尼汀最好现用现配,并应尽可能在8 h内使用完毕,若使用GNS稀释,则应在4 h内使用完毕,不可使用pH最低的10%GS稀释。
[1]李 敏,那 宁,高建军.左旋肉碱改善顺铂诱导肾损伤机制的相关研究[J].安徽医药,2015,19(1):10-13.
[2]Li K,Sun Q.Simultaneous determination of free and total carnitine in human serum by HPLC with UV detection[J].J Chromatogr Sci,2010,48(5):371-374.
[3]Cao Y,Wang YX,Liu CJ,et al.Comparison of pharmacokinetics of L-carnitine,acetyL-L-carnitine and propionyL-L-carnitine after single oral administration of L-carnitine in healthy volunteer[J].Clin Invest Med,2009,32(1):E13-E19.
[4]周慧敏.左卡尼汀对缺血性心力衰竭心室重构、心肌酶学及血脂代谢的影响[J].中国老年学杂志,2014,34(15):4168-4169.
[5]罗 敏,陈世金.左卡尼汀注射液治疗慢性心力衰竭92例疗效观察[J].检验医学与临床,2013,10(24):3357-3358.
[6]耿魁魁,汝婷婷,唐 祺,等.注射用血塞通调配技术正交优化及其在不同溶媒中稳定性考察[J].中国医院药学杂志,2014,34(8):660-664.
[7]杜红芳,耿魁魁,李冬梅,等.注射用红花黄色素与6种输液配伍的稳定性[J].中成药,2014,36(8):1635-1640.
[8]谢 军,刘 圣,朱文君.等.苦碟子注射液与5种常用输液及注射用盐酸川芎嗪配伍后的稳定性考察[J].中成药,2013,35(8):1788-1792.
[9]国家药典委员会.中国药典(二部)[S].北京:中国医药科技出版社,2010:附录Ⅸ C.
[10]Dabrowska M,Starek M.Analytical approaches to determination of carnitine in biological materials,foods and dietary supplements[J].Food Chem,2014,142:220-232.
[11]侯晓平.警惕不当输液引发的心血管系统医源性损害[J].医学与哲学,2012,33(7):63-64.
[12]韦 敏,肖 亿.反相高效液相色谱法测定左卡尼汀的血药浓度[J].中国新药杂志,2006,15(20):1785-1786.
[13]付 彪,张烈云.HPLC法测定注射用左卡尼汀的含量[J].黑龙江医学,2010,23(5):692-693.
[14]闵翠娥,陆 媛,江少仪,等.HPLC法测定左卡尼汀注射液含量及有关物质[J].广东药学院学报,2009,25(6):588-591.
