人参皂苷Rg1对心肌细胞的影响及其信号传导机制
2015-12-08刘燃宋蕊袁丽凌露杨萍郭家智张戈陆地孙林
刘燃,宋蕊,袁丽,凌露,杨萍,郭家智,张戈,陆地,孙林
人参皂苷Rg1对心肌细胞的影响及其信号传导机制
刘燃,宋蕊,袁丽,凌露,杨萍,郭家智,张戈,陆地,孙林
目的:从细胞和分子层面探讨人参皂苷Rg1(G-Rg1)对心肌细胞的影响及其信号传导机制。
方法:体外培养大鼠H9c2心肌细胞,按实验要求随机分13组,每组5个平行孔,分别为空白对照组,单纯缺血缺氧2 h、6 h、12 h、24 h、48 h组,G-Rg1 5 μmol/L、10 μmol/L、50 μmol/L组,缺氧诱导因子-1α(HIF-1α)的特异性抑制剂(YC-1)组,YC-1+G-Rg1组,蛋白激酶B(Akt)蛋白的磷酸化特异性抑制剂(Wortmannin)组,Wortmannin+G-Rg1组。检测G-Rg1、缺血缺氧以及YC-1对心肌细胞活力及心肌细胞损伤的影响。同时用逆转录聚合酶链反应(RT-PCR)检测心肌细胞内HIF-1α、葡萄糖载体蛋白-1(GLUT-1)和血红素氧合酶-1(HO-1)的信使核糖核酸mRNA表达水平变化。用蛋白质免疫印迹法检测HIF-1α、GLUT-1和HO-1、活化转录因子-6(ATF-6)、抑制CCAAT/增强子结合蛋白同源蛋白(CHOP)和Akt等细胞信号通路蛋白表达水平变化。
结果:缺血缺氧时间与心肌细胞活力呈负相关(r=-0.8580,P<0.05),与乳酸脱氢酶溢出率呈正相关(r=0.9201,P<0.05)。G-Rg1 10 μmol/L组较单纯缺血缺氧24 h组细胞活力明显回升(87.8%、62.6%,P<0.05),细胞培养上清乳酸脱氢酶(LDH)含量明显减少(25.0%、74.8%,P<0.05),且上调了HIF-1α、GLUT-1、HO-1的mRNA表达水平(P<0.05)。蛋白质免疫印迹法分析显示:YC-1+G-Rg1组较G-Rg1组,心肌细胞活力下降(68.0%,87.8%,P<0.05),细胞培养上清LDH含量增加(56.4%,25.0%,P<0.05),同时YC-1拮抗了G-Rg1对HIF-1α、GLUT-1、HO-1、ATF-6和CHOP的蛋白表达水平的调控(P<0.05);Wortmannin可拮抗G-Rg1对HIF-1α和CHOP的蛋白表达水平的调控(P<0.05),及对Akt两个磷酸化位点的激活作用(P<0.05)。
结论:心肌细胞损伤程度与缺血缺氧时间有关;G-Rg1对心肌细胞具有保护作用,其机制激活HIF-1α及其下游因子的表达并抑制了内质网应激效应,可能与G-Rg1激活Akt有关。
人参皂苷Rg1;磷脂酰肌醇3激酶;缺氧诱导因子-1α;内质网应激;凋亡
Methods: H9c2 cells were cultured and treated in different conditions by following groups:①Blank control group, ②Hypoxia alone group, the cells were treated for (2, 6, 12, 24, 48) hr respectively, ③G-Rg1 group, the cells were treated by G-Rg1 at (5, 10, 50) μmol/L respectively,④YC-1 group, which is the specifc inhibitor of hypoxia inducible factor-1α (HIF-1α), ⑤YC-1 + G-Rg1 group, ⑥Wortmannin group, which is the specifc inhibitor for protein kinase B (Akt) phosphorylation and ⑦Wortmannin + G-Rg1 group. Each experiment was conducted with 5 replicates. The effects of G-Rg1, hypoxia and YC-1 on cell activity and injury were studied; intracellular mRNA expressions of HIF-1α, glucose
transporter-1 (GLUT-1) and heme oxygenase-1 (HO-1) were examined by RT-PCR; protein expressions of HIF-1α, GLUT-1, HO-1, activating transcription factor-6 (ATF-6), CCAAT/enhancer binding protein homologous protein (CHOP) and Akt with its signal pathway factors were measured by Western blot analysis.
Results: The time of hypoxia was negatively related to cell activity (r=-0.8580, P<0.05) and positively related to LDH overfow rate (r=0.9201, P<0.05). G-Rg1 (10μmol/L) group showed increased cell activity than Hypoxia alone (24 hr) group (87.8% vs 62.6 %, P<0.05), while decreased LDH overfow (25.0% vs 74.8%, P<0.05), and up-regulated mRNA expressions of HIF-1α, GLUT-1 and HO-1, P<0.05. YC-1+ G-Rg1 group had decreased cell activity than G-Rg1 group (68.0% vs 87.8%, P<0.05), while increased LDH overfow (56.4% vs 25.0%, P<0.05). Meanwhile, YC-1 clashed the effect of G-Rg1 on protein expressions of HIF-1α, GLUT-1, HO-1, ATF-6 and CHOP, P<0.05; wortmannin clashed the effect of G-Rg1 on protein expressions of HIF-1α, CHOP, P<0.05 and suppressed the two phosphorylation sites for Akt activation, P<0.05.
Conclusion: G-Rg1 may protect rat’s H9c2 cells in vitro by activating expressions of HIF-1α with its downstream factors and inhibiting endoplasmic reticulum stress, which might be related to the effect of G-Rg1 on Akt activation.
(Chinese Circulation Journal, 2015,30:1096.)
人参皂苷Rg1(G-Rg1)是人参、三七等人参属药材的主要活性成分之一,有促进海马神经生长[1]以及对心血管系统的保护作用[2,3]。磷脂酰肌醇3-激酶(PI3K)和蛋白激酶B(Akt),参与了多种细胞功能的调节,在细胞存活和抗凋亡中起重要作用。心肌细胞缺血缺氧时,其功能、代谢和结构均可能发生变化,同时可表达缺氧诱导因子-1(HIF-1),受缺氧信号调控的HIF-1α是活性亚基,HIF-1的下游基因涉及能量代谢、血管新生、铁与血红素的代谢以及一氧化氮的合成等。内质网应激(ERS)与许多心血管疾病有关,其中抑制CCAAT/增强子结合蛋白同源蛋白(CHOP)是内质网应激介导细胞凋亡的主要通路[4]。研究证明作为依赖缺血缺氧表达的HIF-1和ERS相关因子有潜在的联系[5]。那两者之间是否会存在交叉通路的调控现象,互相影响各自的下游基因表达;G-Rg1对心肌细胞的保护作用是否与抑制ERS介导的细胞凋亡有关,本研究做进一步探讨。
1 材料与方法
主要仪器及试剂:蛋白电泳系统、逆转录聚合酶链反应(RT-PCR)仪、水平电泳系统和凝胶成像仪(BIO-RAD,美国);普通培养箱及三气培养箱(Theromo electron Corporation, 美国);G-Rg1(纯度≥98%,由昆明制药厂提供);Wortmannin及YC-1(Sigma-Aldrich Co. LLC, 美国);HIF-1α(Novus Biologicals, 美国);GLUT-1(Millipore,Germany);血红素氧合酶-1(HO-1)、活化转录因子-6(ATF-6)和甘油醛-3-磷酸脱氢酶(内参,GAPDH)(Santa Cruz Biotechnology, 美国);Akt、phosphor-Akt (Ser473)、phosphor-Akt (Thr308)和CHOP(Cell Signaling technology, 美国);所有PCR引物(Invitrogen Corporation,中国)。
分组:使用10%小牛血清 DMEM/F12 高糖培养液(于2014年购自Santa Cruz Biotechnology, 美国)培养大鼠H9c2心肌细胞(于2014年由广东医学科学研究中心林秋雄教授馈赠),以 1×106个/ml浓度接种于底面积25 cm2培养瓶中,将细胞置于细胞培养箱(37℃,5% CO2饱和湿度)中培养,每隔两天传代。因前期预实验发现进行细胞饥饿同步化处理后,使心肌细胞提前出现应激状态导致后续实验结果不稳定,故当细胞密度均匀生长至 80%~90%时,随机分13组,每组5个平行孔。空白对照组:将高糖培养液置换为无血清 DMEM低糖培养基继续进行培养,不作任何处理;单纯缺血缺氧2 h、6 h、12 h、24 h、48 h组:将高糖培养液置换为无血清 DMEM低糖培养基后进行缺氧,使用1%O2的三气培养箱,处理H9c2心肌细胞 2 h、6 h、12 h、24 h和48 h;G-Rg1 5 μmol/L、10 μmol/L、50 μmol/L组:将高糖培养液置换为无血清 DMEM低糖培养基后再分别加入5、10和50 μmol/L G-Rg1处理细胞0.5 h,而后再置入三气培养箱处理12 h、24 h和48 h;HIF-1α的特异性抑制剂(YC-1)组:将高糖培养液置换为无血清 DMEM低糖培养基后使用10 μmol/L YC-1处理细胞 15 min,置入三气培养箱处理24 h;YC-1+G-Rg1组:将高糖培养液置换为无血清 DMEM低糖培养基后使用10 μmol/L
YC-1处理细胞 15 min,而后用10 μmol/L G-Rg1处理细胞0.5 h,最后置入三气培养箱处理24 h;蛋白激酶B(Akt)蛋白的磷酸化特异性抑制剂(Wortmannin)组:将高糖培养液置换为无血清 DMEM低糖培养基后使用1 μmol/L Wortmannin 处理细胞 15 min,置入三气培养箱处理24 h。Wortmannin+G-Rg1组:将高糖培养液置换为无血清 DMEM低糖培养基后使用1 μmol/L Wortmannin 处理细胞 15 min,而后用10 μmol/L G-Rg1处理细胞0.5 h,最后置入三气培养箱处理6 h、24 h。
细胞活性测定[3]:培养细胞单层铺满 96孔平底板,选取细胞密度均一、状态良好的细胞进行实验,每组设十个孔。按说明书依次加入相应试剂后,酶标仪 OD 550 nm 处测量各孔的吸光值并记录数据。同样实验条件,重复五次。复孔数据求相应均值后依据公式:(缺血缺氧板OD值—空白对照组OD值)/(对照板OD值—空白对照组OD值)求出相应的细胞相对活性。
细胞乳酸脱氢酶(LDH)溢出率测定[6]:按上述的细胞分组处理细胞,不同培养时间后用移液器吸尽培养瓶内的细胞培养上清至高压灭菌的离心管中。向培养瓶内加入1 ml 0.5% TritonX-100,置于普通培养箱,20 min 后用移液器吸尽培养瓶内细胞裂解液至另一批高压灭菌的离心管中。按说明书依次加入相应试剂后,酶标仪 OD 340 nm 处测量各孔的吸光值并记录数据。同样实验条件,重复五次。复孔数据求相应均值后依据公式:LDH(U/L)=(测定OD值 — 对照OD值)/(标准OD值 — 空白OD值)×标准品浓度(0.2 mmol/L)×1000求出细胞培养上清和细胞裂解液各自的LDH含量,再依据公式:LDH%=细胞培养上清LDH/(细胞培养上清LDH+细胞裂解液LDH)× 100%求出相应各组的细胞LDH溢出率百分比。
RT-PCR检测:细胞总RNA提取后进行纯度和浓度测定,按说明书行cDNA逆转录。所有引物已用PubMed BLAST进行引物来源、引物反应条件、引物长度和引物链配对等检测。各基因引物系列见表1。并按照相应反应条件进行PCR扩增,完成后将PCR产物鉴定并定量分析,电泳完成后将琼脂糖胶置于 Bio-Rad ChemiDoc XRS凝胶图像分析系统中拍照采集图像,Quantity one 4.4.0 计算各条带的荧光强度值及其与GAPDH的比值进行定量分析。同样实验条件,重复五次。
蛋白质免疫印迹法检测:蛋白质提取后定量,进行SDS-PAGE聚丙烯酰胺凝胶电泳,而后使用半干转移系统转膜,完成后按照抗体说明书按一定比例依次加入一抗、二抗进行孵育,孵育最佳时间后进行化学发光、显影、定影、拍照并晾干。用扫描仪扫描图片后进行灰度分析。同样实验条件,重复五次。

表1 各基因引物序列
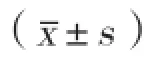
2 结果
缺血缺氧时间与细胞损伤的关系(表2):缺血缺氧时间与心肌细胞活力呈负相关(r=-0.8580,P<0.05),与细胞培养上清LDH含量呈正相关(r=0.9201,P<0.05),验证了体外缺血缺氧模型的建立。RT-PCR分析显示HIF-1α、葡萄糖载体蛋白-1(GLUT-1)和HO-1在心肌细胞缺血缺氧2 h出现mRNA表达高峰。
表2 缺血缺氧时间与细胞损伤的关系
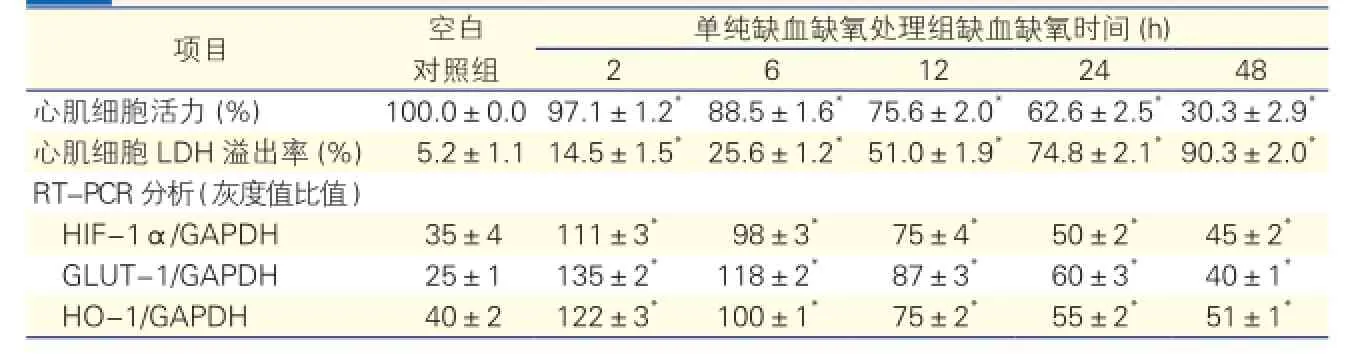
表2 缺血缺氧时间与细胞损伤的关系
注:LDH:细胞乳酸脱氢酶;RT-PCR:逆转录聚合酶链反应。与空白对照组比*P< 0.05。余注见表1
?
不同剂量G-Rg1对心肌细胞的作用(图1):分别用5 μmol/L、10 μmol/L和50 μmol/L的浓度梯度G-Rg1预处理心肌细胞,发现的G-Rg110 μmol/L组较
单纯缺血缺氧24 h组细胞活力明显回升(87.8%、62.6%,P<0.05),细胞培养上清LDH含量明显减少(25.0%、74.8%,P<0.05),且上调了HIF-1α、GLUT-1、HO-1的信使核糖核酸mRNA表达水平(P<0.05)。

图1 浓度梯度的G-Rg1 对心肌细胞内三个因子信使核糖核酸表达的RT-PCR 图
G-Rg1可抑制内质网应激介导的细胞凋亡(图2):蛋白质免疫印迹法分析显示:YC-1+G-Rg1组较G-Rg1组,心肌细胞活力下降(68.0%,87.8%,P<0.05),细胞培养上清LDH含量增加(56.4%,25.0%,P<0.05)。同时YC-1拮抗了G-Rg1对HIF-1α、GLUT-1、HO-1、ATF-6和CHOP的蛋白表达水平的调控(P<0.05)。
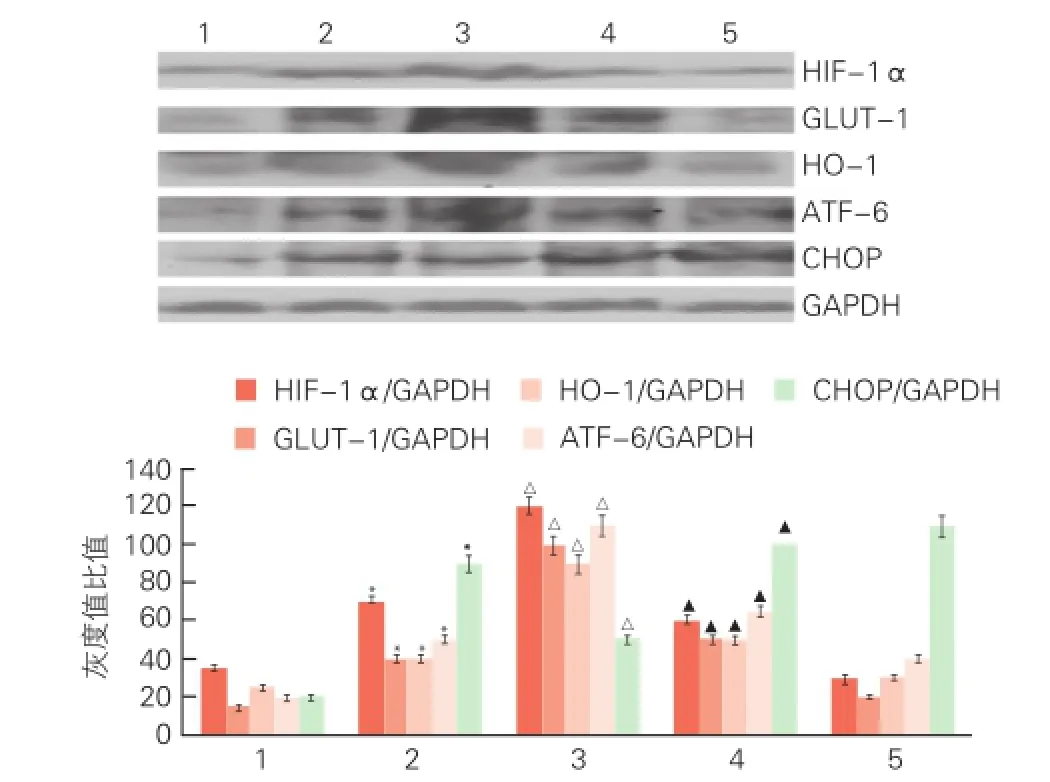
图2 YC-1拮抗G-Rg1对心肌细胞内HIF-1α、GLUT-1、HO-1、ATF-6和CHOP的蛋白水平的调控作用的蛋白质免疫印迹法图
G-Rg1通过激活Akt信号通路抑制了CHOP介导的心肌细胞凋亡(图3、4):蛋白质免疫印迹法分析显示用Wortmannin预处理后,可拮抗G-Rg1对HIF-1α和CHOP的蛋白表达水平的调控(P<0.05)。同时可拮抗G-Rg1在对Akt两个磷酸化位点的激活作用(P<0.05)。
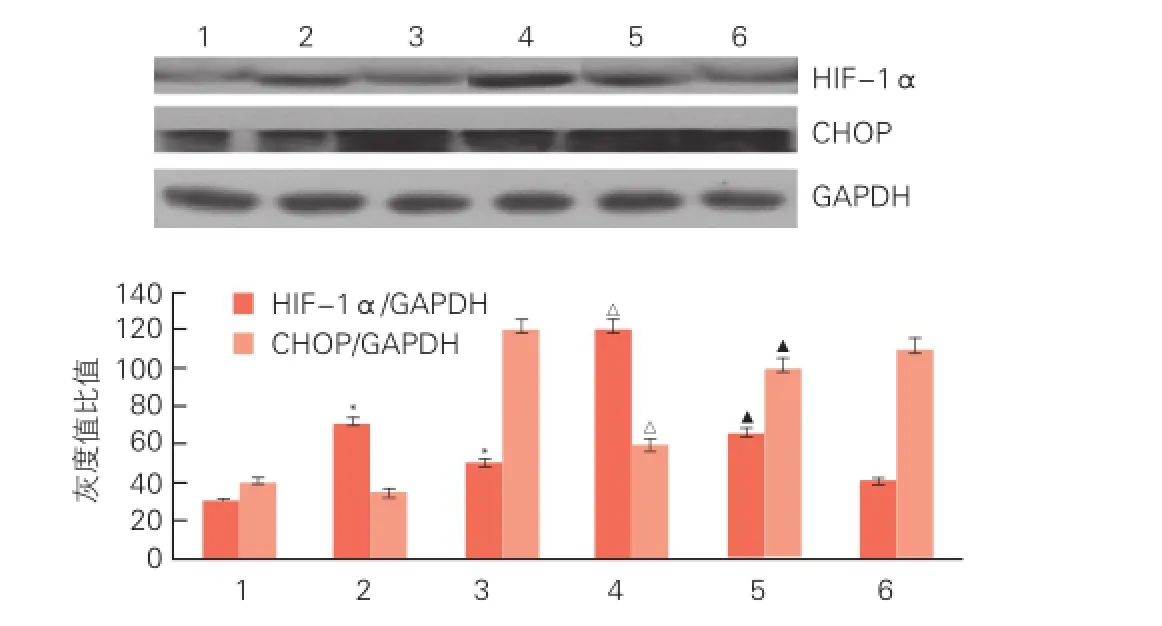
图3 Wortmannin拮抗G-Rg1对HIF-1α和CHOP的蛋白表达水平调控的蛋白质免疫印迹法图
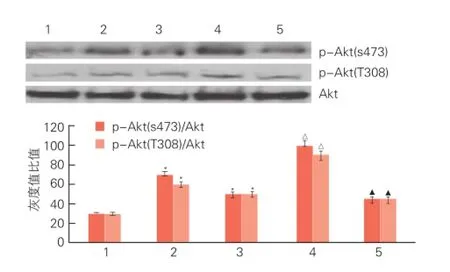
图4 Wortmannin拮抗G-Rg1对Akt的蛋白磷酸化调控的蛋白质免疫印迹法图
3 讨论
HIF-1α是缺血前预处理和远端缺血预处理起到心肌保护作用的关键调控基因[7,8],经脯氨酸羟
化酶(PHD)羟化修饰后降解,缺氧、药物等刺激抑制PHD活性,使HIF-1α蛋白迅速增加,HIF-1α与HIF-1β聚合形成异二聚体,发挥转录因子的作用,调节靶基因的表达。缺氧时,HIF-1α可激活心肌营养蛋白-1以抑制心肌凋亡[9],同时抑制心肌过度收缩,以保持降低能量代谢[10]。当氧化磷酸化过程受抑制时,HIF-1通过诱导GLUT-1和糖酵解酶类以增加糖酵解,满足心肌对能量代谢的需要。HO-1可催化降解血红素产生铁离子、胆红素和一氧化碳,能抑制动脉斑块和粥样硬化的形成及发展并保护心肌。本研究发现HIF-1α、GLUT-1和HO-1 三个内源性保护因子的mRNA表达高峰出现在缺血缺氧2 h时,通过G-Rg1预处理后,可使三个因子mRNA表达水平和蛋白水平的高峰明显延长,起到更长时间的保护作用。
适度的ERS是种细胞保护机制,可使内质网固有分子伴侣增加、蛋白质翻译受抑制、未折叠蛋白的降解增加或自噬作用增强。研究发现G-Rg1可抑制神经毒性致内质网应激介导的细胞凋亡[11]。CHOP基因缺陷小鼠可避免缺血再灌注引起的心肌细胞炎症及凋亡[12]。适当的ERS可增加ATF-6表达,以增强心肌在缺血再灌注中的生存能力[13,14],同时还可以抑制由CHOP介导的细胞凋亡[15]。一些ERS分子伴侣如HO-1等可同时由ATF-6和HIF-1诱导表达。心肌梗死后,使用HIF-1的下游因子促红细胞生成素的注射治疗,可抑制CHOP介导的凋亡,保护缺血心肌以改善心功能[16]。本研究发现G-Rg1激活HIF-1α后上调了ATF-6表达,同时下调了CHOP的表达,抑制HIF-1α表达后明显削弱了G-Rg1对CHOP表达的抑制效应,提示HIF-1可能位于ATF-6、CHOP的调控上游。但CHOP的下调与ATF-6的上调是否有关,本研究尚未探讨。
PI3-K/Akt信号通路在缺血缺氧诱导的损伤反应中发挥了保护作用,而PI3K/Akt信号通路可调控HIF-1α其下游因子, G-Rg1可抑制脂多糖诱导炎性蛋白酶及促炎性细胞因子的表达[17],也可以通过PI3K/Akt信号通路上调HIF-1α及其下游基因,提示PI3K/Akt位于HIF-1α和CHOP的调控上游。本研究证实G-Rg1先激活PI3-K/Akt信号通路Akt的两个磷酸化位点后,再上调了HIF-1α及其下游保护因子的表达,起到保护心肌细胞的作用,并通过上调HIF-1α的表达以抑制内质网应激介导的凋亡因子CHOP的表达,减少了心肌细胞的伤亡。初步证实了作为依赖缺血缺氧表达的HIF-1和ERS相关因子之间存在交叉通路的调控现象,G-Rg1对心肌细胞的保护作用与抑制ERS介导的细胞凋亡有关。这些发现解释了G-Rg1发挥其保护效应涉及到的部分信号通路之间的调控关系。随着越来越多G-Rg1机制学研究的完善,可使其成为临床上用于保护心肌细胞的关键药物。
[1] 陈彦, 吴鸿浩, 何斌, 等. 人参皂苷Rg1对大鼠海马神经元缺糖氧/复糖氧后钙内流的影响. 中国急救医学, 2012, 010: 1002-1949.
[2] 张庆勇, 陈燕萍, 刘芬, 等. 人参皂苷Rg1对大鼠急性心肌缺血抗氧化损伤指标及超微结构的影响. 中国循环杂志, 2015, 30: 164-167.
[3] Zhang ZL, Fan Y, Liu ML. Ginsenoside Rg1 inhibits autophagy in H9c2 cardiomyocytes exposed to hypoxia/reoxygenation. Mol Cell Biochem, 2012, 365: 243-250.
[4] Xu J, Zhou Q, Xu W, et al.Endoplasmic reticulum stress and diabetic cardiomyopathy.Exp Diabetes Res, 2012, 2012: 1-12.
[5] 刘燃, 孙林, 张戈. 人参皂苷Rg1对缺血再灌注损伤的保护机制研究进展. 中国循环杂志, 2014, 29: 77-79.
[6] Cuadrado I, Fernández-Velasco M, Boscá L, et al. Labdane diterpenes protect against anoxia/reperfusion injury in cardiomyocytes: involvement of AKT activation. Cell Death Dis. 2011, 11: e229.
[7] Sarkar K, Cai Z, Gupta R, et al. Hypoxia-inducible factor 1 transcriptional activity in endothelial cells is required for acute phase cardioprotection induced by ischemic preconditioning. Proc Natl Acad Sci USA, 2012, 109: 10504-10509.
[8] Cai Z, Luo W, Zhan H, et al. Hypoxia-inducible factor 1 is required for remote ischemic preconditioning of the heart. Proc Natl Acad Sci USA, 2013, 110: 17462-17467.
[9] Robador PA, San Jose G, Rodriguez C, et al. HIF-1-mediated upregulation of cardiotrophin-1 is involved in the survival response of cardiomyocytes to hypoxia. Cardiovasc Res, 2011, 92: 247-255.
[10] Ronkainen VP, Skoumal R, Tavi P. Hypoxia and HIF-1 suppress SERCA2a expression in embryonic cardiac myocytes through two interdependent hypoxia response elements. J Mol Cell Cardiol, 2011, 50: 1008-1016.
[11] Luo FC, Zhou J, Lv T, et al. Induction of endoplasmic reticulum stress and the modulation of thioredoxin-1 in formaldehyde-induced neurotoxicity. Neurotoxicology, 2012, 33: 290-298.
[12] Miyazaki Y, Kaikita K, Endo M, et al. C/EBP homologous protein deficiency attenuates myocardial reperfusion injury by inhibiting myocardial apoptosis and inflammation. Arterioscler Thromb Vasc Biol, 2011, 31: 1124-1132.
[13] Belmont PJ, Chen WJ, Thuerauf DJ, et al. Regulation of microRNA Expression in the Heart by the ATF6 Branch of the ER Stress Response. J Mol Cell Cardiol, 2012, 52: 1176-1182.
[14] Doroudgar S, Thuerauf DJ, Marcinko MC, et al. Ischemia activates the ATF6 branch of the endoplasmic reticulum stress response. J Biol Chem, 2009, 284: 29735-29745.
[15] Isodono K, Takahashi T, Imoto H, et al. PARM-1 is an endoplasmic reticulum molecule involved in endoplasmic reticulum stress-induced apoptosis in rat cardiac myocytes. PLoS One, 2010, 5: e9746.
[16] 马骥, 郑呜之, 俞月萍. 促红细胞生成素抑制心梗大鼠心肌核转录因子CHOP表达的研究. 中国药学杂志, 2011, 46: 25-27
[17] Zong Y, Ai QL, Zhong LM, et al. Ginsenoside Rg1 attenuates lipopolysaccharide-induced inflammatory responses via the phospholipase C-γ1 signaling pathway in murine BV-2 microglial cells. Curr Med Chem, 2012, 19: 770-779.
Effect of Ginsenoside-rg1 on Rat's Cardiomyocytes With its Mechanism of Signal Pathway in vitro
LIU Ran, SONG Rui, YUAN Li, LING Lu, YANG Ping, GUO Jia-zhi, ZHANG Ge, LU Di, SUN Lin.
Department of Cardiology Third Ward, The second Affliated Hospital of Kunming Medical University, Kunming (650101), Yunnan, China
Co-corresponding Authors: SUN Lin, Email: sunlinkm@sina.com and LU Di, Email: ludi20040609@126.com
Objective: To investigate the effect of ginsenoside-rg1 (G-Rg1) on rat’s cardiomyocytes H9c2 with its mechanism of signal pathway in vitro.
Ginsenoside-rg1; Phosphoinositide-3 kinase; Hypoxia inducible factor-1α; Endoplasmic reticulum stress; Apoptosis
2015-03-31)
(编辑:王宝茹)
国家自然科学基金(81260061);云南省科技厅-昆明医科大学联合专项基金(2012FB046、2014FB047);云南省科技厅-昆明医科大学应用基础研究联合专项重点项目(2013FB101)
650101 云南省昆明市,昆明医科大学第二附属医院 心内科三病区(刘燃、宋蕊、袁丽、凌露、张戈、孙林);昆明医科大学生物医学工程中心(杨萍、郭家智、陆地)
刘燃 住院医师 硕士 主要从事冠心病及缺血再灌注损伤研究 Email:179143498@qq.com 通讯作者:孙林 Email:sunlinkm@sina.com陆地 Email:ludi20040609@126.com
R54
A
1000-3614(2015)11-1096-05
10.3969/j.issn.1000-3614.2015.11.015
