阿托伐他汀对小鼠压力负荷诱导的心室重构的保护作用及机制研究
2015-12-08赵地王维张小娟郭伟星赵添姜红菊赵卓
赵地,王维,张小娟,郭伟星,赵添,姜红菊,赵卓
基础与实验研究
阿托伐他汀对小鼠压力负荷诱导的心室重构的保护作用及机制研究
赵地,王维,张小娟,郭伟星,赵添,姜红菊,赵卓
目的:观察阿托伐他汀对小鼠主动脉弓缩窄(TAC) 术后心室重构的保护作用并探讨其可能机制。
方法:采用主动脉弓缩窄法建立小鼠心肌肥厚模型。选取48只C57BL/6小鼠,随机分为4组(每组12只):假手术组、TAC组、TAC+缬沙坦组,TAC+阿托伐他汀组,术后4 周成功造模并分别给予生理盐水、缬沙坦(5 mg/kg)、阿托伐他汀(10 mg/kg)处理。8周后进行超声心动图检查,测量左心室舒张期前壁厚度(LVAWd),左心室舒张期后壁厚度(LVPWd),左心室射血分数(LVEF)及短轴缩短率(FS),计算心肌肥厚指数。应用免疫蛋白印迹(Western blot)法检测核转录因子-κB(NF-κB)的蛋白表达水平。碱水解法检测心肌组织羟脯氨酸(Hyp)的含量、采用酶联免疫吸附(ELISA)法检测血清肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)的浓度。苏木素-伊红(HE)染色及马松(Masson)染色方法测定心肌胶原沉积。
结果:与假手术组相比,TAC组LVAWd、LVPWd、心肌肥厚指数、心肌纤维化面积明显增加(P<0.01),NF-κB的蛋白水平,Hyp含量、TNF-α、IL-1β浓度明显升高(P<0.01)。与TAC组相比,TAC+阿托伐他汀组和TAC+缬沙坦组心肌肥厚指数明显改善, LVAWd和LVPWd减小,纤维化面积减小(P均<0.01),NF-κB的蛋白水平,Hyp含量、TNF-α、IL-1β浓度明显下降(P均<0.01)。
结论:阿托伐他汀对压力超负荷诱导的心肌肥厚有保护作用,其作用机制可能与抗炎作用有关。
阿托伐他汀;压力负荷;主动脉弓缩窄术;心肌肥厚;炎症因子
Methods: A total of 48 C57BL/6 mice were randomly divided into 4 groups: Sham group, TAC group, TAC + valsartan group and TAC + atorvastatin group, n=12 in each group. Myocardial hypertrophy model was successfully established at 4 weeks after the operation, and then the animals were further treated by normal saline, valsartan 5mg/kg and atorvastatin 10mg/kg respectively for 8 weeks. Left ventricular anterior wall thickness at diastole (LVAWd), left ventricular posterior wall thickness at diastole (LVPWd), LVEF and left ventricular fractional shortening (FS) were examined by echocardiography, cardiac hypertrophy indexes were calculated. Protein expression of NF-κB was detected by Western blot analysis, cardiac tissue hydroxyproline (Hyp) level was measured by alkaline hydrolysis, serum levels of TNF-α, IL-1β were determined by ELISA, cardiac collagen deposition was identifed by HE and Masson staining.
Results: Compared with Sham group, TAC group had increased LVAWd, LVPWd, cardiac hypertrophy indexes and increased area of cardiac fibrosis, all P<0.01; elevated protein expressions of NF-κB, Hyp, TNF-α, IL-1β, all
P<0.01. Compared with TAC group, TAC + valsartan group and TAC + atorvastatin group presented improved cardiac hypertrophy indexes, decreased LVAWd, LVPWd and decreased area of cardiac fbrosis, all P<0.01; reduced protein expressions of NF-κB, Hyp, TNF-α, IL-1β, all P<0.01.
Conclusion: Atorvastatin had protective roll on myocardial hypertrophy induced by pressure overload in experimental mice, which might be related to its anti-infammatory effect.
(Chinese Circulation Journal, 2015,30:1090.)
心肌肥厚(MH)是心脏维持适当收缩功能对各种病理状态的代偿反应,持续性心肌肥厚可使心肌细胞损伤纤维化,最终可导致心力衰竭[1],及早干预心肌肥厚的发生,是延缓心力衰竭的有效手段[2]。近年来,研究发现炎症因子在心肌肥厚的形成中具有重要作用[3]。而他汀类药物具有调脂、抗炎、改善内皮细胞功能和改善和逆转心肌肥厚的作用[4]。本研究采用压力负荷诱导C57BL/6小鼠建立心肌肥厚模型,探讨阿托伐他汀是否通过抑制炎症因子的表达改善心肌重构,进一步探讨他汀类药物抑制心肌肥厚的机制。
1 材料与方法
材料与试剂:阿托伐他汀(10 mg,辉瑞制药有限公司)。缬沙坦胶囊(80 mg,诺华制药有限公司)。兔单克隆抗核转录因子-κB(NF-κB)抗体购于美国cell signaling technology公司。肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)试剂盒由北京普尔伟业生物科技有限公司提供(批号20141008)。马松(Masson)染色试剂盒、苏木素-伊红(HE)染色试剂盒由珠海贝索生物技术有限公司提供。
模型建立及实验分组:选取清洁级8周龄C57BL/6雄性小鼠48只[北京华孚康生物科技实验动物中心提供,许可证号:SCXK(京)2014-0004],饲养环境:山东省医学科学院实验室。平均室温为(23±3)℃,每笼6只。小鼠适应环境一周后通过主动脉弓缩窄(TAC)术建立心肌肥厚模型。具体步骤如下:用异氟烷雾化吸入麻醉,仰卧位固定小鼠,胸骨正中切口,在心底部分离主动脉弓部,用 7号手术丝线将针头和主动脉弓一齐扎紧后将针头移去,关胸术后,依次关胸腔、肌层和皮肤,缩窄程度约为75%~80%。碘伏消毒皮肤预防感染。
48只小鼠随机分为4组(每组12只):假手术组、TAC组、TAC+缬沙坦组,TAC+阿托伐他汀组。假手术组不行主动脉弓结扎。术后4周造模成功,TAC+缬沙坦组,TAC+阿托伐他汀组分别给予缬沙坦和阿托伐他汀。各组小鼠体重差异无统计学意义(P>0.05)。
TAC+缬沙坦组小鼠给予缬沙坦(5 mg/kg),TAC+阿托伐他汀组给予阿托伐他汀(10 mg/kg),均溶于1 ml生理盐水中制成悬液,采用灌胃给药;TAC组给予生理盐水(1.0 mg/kg)灌胃,根据小鼠体重增长情况增加给药剂量,持续8周。
超声心动图检查:TAC术后4周和8周,用Vevo770超声仪(加拿大VisualSonics公司),采用30 MHz高频探头进行小鼠超声检查,将小鼠吸入麻醉,取胸骨旁左心室长轴观,在二尖瓣键索乳头肌水平取M型超声切面图像,获得二维引导下10个心动周期的M型超声心动图记录并测量左心室舒张期前壁厚度(LVAWd),左心室舒张期后壁厚度(LVPWd),左心室射血分数(LVEF)和短轴缩短率(FS)。
心肌肥厚指数测定:术后4周、8周,小鼠禁食12 h称重,处死,摘取心脏,精密天平称全心重量(HW),剪除心房和右心室,称左心室重量(LVW),计算心重指数(HWI)=HW/BW,左心室重量指数(LVWI)=LVW/BW,肺脏重量与体重的比值(LW/ BW)以及心脏重量与胫骨长度比值(HW/TL)。左心室重量指数表示心肌肥厚程度。取部分左心室组织放入冻存管,标号后立即置于- 80℃冰箱。
心肌组织学分析:沿左心室冠状面中部切取环状心肌组织块,4%甲醛固定过夜,酒精梯度脱水后石蜡包埋,进行HE染色以及Masson染色,光学显微镜下拍照(400倍),用Image-Pro Plus 5.0软件随机测定HE染色切片中五个视野心肌细胞横截面积(CSA)后统计分析,计算心肌纤维化面积。
免疫蛋白印迹(Western blot) 法测定核转录因子-κB蛋白表达:取约 100 mg左心室心肌组织加入裂解液剪碎后移入1.5 ml离心管中,超声粉碎,4℃12 000 rpm离心15 min,进行蛋白定量,取等量的样品进行变性,SDS-聚丙烯酰胺凝胶,90 V恒压电泳,转膜,封闭,洗膜,加入1:800稀释一抗,4℃过夜,用洗膜液漂洗后加入1:1000 稀释的二抗,摇床上杂交90 min,用TBST(NaCL87.6 g,Tris-HCL缓冲液100 ml,加Tween20 5 ml,转入1 L双蒸水调整pH至7.4)冲洗3遍,每次5 min,然后加上化学发光剂(ECL)显色,上机检测以β-肌动蛋白(β-actin)为内参,根据NF-κB和β-actin密度分析结果比值。
TNF-α、IL-1β、羟胖氨酸水平的测定:用酶联免疫吸附(ELISA)法检测血清TNF-α、IL-1β的浓度。药物干预后断头取血4 ml,分离血清,-20℃保存。4℃3 000 r/min 离心5 min,取上清液,具体操作严格按试剂盒说明书进行。用碱水解法测定心肌组织羟脯氨酸(Hyp)的含量。
2 结果
4组小鼠基本情况和TAC模型建立:假手术组小鼠生长发育良好,皮毛光滑、活动灵活、摄食摄水正常。TAC术后1周小鼠出现活动量降低,摄食减少。TAC+缬沙坦组、TAC+阿托伐他汀组小鼠的状况较TAC组有好转。假手术组无小鼠死亡,TAC组小鼠的存活率83.3%(10/12)。最终完成实验的小鼠共42只,其中假手术组12只,TAC组、TAC+缬沙坦组、TAC+阿托伐他汀组各10只。4周后假手术组和TAC组随机各处死2只取心脏观察,与假手术组比较,TAC组心脏明显增大,重量增加。超声心动图显示:TAC组LVAWd、LVPWd明显高于假手术组(P<0.01) ,表明心肌肥厚模型建立成功。
4组小鼠的超声心动图检测结果比较(图1、表1):与假手术组相比,TAC组小鼠LVAWd、LVPWd在术后4周、8周均有增厚(P<0.01),各组小鼠的LVEF、FS差异无统计学意义(P>0.05)。提示心脏整体收缩功能正常,表明心肌肥厚模型建立而没有发生心力衰竭。与TAC组比较,TAC+缬沙坦组、TAC+阿托伐他汀组LVAWd、LVPWd均显著降低(P<0.01)。

图1 四组小鼠心脏M型超声心动图切面图像
表1 四组小鼠超声心动图参数

表1 四组小鼠超声心动图参数
注:LVAWd:左心室舒张期前壁厚度,LVPWd:左心室舒张期后壁厚度,LVEF:左心室射血分数,FS:短轴缩短率。与假手术组比**P<0.01;与TAC组比△△P<0.01
?
4组小鼠的心肌肥厚指数比较(图2):与假手术组比较,TAC组的心重指数(HWI)、左心室重量指数(LVWI)、LW/BW、HW/TL比值均升高(P<0.01),说明TAC组心肌肥厚。TAC+阿托伐他汀组和TAC+缬沙坦组 HWI、LVWI、LW/BW、HW/TL与TAC组相比显著降低(P< 0.01)。
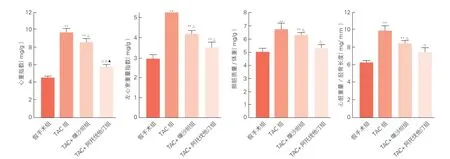
图2 四组小鼠的心重指数、左心室重量指数、肺脏重量/体重比值、心脏重量/胫骨长度比值的比较
心肌组织形态学的影响(图3、4、5):HE染色显示,4周后假手术组心肌纤维细胞排列整齐、形态完整。TAC组心肌细胞肥大,心肌纤维排列紊乱,形态不规整,胞核深染。而TAC+缬沙坦组和TAC+阿托伐他汀组心肌细胞排列整齐,心肌细胞肥大减轻,细胞间隙缩小。TAC术后4周和8周的心肌细胞横截面积显著增加(P<0.01),与TAC组相比,TAC+缬沙坦组和TAC+阿托伐他汀组的心肌细胞横截面积显著减小(P<0.01),但两组间差异无统计学意义。提示阿托伐他汀和缬沙坦抑制了压力负荷介导的心肌细胞横截面积的增大。图3为术后4周和8周的HE染色选自每组10只小鼠的切片中抽样显示的图片。
Masson染色:胶原纤维呈蓝绿色,心肌纤维呈红色。假手术组胶原组织染色均为阴性,心肌纤维排列整齐;TAC组心肌细胞肿大,肌纤维排列疏松紊乱,间质中有胶原纤维增生。TAC+阿托伐他汀组胶原纤维沉积改善效果最佳,且优于TAC+缬沙坦组,两种药物均能有效抑制小鼠心肌肥厚和纤维化。图4为术后4周和8周的Masson染色选自每组10只小鼠的切片中抽样显示的图片。
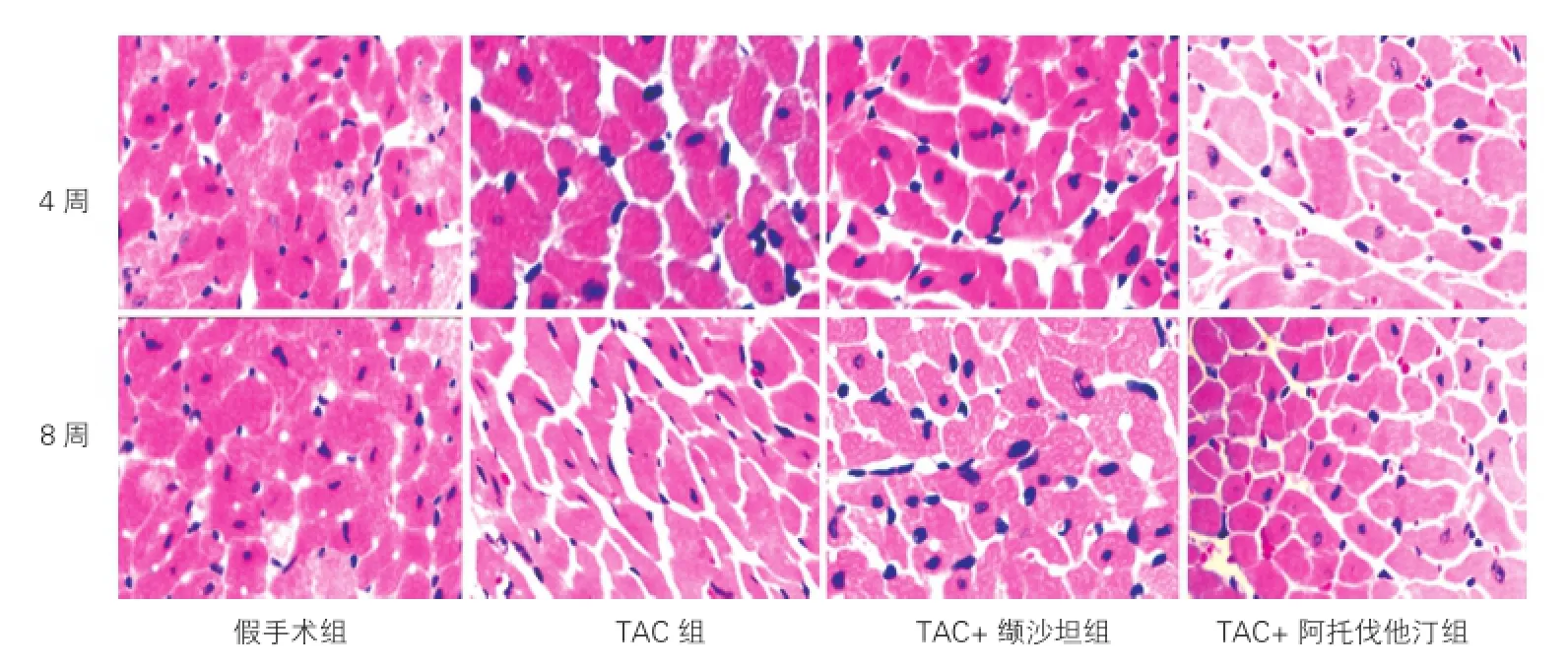
图3 苏木素-伊红染色观察术后4周、8周四组小鼠心肌组织的变化(×400)
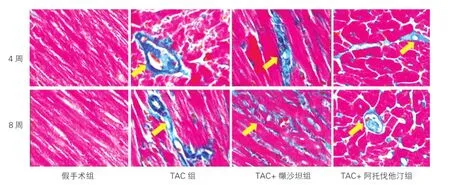
图4 马松染色观察干预4周、8周后四组小鼠心肌组织的变化(×400)
Western blot 法测定小鼠心肌组织 NF-κB含量的测定(图6):与假手术组相比,TAC组NF-κB表达明显升高(P<0.01);与TAC组相比,TAC+阿托伐他汀组、TAC+缬沙坦组NF-κB 表达明显降低(P<0.01),但TAC+阿托伐他汀组与TAC+缬沙坦组比较差异无统计学意义(P>0.05)。
Hyp、TNF-α、IL-1β含量测定:与假手术组相比,TAC组、TAC+阿托伐他汀组、TAC+缬沙坦组Hyp明显增加,TNF-α、IL-1β浓度也明显升高(P<0.01);与TAC组相比,TAC+阿托伐他汀组和TAC+缬沙坦组Hyp明显减少,纤维化程度减轻(P<0.01),TNF-α、IL-1β浓度明显降低(P<0.01)。
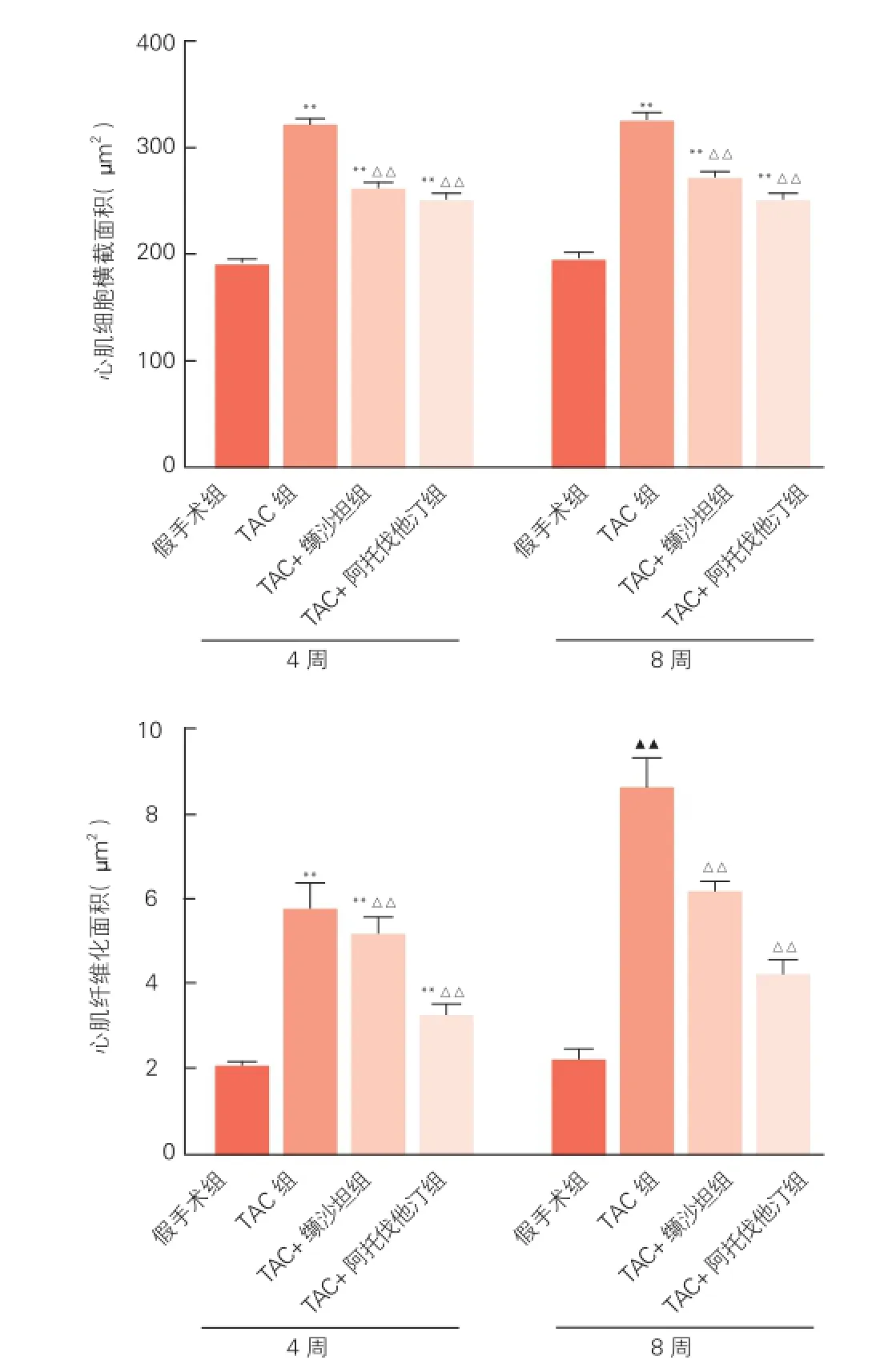
图5 四组小鼠在TAC术后4周、8周小鼠心肌细胞横截面积、心肌纤维化面积的变化
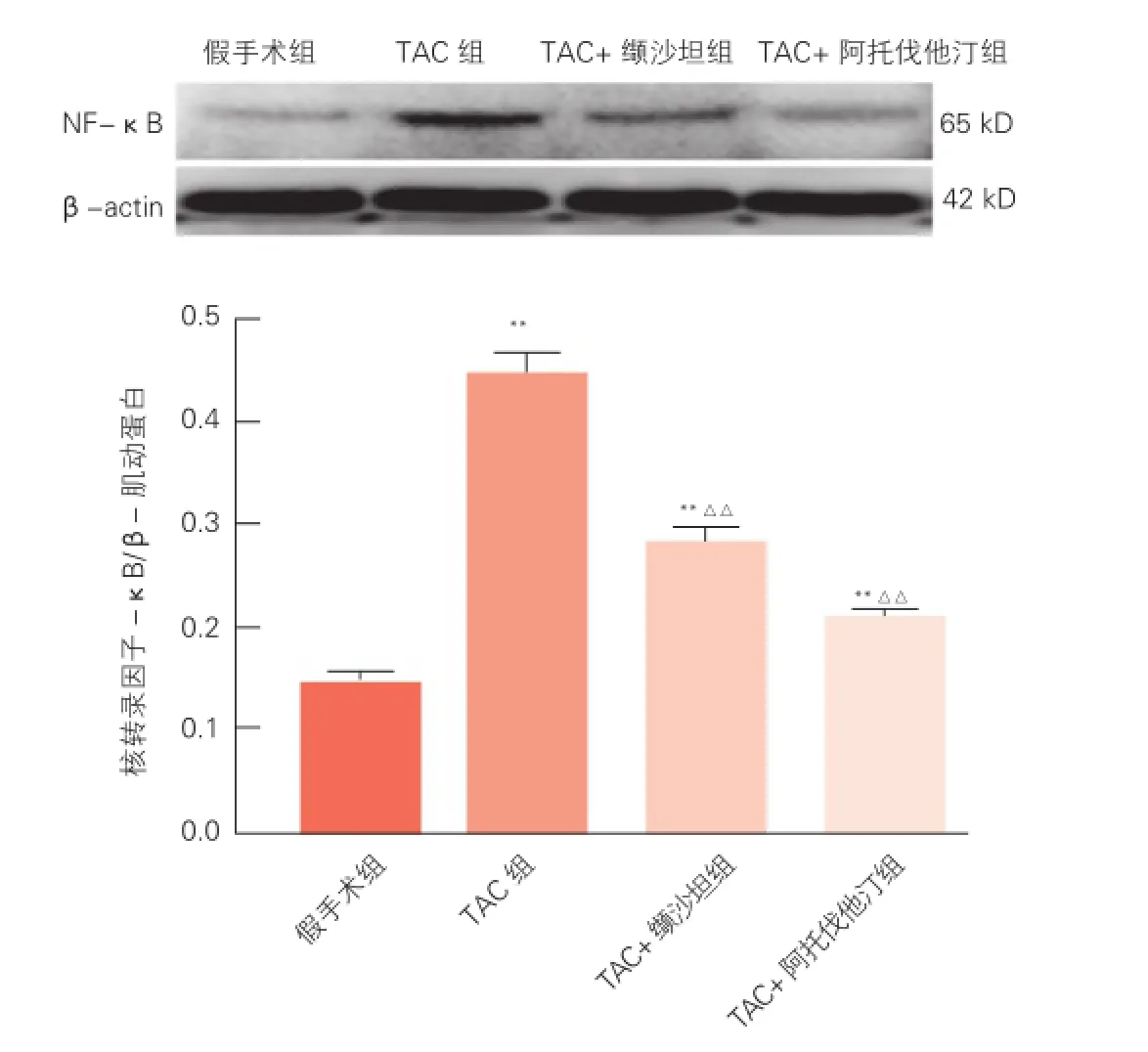
图6 免疫蛋白印迹法检测4组小鼠心肌组织核转录因子-κB的含量比较
表2 四组小鼠血清中羟脯氨酸、肿瘤坏死因子-α、白细胞介素-1β含量

表2 四组小鼠血清中羟脯氨酸、肿瘤坏死因子-α、白细胞介素-1β含量
白细胞介素-1β (μg/L)假手术组235±341.58±0.380.11±0.04 TAC组382±22*2.74±0.14**0.24±0.06**TAC+缬沙坦组 300±28**△△2.26±0.38**△△0.20±0.03**△△TAC+阿托伐他汀组276±18*△△1.94±0.49*△△0.15±0.04*△△分组羟脯氨酸(μg/g)肿瘤坏死因子-α (μg/L)
3 讨论
心肌肥厚是众多心血管疾病共同的病理过程,研究发现肥厚的心肌中存在严重的炎症反应,而一系列的炎症应答会加重心肌损害,引起心肌重构,最终会导致心力衰竭[4]。心肌肥厚以心肌细胞肥大及间质成分的改变(心肌重构)为特点。本实验旨在观察经阿托伐他汀干预后压力超负荷所致心肌肥厚小鼠心肌组织中炎症细胞因子的表达,探讨阿托伐他汀对心肌重构的影响及可能机制,为临床治疗提供理论及实践依据。
各种病理性刺激引起的压力负荷(如高血压、主动脉狭窄)通过信号通路转导,在早期引起心肌细胞代偿性的肥大,表现为心室壁的增厚和心室收缩功能的增强[5]。胸主动脉弓缩窄术致心肌肥厚模型是通过增加心脏的压力负荷从而产生明显的左心
室肥厚,左心室舒张功能减退和心室重构。本实验参照文献建立小鼠压力负荷引起心肌肥厚模型[6],TAC术后4周超声观察左心室室壁增厚,而左室射血分数正常。HWI、LVWI、LW/BW、HW/TL显著性增加,结合HE染色见心肌细胞肥大,CSA显著增大。Masson染色心肌纤维增粗,胶原纤维增生。Hyp水平明显增加,纤维化明显加重。提示TAC术后4周即已形成心肌肥厚和心肌纤维化,TAC模型成功建立。
他汀类药物独立于调脂作用以外的作用包括:改善血管内皮功能失调、抑制炎症反应、抗血栓形成、稳定动脉硬化斑块。研究结果表明阿托伐他汀组可以减轻压力负荷增加引起的小鼠心肌肥厚程度,降低HWI、LVWI、LW/BW、HW/TL的比值。HE染色和Masson染色证明心肌细胞肥大程度减轻,胶原纤维减少。提示阿托伐他汀抑制CSA和纤维化面积的增大,能有效改善压力超负荷所致小鼠心肌肥厚和纤维化,对心肌肥厚小鼠心室重构有明显的改善作用。
心肌肥厚时心肌局部有大量的炎症介质活化,如NF-κB、TNF-α、IL-1β 等[7]。炎症因子主要通过激活炎症信号通路下游NF-κB参与心肌肥厚反应[8]。核因子NF-κB是炎症启动、调节的关键核因子,NF-κB可刺激TNF-α和IL-1β等细胞因子的表达[9]。NF-κB激活后可促进心脏形成心肌肥厚,抑制 NF-κB 的过度激活可有效抑制心肌肥厚及氧化应激对心肌的损伤[10]。NF-κB炎症信号通路激活,其受控的TNF-α、IL-1β也出现逐渐升高的表达趋势。TNF-α可以诱导心肌肥厚。与TNF-α相似,IL-1β的表达也随着心肌肥厚的发展而增加,其表达量与左心室的肥厚程度呈正相关[11]。TAC组的心肌中NF-κB的蛋白含量表达升高,血清 TNF-α和IL-1β含量升高,说明压力后负荷导致的心肌肥厚使炎症反应扩大,阿托伐他汀组、缬沙坦组NF-κB的蛋白含量表达降低,TNF-α、IL-1β水平下降,说明阿托伐他汀通过抑制NF-κB的活化而下调TNF-α、IL-1β炎症细胞因子的表达,发挥抗炎和抑制心肌肥厚的作用,改善心室重构和功能。2002年美国公布的氯沙坦高血压终点减少干预(LIFE)研究在新型与传统抗高血压药物的疗效对比方面, 首次显示血管紧张素Ⅱ受体拮抗剂氯沙坦优于β受体阻滞剂阿替洛尔[12]。结果进一步证实血管紧张素受体阻滞剂可逆转左心室肥厚。
综上,阿托伐他汀能通过抑制NF-κB的活化而下调TNF-α、IL-1β等炎性细胞因子的含量,降低心肌组织中的炎症反应,抑制心室壁增厚、减少心肌细胞肥大和胶原产生,改善心腔扩大、心室肥厚,最终改善左心室重构,抑制心肌肥厚的发展,这一作用可能是阿托伐他汀抑制心肌肥厚,改善心功能的机制之一,这为临床防治心肌肥厚提供新的思路。作为阳性对照组的缬沙坦,在本实验中再次重现了改善左心室重构的药理作用,说明了本实验中模型的建立是成功的。
[1] 宋晓东, 辛颖, 刘哲, 等. 欣力胶囊对心力衰竭大鼠心肌重塑及心功能的影响. 中国循环杂志, 2006, 21: 469-472.
[2] Gardin JM, Lauer MS. Left ventricular hypertrophy: the next treatable,silent killer. J Am Med Assoc, 2004, 292: 2396.
[3] Chandrasekar B, Mummidi S, Claycomb W C, et al. Interleukin-18 is a pro-hypertrophic cytokine that acts through a phosphatidylinositol 3-kinase-phosphoinositide-dependent kinase-1-Akt-GATA4 signaling pathway in cardiomyocytes. J Bio Chem, 2005, 280: 4553-4567.
[4] Rohini A, Agrawal N, Koyani CN, et al. Molecular targets and regulators of cardiac hypertrophy. Pharmac Res, 2010, 61: 269-280.
[5] Creemers EE, Wilde A, Pinto YM. Heart failure: advances through genomics. Nature Reviews Genetics, 2011, 12: 357-362
[6] Rockman HA, Ross RS, Harris AN, et al. Segregation of atrial-specific and inducible expression of an atrial natriuretic factor transgene in an in vivo murine model of cardiac hypertrophy. Proc Natl Acad Sci U S A, 1991, 88: 8277-8281.
[7] Rohini A, Agrawal N, Koyani CN, et al. Molecular targets and regulators of cardiac hypertrophy. Pharmacol Res, 2010, 61: 269-280.
[8] Serra AJ,Santos MH,Bocalini DS,et al. Exercise training inhibits in-flammatory cytokines and more than prevents myocardial dysfunction in rats with sustained beta-adrenergic hyperactivity. J Physio, 2010, 588: 2431~2442.
[9] Baker RG, Hayden MS, Ghosh S. NF-κB, inflammation, and metabolic disease. Cell metabolism, 2011, 13: 11-22.
[10] Álvarez-Guardia D, Palomer X, Coll T, et al. The p65 subunit of NF-κB binds to PGC-1α, linking inflammation and metabolic disturbances in cardiac cells. Cardiovasc Res, 2010, 87: 449-458.
[11] Shioi T, Matsumori A, Kihara Y, et al. Increased expression of interleukin-1β and monocyte chemotactic and activating factor/ monocyte chemoattractant protein-1 in the hypertrophied and failing heart with pressure overload. Cir Res, 1997, 81: 664-671.
[12] Dahlöf B, Devereux RB, Kjeldsen SE, et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. The Lancet, 2002, 359: 995-1003.
Protective Roll of Atorvastatin on Cardiac Remodeling Induced by Pressure Overload in Experimental Mice With its Mechanism
ZHAO Di, WANG Wei, ZHANG Xiao-juan, GUO Wei-xing, ZHAO Tian, JIANG Hong-ju, ZHAO Zhuo.
First Clinical College, Shandong University of Chinese Medicine, Jinan (250014), Shandong, China
Objective: To observe the protective roll of atorvastatin on post-operative cardiac remodeling induced by transverse aortic constriction (TAC) in experimental mice with its possible mechanism.
Atorvastatin; Pressure overload; Transverse aortic constriction; Myocardial hypertrophy; infammatory factor
2015-03-12)
(编辑:许 菁)
国家自然基金面上项目(81270715);山东省优秀中青年科学家科研奖励基金(BS2010YY005)
250355 山东省济南市,山东中医药大学(赵地、赵添);山东省胸科医院 心血管中心(王维、张小娟);山东省医学科学院院长办公室(郭伟星);山东省中西医结合医院 心内科(姜红菊);山东大学附属济南中心医院 心内科(赵卓)
赵地 博士研究生 主要从事心血管疾病的临床研究 Email: gangqinshi1988@163.com 通讯作者:赵卓 Email:zhaozhauo1230@163.com
R54
A
1000-3614(2015)11-1090-06
10.3969/j.issn.1000-3614.2015.11.014
