维生素K2对大鼠主动脉钙化的作用研究
2015-12-08姜晓宇张东海吕安林李寰邱翠婷马晓磊郭显李珊
姜晓宇,张东海,吕安林,李寰,邱翠婷,马晓磊,郭显,李珊
维生素K2对大鼠主动脉钙化的作用研究
姜晓宇,张东海,吕安林,李寰,邱翠婷,马晓磊,郭显,李珊
目的:探讨维生素K2对大鼠血管钙化形成及氧化应激损伤的作用。
方法:24只大鼠随机分为4组:对照组、6周钙化组、12周钙化组和6周钙化+6周维生素K2组。采用华法林诱导大鼠体内血管钙化形成。分别通过茜素红S染色法和邻甲酚肽络合酮比色法检测4组大鼠主动脉组织钙结节形成情况及钙沉积含量;活性氧检测试剂盒(二氢乙啶)检测大鼠主动脉组织活性氧阳性细胞数;透射电子显微镜检测大鼠血管平滑肌细胞线粒体形态变化。
结果:6周及12周两个钙化组大鼠主动脉有钙结节形成,钙沉积含量及活性氧水平均显著高于对照组(P均<0.01);6周钙化+6周维生素K2组大鼠与两个钙化组相比,上述各指标均显著降低,差异均有统计学意义(P均<0.01)。两个钙化组大鼠血管平滑肌细胞线粒体肿胀,结构模糊不清,胞质内空泡变性;6周钙化+6周维生素K2组大鼠血管平滑肌细胞体积与对照组比较无明显变化,胞质内未见空泡变性。
结论:华法林诱导血管钙化形成与氧化应激损伤有关,氧化应激损伤可造成细胞超微结构损伤。维生素K2可能通过减轻血管平滑肌细胞氧化应激损伤,改善血管钙化。
动脉钙化;氧化应激;活性氧;线粒体
Methods: A total of 24 rats were divided into 4 groups: ①Control group, ②6-week calcifcation group, ③12-week calcifcation group and ④6-week calcifcation + 6-week VK2group; n=6 in each group. The arterial calcifcation was induced by warfarin (WFN) treatment. The calcium nodule and deposition in rat’s theaortic artery were detected by Alizarin red staining and o-cresolphthalein complexone method, the reactive oxygen species (ROS) were measured by DHE probe staining and the morphological changes of mitochondria in smooth muscle cells were detected by transmission electron microscopy.
Results: Calcifcation nodule formed in both 6-week and 12-week calcifcation groups, the calcifcation deposition and ROS were higher than Control group, P<0.01. Compared with both calcification groups, the above indexes were decreased in 6-week calcifcation + 6-week VK2group, P<0.01. Both calcifcation groups showed mitochondria swelling with unclear structure and cytoplasm vacuoles degeneration in vascular smooth muscle cells. The vascular smooth muscle cell volumes were similar between Control group and 6-week calcification + 6-week VK2group, and no cytoplasm vacuoles degeneration was observed.
Conclusion: Warfarin induced aortic calcifcation is related to oxidative stress injury which may cause the ultra-
micro structural damage in smooth muscle cells; VK2may reduce the oxidative stress injury and improve the condition of vessel calcifcation in experimental rats.
(Chinese Circulation Journal, 2015,30:1101.)
动脉钙化是2型糖尿病、慢性肾脏病和慢性炎症性疾病患者中普遍存在的血管病变。回顾性分析发现[1],70岁以上健康绝经后女性中90%以上存在动脉钙化。在Framingham研究中[2],平均年龄为6l岁的男性和女性受试者中动脉钙化发生率分别为68%和57%。慢性肾脏病患者中动脉钙化患病率比健康人群高45倍[3]。因此,动脉钙化的预防和治疗对于原发病的进展和预后具有重要临床意义。动脉钙化形成的确切机制尚不清楚。有研究发现,活性氧簇(ROS)的产生能够通过促进细胞核表达的成骨转录因子Runx2升高,α-平滑肌肌动蛋白表达量降低,血管平滑肌细胞(VSMC)由收缩表型向具有分泌功能的成骨样细胞表型转化,促发钙化形成[4]。因此,动脉钙化与氧化应激密切相关[5,6]。而华法林干预大鼠后,研究证实能成功诱导大鼠动脉钙化模型的建立[7]。故本研究通过华法林诱导建立大鼠体内血管钙化模型,在此基础上观察维生素K2治疗对大鼠体内血管钙化形成、活性氧表达、线粒体形态变化的影响,探讨维生素K2对大鼠血管钙化形成及氧化应激损伤的作用。
1 材料与方法
动物与试剂:2013-11至2014-11选取清洁级10周龄Sprague-DaWley雄性大鼠24只,重约120~150 g(军队实验动物使用许可证SYXK军2010-046,购自第四军医大学动物实验中心)。实验大鼠在普通鼠笼单只饲养(第四军医大学口腔实验动物中心,SPF级别),实验协议经第四军医大学实验动物伦理委员会批准。华法林和维生素K2分别溶解在玉米油中,均匀拌入饲料中,饲料经钴60照射消毒。茜素红S 产自美国Sigma公司;活性氧检测试剂盒(S0033)购自中国碧云天生物公司;钙沉积含量邻甲酚肽络合酮比色试剂盒购自北京中生北控生物公司。
实验动物分组[7]:24只大鼠随机分为对照组、6周钙化组、12周钙化组和6周钙化+ 6周维生素K2组,每组6只。对照组投喂正常饲料;两个钙化组投喂含华法林(3 mg/g)的饲料;6周钙化+ 6周维生素K2组在投喂6周含华法林饲料的基础上给予含维生素K2(100 µg/g)饲料喂养6周。
大鼠主动脉组织钙化形成情况检测: (1)茜素红S染色:取石蜡切片脱蜡后,磷酸盐缓冲液清洗3次,晾干后,在组织面滴加1 g/L的茜素红S(pH 6.3),室温下5~10 min,用蒸馏水冲洗3次,淡绿染色20~30 s,蒸馏水浸洗3次,中性树胶封片,显微镜下观察钙结节被染成深红色[8]。(2)主动脉组织钙沉积含量检测:取双侧颈总动脉晾干后称重,剪碎置于1.5 ml EP管中,加入超过10倍(wt /体积)10%甲酸,4℃过夜,钙沉积含量检测前,1006.2 g离心10 min,取上清液用于各组主动脉组织钙沉积含量检测[7]。
华法林成功诱导大鼠血管钙化模型的鉴定标准[7]:茜素红S染色法检测钙化形成,钙化组大鼠钙结节形成。同时邻甲酚肽络合酮比色法进行钙沉积含量定量检测,钙化组大鼠主动脉组织钙沉积含量较对照组显著升高,且差异有统计学意义。
大鼠主动脉组织ROS检测:取大鼠腹主动脉,迅速制备冰冻切片。加入适当体积稀释好的无血清培养基与ROS荧光探针——二氢乙啶(DHE)探针,37℃孵箱中孵育20 min,无血清培养基洗涤3次。激光共聚焦显微镜下观察并拍照[6]。
大鼠VSMC线粒体形态学检测:取腹主动脉,剥去外膜及结缔组织后,纵剖血管成片状,平铺切成约2 mm3大小的组织块,2.5%戊二醛4℃固定24 h,脱水后纯树脂浸透2 h包埋,30℃聚合炉中聚合1 d,甲苯胺蓝染色,光镜定位,用钻石刀切片,附到铜网上,醋酸双氧铀染色,避光25~30 min,用蒸馏水冲洗3次,柠檬酸铅染色,6~7 min,蒸馏水冲洗3次。透射电子显微镜观察线粒体形态改变并拍照[9]。
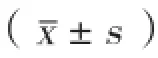
2 结果
4组大鼠主动脉组织钙化形态学、钙沉积含量及ROS检测(图1、图2):6周钙化组和12周钙化组大鼠主动脉有钙结节形成,钙沉积含量分别为(9.38±0.867)µg/g和(14.41±0.506)µg/g,与对照组[(0.24±0.071)µg/g]相比显著升高,差异有统计学意义(P均<0.01)。6周钙化+6周维生素K2组大鼠主动脉也有钙结节形成,钙沉积含量为(5.75±0.465)µg/g,较两个钙化组显著降低, 差异有统计学意义(P均<0.01)。
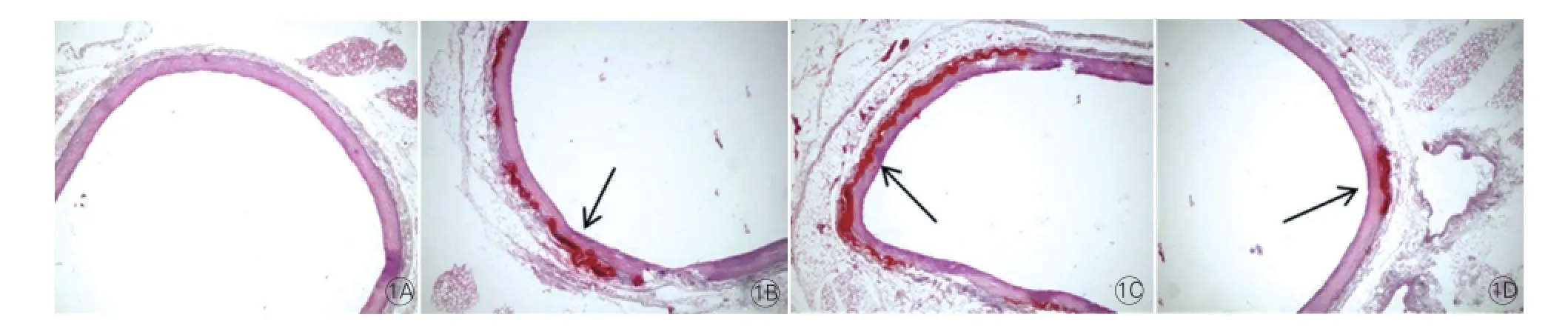
图1 普通光学显微镜观察茜素红S染色法检测4组大鼠主动脉组织钙结节形成情况(n=6)
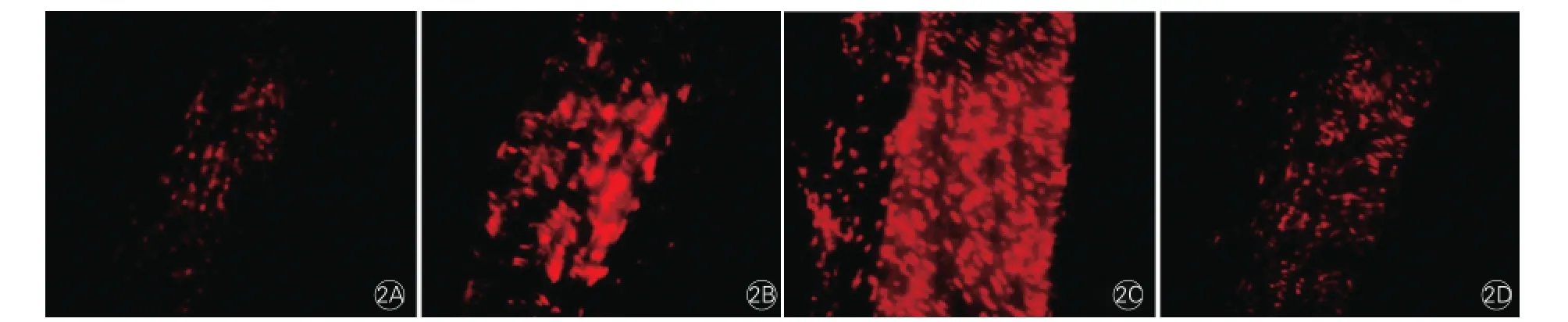
图2 激光共聚焦显微镜观察4组大鼠主动脉组织中活性氧表达情况(n=6)
图3 透射电子显微镜观察4组大鼠主动脉组织中线粒体形态改变(n=6)
6周钙化组和12周钙化组大鼠主动脉组织中ROS阳性组织水平[分别为(15.7±1.59)和(28.6±2.16)]均较对照组(4.5±0.64)显著升高,差异具有统计学意义(P均<0.01)。6周钙化+ 6周维生素K2组大鼠主动脉组织中ROS阳性组织水平(11.7±1.97)较两个钙化组显著降低,差异有统计学意义 (P均<0.01)。
4组大鼠VSMC线粒体形态学检测 (图3):对照组大鼠VSMC呈圆形或椭圆形,细胞膜及核轮廓清晰,胞质内细胞浆丰富,胞浆内有丰富的线粒体,包膜完整,嵴清晰可见,核大,核型不整,染色质均匀分布,可见核仁。与对照组比较,6周钙化组及12周钙化组大鼠VSMC细胞皱缩变小,部分细胞器发生崩解,释放凋亡小体,线粒体肿胀变大,结构变得模糊不清,胞质内出现空泡变性。与对照组比较,6周钙化+6周维生素K2组大鼠VSMC体积无明显变化,细胞器减少,可见线粒体肿胀,核略增大,核染色质分布欠均匀,可见核仁,有少量凋亡细胞。
3 讨论
导致动脉钙化发病率升高的因素较多,包括高胆固醇血症、高血压、2型糖尿病、终末期肾病床旁透析等,这些因素均与氧化应激相关[10,11]。大量研究证实,血管钙化灶附近ROS表达升高[3,11-14]。而Westhofen等[15]研究发现,维生素K通过维生素K环氧化物还原酶复合体-1(VKORC1L1)介导细胞内抗氧化作用,HEK293T细胞过表达VKORC1L1基因且经氧化剂2,4-二甲氧基-1,4-奈醌干预后,与对照组相比ROS水平降低。本研究通过动脉钙化形态学及钙沉积含量检测,观察华法林诱导大鼠体内血管钙化形成情况。华法林干预后两个钙化组大鼠主动脉组织中有钙结节形成,钙沉积含量较对照组显著升高,成功建立大鼠体内血管钙化模型[16];维生素K2干预后钙结节形成及钙沉积含量较两个钙化组均显著降低。为进一步观察钙化形成后氧化应激损伤水平,我们检测了4组大鼠主动脉组织ROS水平。结果显示:两个钙化组大鼠主动脉组织ROS阳性水平较对照组均增加(P<0.01),且随着钙化时间延长,ROS阳性水平进一步升高。6周钙化形成基础上给予维生素K2干预后的大鼠主动脉ROS阳性水平显著降低,同时主动脉钙化形态学和钙沉积含量与两个钙化组比较均显著减少。本研究结果与Wei等[17]研究报道一致,明确了在动脉钙化发生、发展过程中存在氧化应激损伤。
众所周知,氧化应激可引起抗凋亡蛋白B细胞淋巴瘤/白血病-2的表达下调。而生物体内线粒体损伤后,线粒体膜电位破坏,继而出现ROS生成增多、钙超载及凋亡等现象。维生素K2干预是否提高线粒体膜电位,从而降低ROS水平、钙超载及凋亡表达,目前尚未见相关报道。本研究通过透射电镜观察到,两个钙化组大鼠VSMC线粒体肿胀变大,结构变得模糊不清,胞质内出现空泡变性。而经维生素K2治疗后线粒体虽肿胀,但胞质内未见空泡变性。这进一步明确了动脉钙化发生、发展过程中存在氧化应激损伤。钙化组大鼠VSMC超微结构线粒体肿胀、部分溶解,进而造成细胞凋亡。炎症或机械损伤可导致VSMC凋亡,释放基质囊泡和凋亡小体,凋亡小体成为钙化晶核,促发钙沉积[18]。氧化应激损伤是否通过凋亡途径促进 VSMC 钙化形成还有待进一步深入研究。
本研究观察到,大鼠主动脉组织钙化形成与氧化应激损伤有关,氧化应激损伤可造成细胞超微结构改变,如线粒体肿胀和溶解。而维生素K2干预后钙化组大鼠VSMC氧化应激损伤减轻,线粒体肿胀和溶解改善。本课题组细胞学实验进一步证实,ROS作为第二信使激活VSMC中成骨转录因子Runx2的表达,由具有收缩表型的VSMC向成骨样细胞转变并促使钙化形成[19]。因此,氧化应激损伤可能是动脉钙化的重要发病机制之一,维生素K2为动脉钙化的治疗提供了新的方向。
[1] Schulz E, Arfai K, Liu X, et al. Aortic calcification and the risk of osteoporosis and fractures. J Clin Endocrinol Metab, 2004, 89: 4246-4253.
[2] Wilson PW, Kauppila LI, O'Donnell CJ, et al. Abdominal aortic calcific deposits are an important predictor of vascular morbidity and mortality. Circulation, 2001, 103: 1529-1534.
[3] Chowdhury UK, Airan B, Mishra PK, et al. Histopathology and morphometry of radial artery conduits: basic study and clinical application. Ann Thorac Surg, 2004, 78: 1614-1621.
[4] Liberman M, Bassi E, Martinatti MK, et al. Oxidant generation predominates around calcifying foci and enhances progression of aortic valve calcification. Arterioscler Thromb Vasc Biol, 2008, 28: 463-470.
[5] Roman-Garcia P, Barrio-Vazquez S, Fernandez-Martin JL, et al. Natural antioxidants and vascular calcification: a possible benefit. J Nephrol, 2011, 24: 669-672.
[6] Sage AP, Tintut Y, Demer LL. Regulatory mechanisms in vascular calcification. Nat Rev Cardiol, 2010, 7: 528-536.
[7] Schurgers LJ, Spronk HM, Soute BA, et al. Regression of warfarininduced medial elastocalcinosis by high intake of vitamin K in rats. Blood, 2007, 109: 2823-2831.
[8] Lau WL, Leaf EM, Hu MC, et al. Vitamin D receptor agonists increase klotho and osteopontin while decreasing aortic calcification in mice with chronic kidney disease fed a high phosphate diet. Kidney Int, 2012, 82: 1261-1270.
[9] 王英, 王梅. 高磷诱导大鼠血管平滑肌细胞钙化及其电镜表现. 首都医科大学学报, 2009, 30: 521-524.
[10] Basta G, Schmidt AM, De Caterina R. Advanced glycation end products and vascular inflammation: implications for accelerated atherosclerosis in diabetes. Cardiovasc Res, 2004, 63: 582-592.
[11] Maziere C, Salle V, Gomila C, et al. Oxidized low density lipoprotein increases RANKL level in human vascular cells. Involvement of oxidative stress. Biochem Biophys Res Commun, 2013, 440: 295-299. [12] Miller JD, Chu Y, Brooks RM, et al. Dysregulation of antioxidant mechanisms contributes to increased oxidative stress in calcific aortic valvular stenosis in humans. J Am Coll Cardiol, 2008, 52: 843-850.
[13] Boraldi F, Garcia-Fernandez M, Paolinelli-Devincenzi C, et al. Ectopic calcification in beta-thalassemia patients is associated with increased oxidative stress and lower MGP carboxylation. Biochim Biophys Acta, 2013, 1832: 2077-2084.
[14] Brodeur MR, Bouvet C, Barrette M, et al. Palmitic acid increases medial calcification by inducing oxidative stress. J Vasc Res, 2013, 50: 430-441.
[15] Westhofen P, Watzka M, Marinova M, et al. Human vitamin K 2,3-epoxide reductase complex subunit 1-like 1 (VKORC1L1) mediates vitamin K-dependent intracellular antioxidant function. J Biol Chem, 2011, 286: 15085-15094.
[16] Li H, Tao HR, Hu T, et al. Atorvastatin reduces calcification in rat arteries and vascular smooth muscle cells. Basic Clin Pharmacol Toxicol, 2010, 107: 798-802.
[17] Wei Q, Ren X, Jiang Y, et al. Advanced glycation end products accelerate rat vascular calcification through RAGE/oxidative stress. BMC Cardiovasc Disord, 2013, 13: 13.
[18] Proudfoot D, Skepper JN, Hegyi L, et al. Apoptosis regulates human vascular calcification in vitro: evidence for initiation of vascular calcification by apoptotic bodies. Circ Res, 2000, 87: 1055-1062.
[19] 邱翠婷, 吕安林, 李寰, 等. 钙磷诱导大鼠血管平滑肌细胞钙化的机制研究. 中国循环杂志, 2015, 1: 64-67.
Effect of Vitamin K2on Theaortic Artery Calcification in Experimental Rats
JIANG Xiao-yu, ZHANG Dong-hai, LV An-lin, LI Huan, QIU Cui-ting, MA Xiao-lei, GUO Xian, LI Shan.
Department of Cardiology, Xijing Hospital, Fourth Military Medical University, Xi’an (710032) Shaanxi, China
Co-corresponding Authors: LV An-lin, Email: lvanlin@fmmu.edu.cn and LI Huan, Email: lihuan816@yahoo.com
Objective: To explore the effects of Vitamin K2(VK2) on theaortic artery calcifcation and oxidative stress injury in experimental rats.
Arterial Calcifcation; Oxidative stress; Reactive oxygen species; Mitochondria
2015-06-12)
(编辑:朱柳媛)
国家自然科学基金(81170256);陕西省科技计划项目(2009K13-01)
710032 陕西省西安市,中国人民解放军第四军医大学第一附属医院 心内科(姜晓宇、吕安林、李寰、邱翠婷、马晓磊、郭显、李珊);陕西铜川市人民医院 心内科(张东海)
姜晓宇 硕士研究生 主要从事动脉钙化及机制研究 Email: muyuanj99@163.com 通讯作者:吕安林 Email: lvanlin@fmmu.edu.cn;
李寰 Emal: lihuan816@yahoo.com
R54
A
1000-3614(2015)11-1101-05
10.3969/j.issn.1000-3614.2015.11.016
