高教版《基础有机化学》中两个还原反应机理的修正与补充*
2015-12-07柏铭孟凡君赖鹏翔
柏铭 孟凡君 赖鹏翔
(山东大学(威海)海洋学院 山东威海 264209)

高教版《基础有机化学》中两个还原反应机理的修正与补充*
柏铭**孟凡君 赖鹏翔
(山东大学(威海)海洋学院 山东威海 264209)
在教学过程中发现高等教育出版社出版的《基础有机化学》一书中有两个经自由基负离子的还原反应(即炔烃用碱金属和液氨还原反应和Birch(伯奇)还原反应)机理有不妥和需要完善之处,对此进行了修正与补充。
有机化学 自由基负离子 反应机理 修正
高等教育出版社出版的由北京大学邢其毅、裴伟伟、徐瑞秋、裴坚等编写的《基础有机化学》,前后经历3版,是国内有机化学教科书中非常优秀的一套教材[1]。该书结构合理,教材内容选择和安排与教学科研发展方向一致,得到了任课教师和学生的普遍认可。但该书中还是存在着或多或少的问题。我们在教学过程中发现,炔烃用碱金属和液氨还原和Birch(伯奇)还原这两个都经过自由基负离子中间体的反应的反应机理在描述过程中有不妥和需要补充之处。
1 炔烃用碱金属和液氨还原反应[1]
炔烃用碱金属和液氨还原反应是炔烃的重要还原反应。该反应主要生成E型烯烃衍生物,因此是各类考试中经常出现的考点,尤其是在合成题中,该反应是选择性地制备反式烯烃的主要方法之一。例见图1。
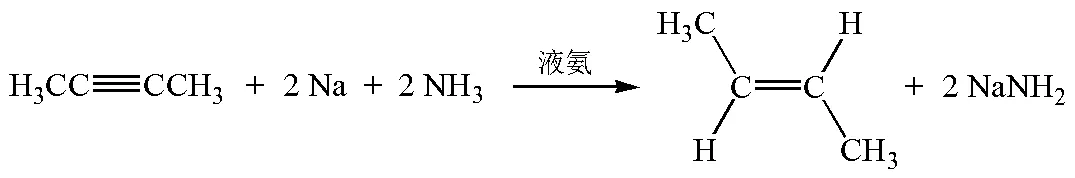
图1 2-丁炔烃用钠和液氨还原
书中给出了该反应的反应过程(图2):首先金属钠与液氨在无Fe3+存在下形成Na+与e-(NH3)蓝色溶液,然后在此溶液中加入炔烃(i),i得到电子形成E型的自由基负离子(ii),ii从NH3处得到质子生成自由基(iii),iii再从溶液中得到一个电子形成负离子(iv),iv又从NH3得到一个质子,生成E型烯烃(v)。

图2 炔烃用碱金属和液氨还原的反应过程
该反应是一个有着很好立体选择性的反应。既然强调了这个反应的立体选择性,根据书中描述的反应机理,我们就会认为:反应在炔得到第一个电子形成自由基负离子时就已经确定了它的反式构型。
通过进一步的研究,我们发现,通过ESR(电子自旋共振谱)的测量,乙烯自由基有两个sp2杂化的弯曲结构[2-3],这两种弯曲结构可以迅速翻转,300K翻转速度达到4×1010次/秒,主要原因是两种结构的转换能垒很低,只有12.5kJ/mol[2]。sp型直线型结构尽管不是真实的转换中间体,但可以是这两种结构的过渡结构(图3)。

图3 乙烯自由基两种sp2构型转换
烯负离子(iv)的结构就稳定很多,一对电子占据一个空轨道。对于烯烃来说,反式结构稳定,因此在该反应的反应机理中,决定分子最后构型的应该是第二次得到电子形成烯负离子时,而不是第一次得到电子形成烯自由基负离子时。
因此,反应机理应该修正为,第一步,炔得到一个电子形成烯自由基负离子,这时并没有构型差异;进一步得到NH3中的一个H后,形成烯自由基,这时也没有构型差异;当得到第二个电子形成烯负离子时,化合物选择了一个大基团在烯烃两边的稳定的反式构型,最后从NH3中得到一个H后形成反式烯烃(图4)[4]。

图4 炔烃用碱金属和液氨还原的反应机理
2 Birch(伯奇)还原
伯奇还原是芳香化合物的一个重要知识点,在第11章(芳香烃的还原)中[1]以及第19章(芳香醚的还原)中[1]都有介绍。其具体描述为“碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或二级丁醇)的混合液中,与芳香化合物反应,苯环可被还原成1,4-环己二烯类化合物,这种反应叫做Birch(伯奇)还原” (图 5)。
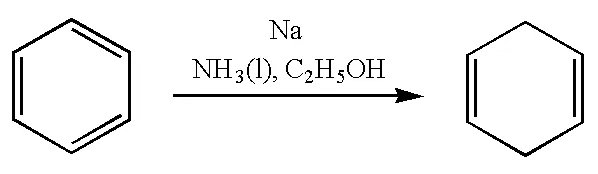
图5 苯被还原成1,4-环己二烯
书中给出了反应机理(图6)。反应首先也是钠与液氨作用形成溶剂化电子(蓝色溶液)。然后,苯环得到一个电子生成(Ⅰ),Ⅰ仍是环状共轭体系,但有一个单电子处在反键轨道上,Ⅰ从乙醇中夺取一个质子生成(Ⅱ)。Ⅱ再取得一个电子转变成(Ⅲ),Ⅲ是一个强碱,可以再从乙醇中夺取一个质子形成1,4-环己二烯。这里首先形成的也是一个自由基负离子(Ⅰ)。
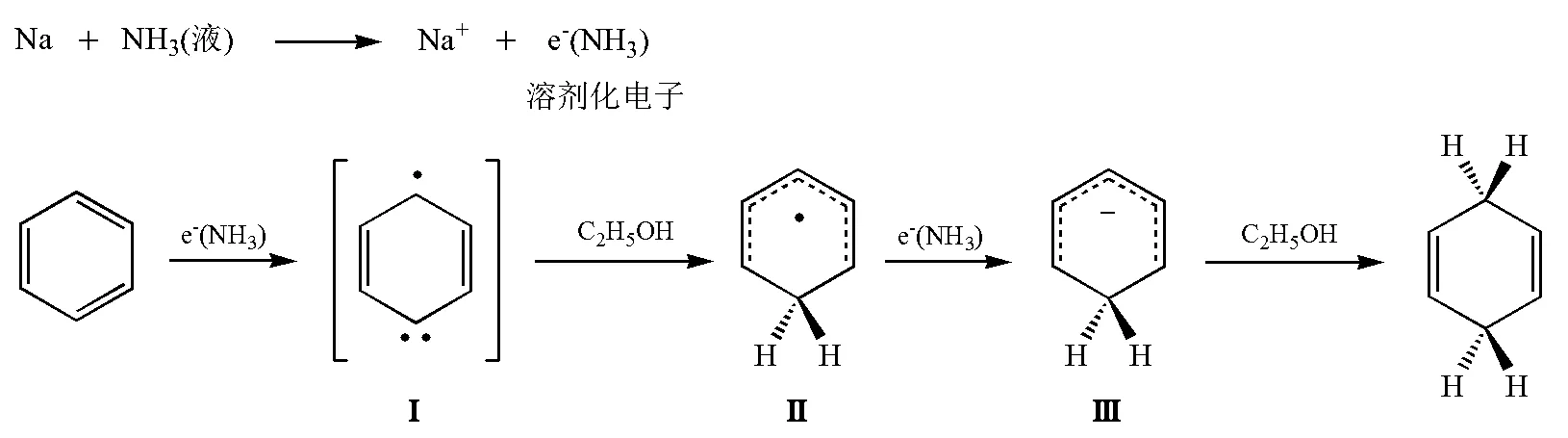
图6 苯被还原成1,4-环己二烯的反应机理
在该书第19章(芳香醚的还原)也给出了芳香醚发生Birch还原的反应机理(图7)。并且进一步指出:“苯环上有可以被还原的卤素、硝基、醛或酮等官能团不能进行Birch还原;烷基苯、芳香羧酸、酰胺、酯、苯胺及其衍生物可以进行Birch还原”。

图7 苯甲醚被还原成1-甲氧基-1,4-环己二烯的反应机理
需要指出的是,在书中用红字标出了该反应中最重要的知识点“给电子基团一般使还原速率减慢;吸电子基团使反应速率加快,而且所得产物取代基团位于被还原的碳原子上”,即还原位置的选择性(图8)。尽管这个知识点非常重要,但是在书中对这部分却没有解释,并且自由基负离子的形成在书中也没有说明,学生经常会对该部分内容提出疑问。
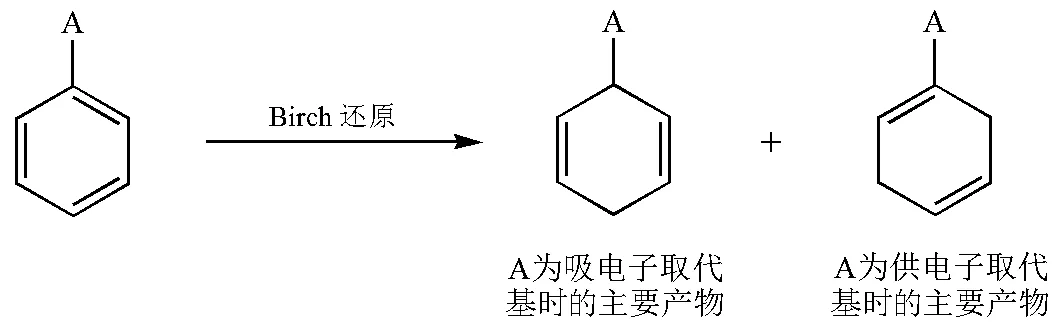
图8 官能团电效应对Birch(伯奇)还原的影响
在教学中,我们对该部分知识点的内容和反应机理进行了补充(图9)。
通过研究吸电子和供电子官能团不同的还原机理,我们发现最终产物的双键位置是在苯环得到第一个电子形成自由基负离子时就已经确定了,因此电子进攻的位置与自由基负离子的稳定性决定了产物的结构。供电子基团使苯环电子云密度升高,接受电子困难,在供电子官能团的邻、对、间3个位置中,间位的电子云密度最低,最容易接受电子,形成负电荷在邻位的自由基负离子;当取代基为吸电子基团时,苯环电子云密度低,更容易接受电子,反应速率快,尤其是在吸电子官能团连接的位置,电子云密度最低,得到一个电子后形成的自由基负离子的负电荷刚好处在离吸电子基团最近的位置,产物稳定。

图9 Birch(伯奇)还原的反应机理
3 总结
本文对高教出版社出版的《基础有机化学》[1]中涉及自由基负离子中间体的两个还原反应(炔烃用碱金属和液氨还原反应和Birch(伯奇)还原反应)的机理进行了修正及补充。
[1] 邢其毅,裴伟伟,徐瑞秋,等.基础有机化学.第3版.北京:高等教育出版社,2005
[2] Fessenden R W,Schuler R H.JChemPhys,1963,39(9):2147
[3] Cochran E L,Adrian F J,Bowers V A.JChemPhys,1964,40(1):213
[4] John M.Organic Chemisty.7th ed.Belmont:Thomson Higher Eductaion,2008
TheAmendmentofTwoMechanismsofReductionReactionsinFundamentalOrganicChemistry(HigherEducationPress)*
Bai Ming* *Meng Fanjun Lai Pengxiang (MarineCollege,ShandongUniversity
(Weihai),Weihai264209,Shandong,China)
Organic chemistry is the core course of chemistry, biology and medicine, and other disciplines. The textbookFundamentalOrganicChemistry(Higher Education Press) is adopted by many universities. We proposed amendment for two mechanisms in this book involving the radical anion intermediate, the alkynes reduction with alkali metal in liquid ammonia and the Birch reduction.
Organic chemistry; Radical anion; Mechanism; Amendment
10.3866/pku.DXHX20150454
山东大学(威海)教学研究与教学改革立项项目(B201309)
**通讯联系人,E-mail:ming_bai@sdu.edu.cn
O6;G64
