碰撞池-多接收电感耦合等离子体质谱分析硅同位素的方法研究
2015-12-07任同祥周原晶
任同祥,周 涛,逯 海,周原晶,王 军
(中国计量科学研究院,化学计量与分析科学研究所,北京 100013)
碰撞池-多接收电感耦合等离子体质谱分析硅同位素的方法研究
任同祥,周 涛,逯 海,周原晶,王 军
(中国计量科学研究院,化学计量与分析科学研究所,北京 100013)
通过更换仪器进样系统、改变溶液基体、调节碰撞气的种类和流量以及调节质量分辨率等参数,建立了碰撞池-多接收电感耦合等离子体质谱(Collision Cell-MC-ICP-MS)测定硅同位素丰度组成的分析方法。实验结果表明:使用PFA雾化器、Pt锥和蓝宝石材质的矩管可有效降低仪器本底;调节狭缝宽度、中心杯位置等可提高仪器的质量分辨率,实现硅同位素离子与同量异位素干扰离子在一定程度上的分离;选择氖气(Ne)和氩气(Ar)的混合气作为碰撞气、降低溶液中四甲基氢氧化铵(TMAH)浓度等能有效降低多原子离子的干扰。在此基础上,分析了样品WASO 04和GBW(E)080272中硅同位素的丰度组成,同位素丰度比R30/28的测量精度达到0.02%。将样品WASO 04作为参考标准时,样品GBW(E)080272中的硅同位素分馏系数δ30Si为-1.57‰。
多接收电感耦合等离子体质谱(MC-ICP-MS);碰撞池;硅;同位素丰度比
硅(Si)是地壳和土壤中含量仅次于氧的大量元素。在地壳中,硅主要以硅酸盐和氧化物的形式存在;而在水圈和生物圈中,硅主要以硅酸和二氧化硅的形式存在。研究表明,从单细胞的藻类到维管植物,几乎所有的生命体中都有含硅组织的存在。开展硅同位素分析的应用研究是揭示地球内部构成的重要途径之一[1],近年来也逐渐成为生物地球化学[2-4]、环境变化[58]等研究领域的新手段。
自然界中,硅元素有3个稳定的同位素:28Si、29Si和30Si,对应的同位素丰度分别为92.22%、4.69%和3.09%[9]。传统的硅同位素分析主要依赖于气体同位素质谱(IR-MS)技术,即将硅单质或者二氧化硅转化为四氟化硅(SiF4)气体后引入质谱仪,来实现对其同位素丰度比的测量,该方法的测量精度可以达到0.01%,基本满足硅同位素分析的要求[10-11]。但是,该方法在样品制备过程中需要用到BrF5等有毒气体,而且样品处理过程相对繁琐。近些年,随着多接收电感耦合等离子体质谱仪(MC-ICP-MS)性能的不断提高,该技术也逐渐被应用在硅元素的同位素分析中[12-13],而且样品制备过程也相对简单[14-15]。通常采用硝酸与氢氟酸的混合酸溶解实际样品,使硅形成SiF62-离子;或者采用氢氧化钠等碱性溶剂溶解样品,使硅形成硅酸根离子;实现了将硅样品以溶液的形式引入质谱仪,从而避免了BrF5等有毒气体的使用。但是,该技术面临的最大问题是碳、氮、氧等引起的同量异位素干扰,特别是14N16O+对30Si+的干扰比较严重,通常情况下14N16O+的离子信号强度是30Si+的100倍以上,这为测定δ30Si带来了很大困难[14-17]。
本工作拟通过改变溶液基体浓度、更换进样系统、调节碰撞气种类和流量、调节质量分辨率等参数,研究碰撞池-多接收电感耦合等离子体质谱开展硅同位素分析方法的可行性,并利用天然丰度组成的硅溶液对所建立的测量方法进行考察,对比2个天然丰度组成样品WASO 04和GBW(E)080272中硅同位素的丰度组成情况。
1 实验部分
1.1 主要仪器与装置
Isoprobe碰撞池-多接收电感耦合等离子体质谱仪:英国GV Instrument公司产品;天平(最小分度0.1μg):美国Mettler-Toledo公司产品;PFA试剂瓶(容积100mL):日本亚速旺公司产品;Memmert烘箱:德国GmbH &Co.KG公司产品。
1.2 主要材料与试剂
去离子水(18MΩ·cm):由Milli-Q超纯水系统制备;25%四甲基氢氧化铵溶液(TMAH):美国Fluka公司产品;天然高纯硅(WASO04):由德国联邦物理技术研究院(PTB)提供;水中二氧化硅标准溶液(GBW(E)080272:100mg/L):中国计量科学研究院提供;30Si浓缩同位素试剂(主同位素丰度为94.40%):由美国橡树岭国家实验室提供。
天然高纯硅样品经表面清洗干燥后,用天平称重并转移至干净的PFA试剂瓶中,加入一定量25%TMAH溶液;然后置于60℃烘箱内加热3~4天,使固体样品溶解完全;最后,用去离子水稀释至待测浓度。
1.3 实验条件
1.3.1 质谱条件 以6mg/L硅溶液调节仪器参数,MC-ICP-MS测定硅同位素丰度比的质谱仪器参数列于表1。MC-ICP-MS测定硅同位素丰度比时,用3个法拉第杯分别接收硅的3个同位素:L2(28Si)、Ax(29Si)、H2(30Si)。测量过程中采用静态法收集离子流,每个测量结果由3组(block)数据合成,每个block包含10次测量(cycle),每个cycle的积分时间为10s。
1.3.2 实验方法 分别在一定范围内调节狭缝宽度、改变碰撞气种类和流量等实验参数,以尽可能降低同量异位素干扰、实现硅同位素离子与干扰离子的有效分离为目的,对比分析各实验参数对硅同位素离子的信号、峰型与干扰离子和干扰离子的信号、峰型的影响情况。在此基础上,建立硅的同位素分析方法,并测量配制的溶液中硅的同位素丰度比。

表1 MC-ICP-MS测定硅同位素丰度比的仪器参数Table 1 Measurement condition of silicon isotope ratios with MC-ICP-MS
2 结果与讨论
采用MC-ICP-MS技术测定硅同位素丰度比时面临的最大问题是同量异位素离子的干扰,可能对硅的各个同位素离子产生干扰的同量异位素离子列于表2。可以看出,主要的干扰来自于C、N、O等形成的双原子或多原子离子,Fe和Ni的二价离子也会对硅的同位素离子形成干扰,此外,由于天然硅样品中28Si的丰度达到92%以上,生成的28Si1H+离子也会对29Si+形成明显的干扰。为了减弱甚至消除这些潜在的干扰离子,本工作开展了几个方面的研究,并在此基础上建立了基于碰撞池技术的硅同位素分析方法。此外,为了尽可能降低仪器中的硅本底,将石英雾化器更换为PFA雾化器,将石英矩管更换为内管为蓝宝石材质的分体式矩管。
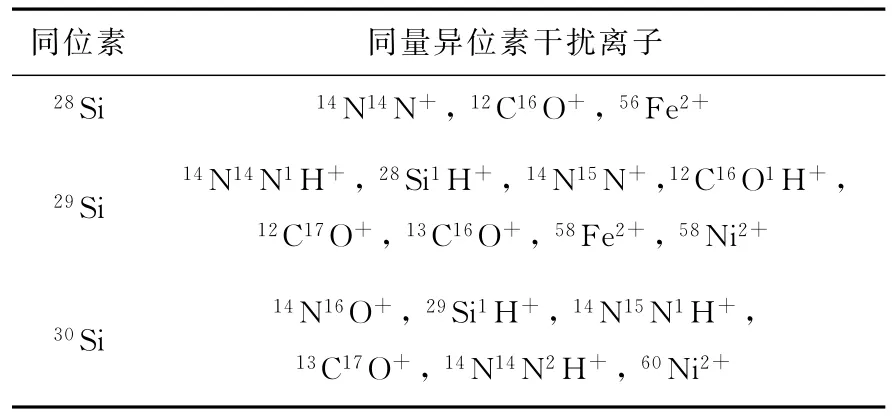
表2 硅元素各个同位素的同量异位素干扰离子Table 2 Possible isobaric interferences on silicon isotopes
2.1 Pt锥与Ni锥的对比
采用Ni锥和Pt锥时,Ni+信号强度对照图示于图1。通常情况下,采用Ni锥进样并截取离子流,这必然导致仪器本底中较高的Ni+离子信号强度,并可能生成较强的二价离子(58Ni2+和60Ni2+)。考虑到硅元素较低的电离效率和天然硅中29Si和30Si的同位素丰度较低,生成的二价离子对29Si+和30Si+的影响不可忽略。当将Ni锥更换为Pt锥后,Ni+离子的信号强度只有原来的十分之一,生成的Ni2+信号强度在0.1mV以下,与29Si+(0.37V)和30Si+(0.27V)信号强度相比,由其引起的同量异位素干扰已被降低到很低水平,可忽略不计。

图1 采用Ni锥和Pt锥时Ni+信号强度对照图Fig.1 Comparison of Ni+signal intensity using the Ni cones and Pt cones
2.2 质量分辨率调节
与Neptune多接收电感耦合等离子体质谱仪相比,Isoprobe多接收电感耦合等离子体质谱仪的质量分辨率更低,但是,该质谱仪可以通过调节2个物理狭缝的宽度来实现质量分辨率的提高,这2个狭缝分别为前端狭缝和中心杯狭缝。其中,前端狭缝位于离子透镜与飞行管道之间,调节该狭缝宽度可以对所有同位素离子的峰型进行优化;中心杯狭缝位于中心法拉第杯的前端,改变该狭缝只能实现对进入中心法拉第杯离子流的质量分辨率的调节;此外,利用中心杯狭缝与中心法拉第杯之间的相对位
置,通过移动中心杯使中心杯狭缝与法拉第杯之间形成所谓的“狭缝”,借助该“狭缝”可以进一步截取掉一些进入中心法拉第杯的多原子离子,从而降低其对硅同位素离子的干扰。
2.2.1 前端狭缝调节 调节前端狭缝宽度前后的峰型对比示于图2。可以看出,当前端狭缝的宽度为W1时,除了28Si+峰型为对称的平顶峰之外,29Si+和30Si+由于受到严重的同量异位素离子的干扰,几乎无法分辨硅同位素离子与干扰离子;随着前端狭缝逐渐变窄至宽度为W2时,29Si+和30Si+与干扰离子实现了一定程度的分离,出现了比较明显的平台。也就是说,通过使前端狭缝的宽度变窄可以提高质谱仪的质量分辨率,实现29Si+和30Si+离子与干扰离子的有效分离。

图2 前端狭缝宽度从W1调至W2对比图Fig.2 Comparison of silicon isotopes adjusting the width of front slit from W1 to W2
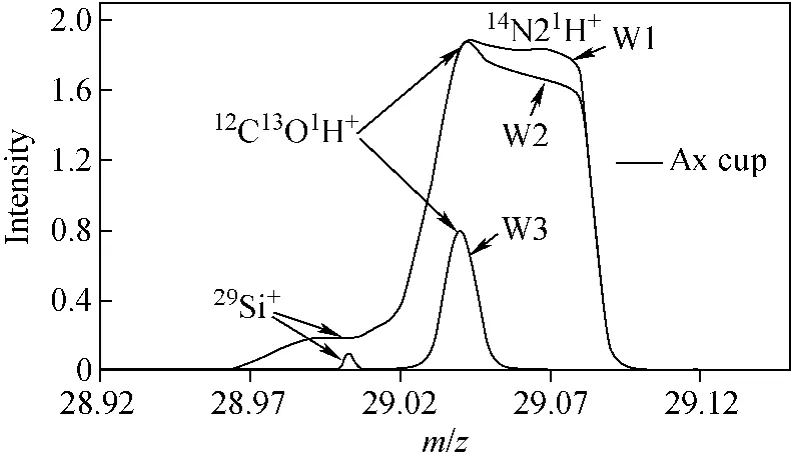
图3 中心杯狭缝宽度调节对比图Fig.3 Comparison of the width of Ax slit on signal intensities and spectra shape
2.2.2 中心杯狭缝调节 中心杯狭缝的宽度共有3个档位,分别命名为W1、W2、W3,中心杯狭缝宽度调节对比图示于图3。图3中,从W1到W2再到W3对应最宽狭缝到最窄狭缝。当中心杯狭缝被调节至最窄宽度(W3)时,大部分离子因被狭缝截取而损失,此时29Si+与多原子离子实现了完全分离。但是29Si+峰型由平顶峰变成尖峰,这为获取良好的数据增加了很大难度。因此,将中心杯狭缝的宽度设置为W2。
2.2.3 中心杯位置调节 对于硅的3个同位素而言,29Si+受到的同量异位素的干扰除了基于C、N、O等的多原子离子之外,还受到28Si1H+干扰,为了实现两者的分离所需要的质量分辨率也最高。为此,在优化了狭缝宽度之后,本工作通过调节中心杯狭缝与中心法拉第杯之间的相对位置,使部分多原子离子被截取以实现分离,中心杯位置调节对比图示于图4。从图4可以看出,随着中心法拉第杯由初始的“0”位置向偏离中心的位置移动,峰型呈现整体向高质量端移动的趋势,而且随着中心法拉第杯的移动,29Si+与多原子离子逐步实现完全分离,而29Si+的信号强度并未发生明显衰减。

图4 中心杯位置调节对比图Fig.4 Comparison of the Ax cup position on signal intensities and spectra shape
2.3 碰撞气的选择
碰撞池技术被认为是有效降低甚至消除多原子离子干扰的有效方法之一[18]。本工作分别尝试了氖气(Ne)与氢气(H2)的混合气、氖气与氩气(Ar)的混合气两种碰撞气,对比分析了多原子离子信号强度的变化情况,以及使用氢气作为碰撞气时产生的氢化物离子对硅同位素离子的干扰情况。
采用Ne和H2的混合气作为碰撞气时获得的峰型图示于图5,优化后的Ne和H2的流
量分别为10mL/min和0.1mL/min。与图3对比可以看出,多原子离子的信号强度明显降低,其与硅同位素离子的信号强度比由原来的8~10倍降低至2~3倍,29Si+和30Si+的平台宽度进一步变大,为测得准确可靠的同位素丰度比值提供了保障。随后,采用Ne和Ar的混合气作为碰撞气对峰型的变化情况进行了研究,优化后的Ne和Ar的流量分别为10mL/min和1mL/min,结果示于图6。采用Ne和Ar的混合气作为碰撞气时,Ne原子和Ar原子都是通过与多原子离子发生碰撞使其失去电荷或者发生分解而被消除的。而采用Ne和H2的混合气作为碰撞气时,除了Ne原子与多原子离子的相互碰撞之外,由于H原子较高的反应活性,通过与多原子离子反应生成新的离子而将其引起的干扰消除。对比分析图5和图6可以看出,采用Ne和H2的混合气作为碰撞气更有利于降低多原子离子的信号强度。

图5 Ne和H2混合气作为碰撞气时的质谱图Fig.5 Mass spectrogram of silicon isotopes and isobaric interferences using mixture of Ne and H2as collision gas
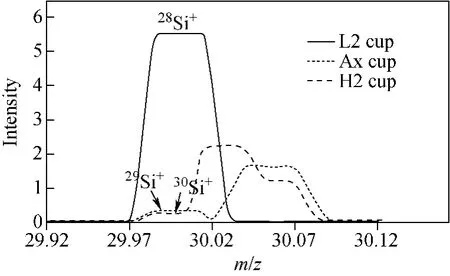
图6 Ne和Ar混合气作为碰撞气时的质谱图Fig.6 Mass spectrogram of silicon isotopes and isobaric interferences using mixture of Ne and Ar as collision gas
为了量化SiH+的生成比例,首先分析了0.025%四甲基氢氧化铵(TMAH)空白溶液在m/z31处的离子流,以确认不存在高于本底的信号,随后分析浓度为600g/L的30Si浓缩同位素溶液,质量扫描范围为m/z 29.5~31.5,经对比分析和谱峰确认,生成的30SiH+信号强度是30Si+信号强度的0.2%,即采用Ne和H2的混合气作为碰撞气后,氢化物的生成比例为0.2%。在相同的实验条件下,将碰撞气改为Ne和Ar的混合气时,计算得氢化物的生成比例为0.004%。考虑到天然样品中28Si丰度值是29Si丰度值的20倍左右,若采用Ne和H2的混合气作为碰撞气,生成的28Si1H+将对29Si+带来明显的干扰;加之采用Ne和Ar的混合气作为碰撞气时,29Si+和30Si+的平台宽度已满足数据采集的需求,经综合考虑,决定采用Ne和Ar的混合气作为碰撞气。

图7 TMAH浓度对同量异位素干扰离子信号强度的影响Fig.7 Influence of TMAH concentrations on signal intensities and spectra shape
2.4 基体浓度的选择
通常情况下,采用氢氧化钠溶液与单质硅反应生成硅酸盐来制备硅溶液[19],这导致溶液中钠离子的浓度很高,将其引入质谱仪后会对仪器的透镜系统等带来明显的损坏。四甲基氢氧化铵是一种弱碱性有机溶剂[20],在合适的条件下,能够与单质硅完全反应,从而大大降低溶液中盐分的含量。但是,TMAH在等离子体中将产生大量C、N、H等的离子以及基于此形成的多原子离子,为此对比分析了基体浓度对多原子离子形成情况的影响。分别将0.25%和0.025%TMAH空白溶液引入质谱仪,得到的谱图示于图7。由图7可以看出,当基体浓度
降低10倍后,生成多原子离子的信号强度降低了四分之一左右,也就是说,降低溶液中TMAH浓度可以抑制基于C、N、H等的多原子离子的生成。
2.5 硅同位素丰度比的测量
在实现了硅同位素离子与同量异位素干扰离子的分离后,优化了MC-ICP-MS测定硅同位素丰度比的最佳条件,并在此条件下,分别测定了德国PTB提供的天然硅同位素样品WASO 04以及中国计量科学研究院研制的水中硅浓度标准溶液GBW(E)080272,测量结果列于表3。可以看出,利用所建立的硅同位素分析方法测量同位素丰度比29/28和30/28的测量外精度达0.02%,能够满足硅同位素分析要求。随后,以WASO 04作为硅同位素参照标准,计算样品NIM GBW(E)080272中硅同位素分馏系数δ30Si为-1.57‰。可见,不同来源地的硅样品之间存在一定的同位素分馏现象。

表3 样品WASO04和GBW(E)080272中硅同位素丰度比的测量值Table 3 Values of silicon isotope ratios in WASO04 and GBW(E)080272
3 结论
本研究建立了碰撞池-多接收电感耦合等离子体质谱分析硅同位素丰度组成的方法,利用碰撞池技术,采用Ne和Ar的混合气作为碰撞气,降低了同量异位素干扰离子的信号强度;通过调节狭缝宽度等提高仪器的质量分辨率,实现了硅同位素离子与干扰离子的有效分离,方法测量精度达0.02%,能够满足硅同位素分析的要求。
[1] CAROLINE F,BERNARD B.Silicon isotope evidence against an enstatite chondrite earth[J].Science,2012,335(23):1 477-1 480.
[2] DING T P,WAN D,WANG C,et al.Silicon isotope compositions of dissolved silicon and suspended matter in the Yangtze River,China[J].Geochim Cosmochim Acta,2004,68(2):205-216.
[3] DING T P,MA G R,SHUI M X,et al.Silicon isotope study on rice plants from the Zhejiang province,China[J].Chem Geol,2005,218(1/2):41-50.
[4] OPFERGELT S,CARDINAL D,HENRIET C, et al.Silicon isotope fractionation between plant parts in banana:in situ vs.in vitro[J].J Geochem Expl,2006,88(1/3):224-227.
[5] ROCHA C L D L,BRZEZINSKI M A,DENIRO M J,et al.Silicon isotope composition of diatoms as an indicator of past oceanic change[J].Nature,1998,395(6 703):680-683.
[6] FRANCOIS R,MARC C.A Palaeotemperature curve for the precambrian oceans based on silicon isotopes in cherts[J].Nature,2006,443(7 114):969-972.
[7] REYNOLDS B C,FRANK M,HALLIDAY A N.Silicon isotope fractionation during nutrient utilization in the north pacific[J].Earth Planet Sci Lett,2006,244(1/2):431-443.
[8] GEORG R B,REYNOLDS B C,WEST A J,et al.Silicon isotope variations accompanying basalt weathering in iceland[J].Earth Planet Sci Lett,2007,261(3/4):476-490.
[9] 黄达峰,罗修全,李喜斌,等.同位素质谱技术与应用[M].北京:化学工业出版社,2006:301-302.
[10]DING T P,WAN D,BAI R,et al.Silicon isotope abundance ratios and atomic weights of NBS-28and other reference materials[J].
Geochim Cosmochim Acta,2005,69(23):5 487-5 494.
[11]BERN C R,BRZEZINSKI M A,BEUCHER C,et al.Weathering,dust,and biocycling effects on soil silicon isotope ratios[J].Geochim Cosmochim Acta,2010,74(3):876-889.
[12]GEORG R B,REYNOLDS B C,FRANK M,et al.New sample preparation techniques for the determination of Si isotopic compositions using MCICPMS[J].Chem Geol,2006,235(1/2):95-104.
[13]REYNOLDS B C,GEORGE R B,OBERLI F,et al.Re-assessment of silicon isotope reference materials using high-resolution multi-collector ICP-MS[J].J Anal At Spectrom,2006,21(3):266-269.
[14]EMMA E,ILIA R,DOUGLAS C B,et al.Chromatographic purification for the determination of dissolved silicon isotopic compositions in natural waters by high-resolution multicollector inductively coupled plasma mass spectrometry[J].Anal Chem,2006,78(1):250-257.
[15]SANDER H J M van den B,PIETER Z V,COOS C van B,et al.Determination of Silicon isotope ratios in silicate materials by high-resolution MC-ICP-MS using a sodium hydroxide sample digestion method[J].J Anal At Spectrom,2006,21(8):734-742.
[16]ROCHA C L D L.Measurement of silicon stable isotope natural abundances via multicollector inductively coupled plasma mass spectrometry(MCICP-MS)[J].Geochem Geophys Geosyst,2002,3(8):1-8.
[17]CARDINAL D,ALLEMAN L Y,JEROEN de J,et al.Isotopic composition of silicon measured by multicollector plasma source mass spectrometry in dry plasma mode[J].J Anal At Spectrom,2003,18(3):213-218.
[18]任同祥,逯海,王军,等.碰撞池-多接收电感耦合等离子体质谱测定硒同位素的质量偏移效应研究[J].分析化学,2010,38(11):1 620-1 624.REN Tongxiang,LU Hai,WANG Jun,et al.Analysis of mass bias in measurement of Selenium isotope with multi-collectors inductively coupled plasma mass spectrometry[J].Chin J Anal Chem,2010,38(11):1 620-1 624(in Chinese).
[19]PRAMANNA A,RIENITZA O,SCHIEL D,et al.Novel concept for the mass spectrometric determination of absolute isotopic abundances with improved measurement uncertainty:Part 3—molar mass of Silicon highly enriched in28Si[J].Int J Mass Spectrom,2011,305(1):58-68.
[20]TABATA O,ASAHI R,FUNABASHI H,et al.Anisotropic etching of silicon in TMAH solutions[J].Sens Actuators A,1992,34(1):51-57.
Determination of Silicon Isotope Ratios by Collision-Cell Multi-Collectors Inductively Coupled Plasma Mass Spectrometry
REN Tong-xiang,ZHOU Tao,LU Hai,ZHOU Yuan-jing,WANG Jun
(National Institute of Metrology,Beijing100013,China)
The method of analyzing the silicon isotope ratios was developed by collision cell multi-collectors inductively coupled plasma mass spectrometry(MC-ICP-MS).Replacing to PFA nebulizer,Pt cones and sapphire injector were proved to be helpful to decrease the silicon concentration in the instrument;silicon ions were partly separated with interferences after,when the mass resolution was increased by adjusting the slits’width;using mixture of Neon(Ne)and Argon(Ar)as collision gas and keeping the matrix(TMAH)in lower concentration could efficiently reduce the production of polyatomic ions,which contributed to the decrease of isobaric interferences.Subsequently,the silicon isotope composition of samples WASO 04and GBW(E)080272were determined,the uncertainty of this method was about 0.02%,theδ30Si value of GBW(E)
multi-collectors inductively coupled plasma mass spectrometry(MC-ICP-MS);collision cell;silicon;isotope ratio
O657.63
A
1004-2997(2015)02-0104-07
10.7538/zpxb.youxian.2014.0066
2014-04-14;
2014-06-30
国家科技支撑计划项目(2013BAK10B04);中国计量科学研究院创新团队项目(CXTD1206)资助
任同祥(1980—),男(汉族),河南人,副研究员,从事同位素分析工作。E-mail:rentx@nim.ac.cn
王 军(1967—),女(汉族),辽宁人,研究员,从事无机质谱研究。E-mail:wangjun@nim.ac.cn
时间:2014-12-02;
http:∥www.cnki.net/kcms/doi/10.7538/zpxb.youxian.2014.0066.html
080272relative to WASO 04was-1.57‰.
