鱼藤酮诱导PC12细胞自噬的初步研究*
2015-12-06黄永秀崔涌泉王建东
刘 腾,黄永秀,王 丹,崔涌泉,王建东△,张 红△
1.成都医学院 检验医学院(成都 610500);2.成都医学院 生物医学系(成都 610500);3.中国人民解放军第37医院 检验病理科(雅安 625000)
帕金森病(Parkinson′s disease,PD)是常见的一种影响中老年运动功能的中枢神经系统疾病。流行病学调查结果[1]显示,这种疾病主要发于老年人群,随着我国人口老龄化速度加快,其发病率呈现递增趋势。已有研究[2-3]认为,细胞内线粒体代谢异常是导致PD发生的一个重要环节。有研究[4]表明,细胞内的受损线粒体主要通过自噬途径降解,因此,自噬途径的异常可以阻碍受损线粒体的降解,从而导致PD发生。
自噬(autophagy)是细胞内一种依赖溶酶体的物质降解途径,也是细胞在外界环境刺激以及生理病理调控下的自我保护过程,自噬不足或过度自噬都会导致细胞死亡,这也是许多疾病的重要致病机制。自噬主要的研究方法如电镜观察细胞超微结构、Western blot检测自噬相关蛋白、细胞免疫荧光检测自噬斑等,均已广泛应用于细胞自噬的研究[5]。
近年来研究[6-7]发现,鱼藤酮可对机体的神经系统功能产生影响,它可选择性聚集在线粒体等细胞器,抑制复合体Ⅰ活性,损害细胞氧化磷酸化,从而诱导自噬发生。农业生产中的很多农药含有鱼藤酮,从而使人们接触鱼藤酮的机会大大升高。本研究通过探寻鱼藤酮对PC12细胞自噬的影响,为治疗PD提供更多的理论支持。
1 材料与方法
1.1 实验材料与试剂
PC12细胞购自中国科学院典型培养物保藏委员会细胞库。稳定转染pEGFP-LC3质粒的PC12细胞株为成都医学院生物医学系生物技术实验室构建并保存。DMEM完全培养基和胎牛血清购自GIBCO公司。BCA蛋白定量试剂盒、辣根过氧化物酶标记的山羊抗兔IgG和山羊抗小鼠IgG购自碧云天生物科技研究所。兔抗LC3B多克隆抗体购自Novus抗体公司,小鼠抗β-actin单克隆抗体购自成都正能生物技术有限责任公司。PVDF膜和ECL化学发光试剂购自Millipore公司。鱼藤酮购自Sigma公司。
1.2 实验方法
1.2.1 Western blot检测蛋白表达 取对数生长期的PC12细胞,按照3×105个/孔接种于6孔板中,置于37℃、5%CO2培养箱中培养48h后,进行实验分组。浓度梯度组:分别加入终浓度为0、0.01、0.05、0.1、0.5、1、5、10μmol/L的鱼藤酮处理细胞,处理12h后收集各组细胞。时间梯度组:加入终浓度为1μmol/L的鱼藤酮,分别处理0、2、6、12、18、24h,收集各组细胞。在各组细胞中加入ripa裂解液,冰上裂解细胞30min,于4℃,14 000 g,离心半径10cm,离心15min,收集裂解上清液,BCA法测定蛋白浓度。SDS-PAGE电泳,每组上样60μg/泳道,PVDF膜湿转60~80min,分别加兔抗LC3B抗体(1∶1 000)及小鼠抗β-actin抗体(1∶10 000),4℃孵育过夜,TBST洗膜3次,分别加辣根过氧化物酶标记的山羊抗兔IgG(1∶2 000)或山羊抗小鼠IgG(1∶2 000),37℃,孵育1h,TBST洗膜3次,ECL化学发光法检测相关蛋白表达情况。
1.2.2 细胞荧光技术检测细胞自噬水平 取对数生长期的PC12细胞,接种于放置了多聚赖氨酸包被圆玻片的24孔板中,接种量5×104个/孔,37℃,培养48h后进行实验分组。浓度梯度组:分别加入终浓度为 0、0.01、0.05、0.1、0.5、1、5、10μmol/L的鱼藤酮处理细胞12h。时间梯度组:加入终浓度为1μmol/L的鱼藤酮,分别处理0、2、6、12、18、24h。鱼藤酮处理完后,吸去培养基,PBS洗涤3次,冰甲醇-20℃,固定15min,PBS洗涤3次,封片,利用荧光显微镜观察照相。细胞自噬水平采用GFP-LC3荧光斑点计数法,即对每个细胞中的GFP-LC3荧光斑点数目进行计数,每组样品随机统计200个细胞。
1.2.3 透射电镜观察细胞结构 取对数生长期的PC12细胞,按照3×105个/孔接种于6孔板中,置于37℃、5%CO2培养箱中培养48h后,加入终浓度为1μmol/L的鱼藤酮,分别处理0、2、6、12、18、24h。收集各组细胞,放于10mL离心管中,800 g,离心半径14.5cm,离心15min,弃去上清液。沿管壁缓慢加入4mL 0.5%戊二醛固定液,于4℃静置10~15min,再于10 000 g,离心半径10.45cm,离心10min,弃去上清液。沿管壁缓慢加入4mL 3%戊二醛固定液进行预固定,1%四氧化锇再固定。丙酮逐级脱水,Epon812包埋,半薄切片进行光学定位,超薄切片后进行醋酸铀和枸橼酸铅双染色,日立H-600型透射电镜观察。
1.3 统计学方法
采用SPSS 19.0统计软件处理数据,定量资料以均数±标准差(±s)描述,组间比较采用单因素方差分析(one-way ANOVA)。检验水准α设定为0.05。
2 结果
2.1 荧光显微镜观察各浓度梯度组细胞中GFPLC3荧光斑点
使用荧光显微镜观察各组细胞中GFP-LC3荧光斑点情况,结果显示,随着鱼藤酮浓度升高,PC12细胞中GFP-LC3荧光斑点的数量也随之上升,并且从1μmol/L浓度的鱼藤酮处理开始,PC12细胞的形态也产生明显的收缩、变圆等变化(图1~2)。
2.2 Western blot检测各浓度梯度组细胞中LC3-Ⅰ和LC3-Ⅱ表达
利用Western blot检测各组细胞中LC3-Ⅰ和LC3-Ⅱ的表达情况,结果表明,随着鱼藤酮浓度的升高,PC12细胞中LC3-Ⅱ的表达呈增长趋势,进一步分析结果显示,随着鱼藤酮浓度梯度的增加,衡量细胞自噬水平的LC3-Ⅱ/LC3-Ⅰ比值也呈梯度增长趋势(图3~4)。
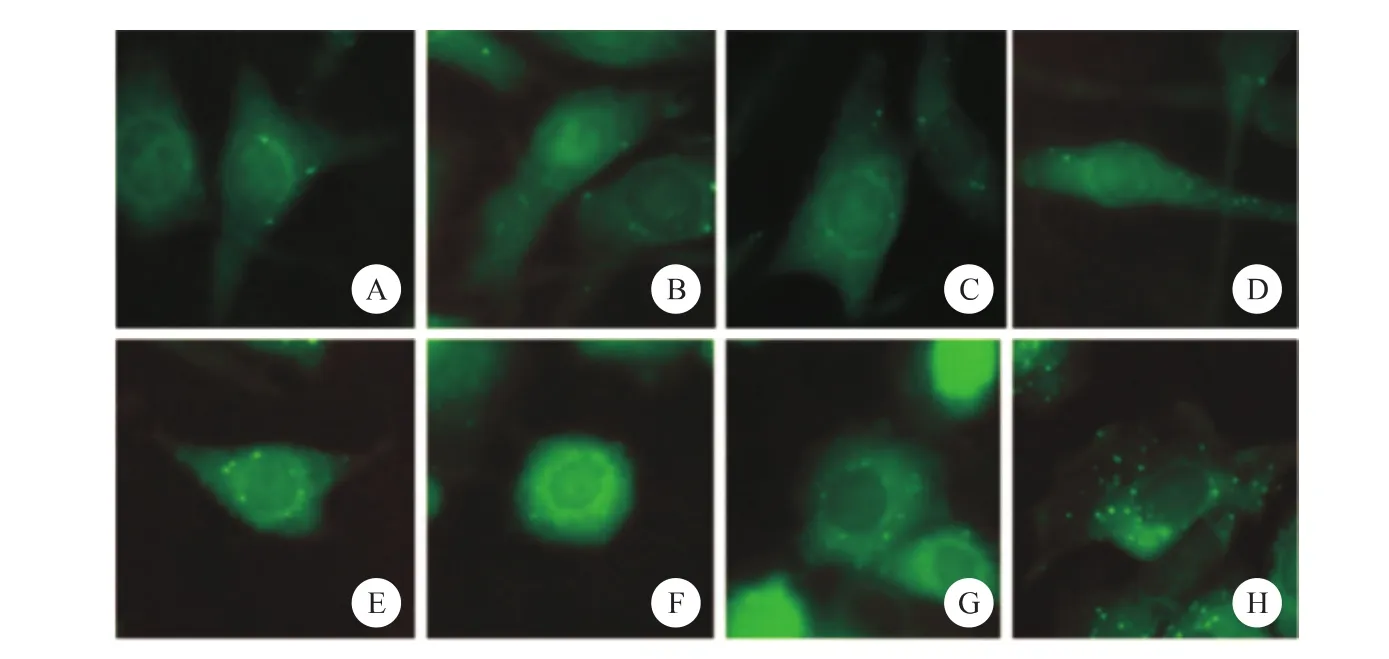
图1 细胞荧光技术检测各组细胞中GFP-LC3荧光斑点
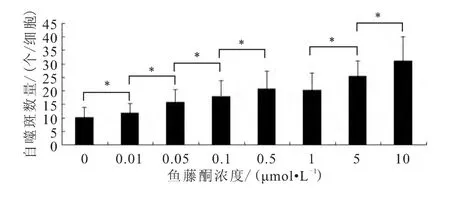
图2 各组细胞中GFP-LC3荧光斑点数量(±s)
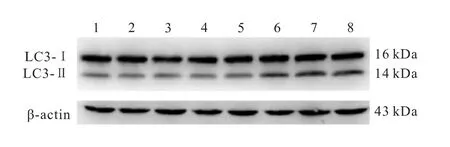
图3 Western blot检测各组细胞中LC3-Ⅰ和LC3-Ⅱ的表达
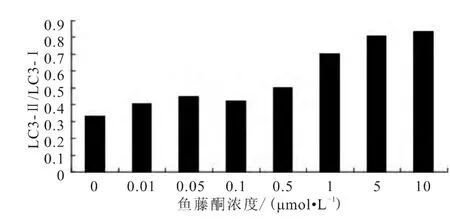
图4 各组细胞中LC3-Ⅱ/LC3-Ⅰ表达
2.3 荧光显微镜观察各时间梯度组细胞中GFPLC3荧光斑点
使用荧光显微镜观察各组细胞中GFP-LC3荧光斑点情况,结果显示,随着鱼藤酮处理时间的延长,细胞中GFP-LC3荧光斑点的数量也随之上升,并且鱼藤酮处理6h后,PC12细胞的形态也产生了收缩、变圆等变化(图5~6)。
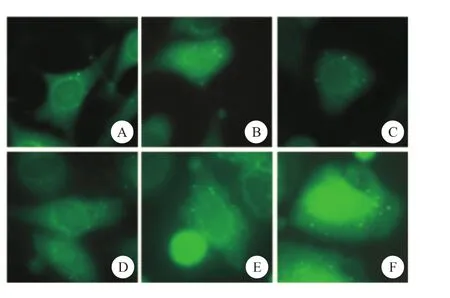
图5 细胞荧光技术检测各组细胞中GFP-LC3荧光斑点
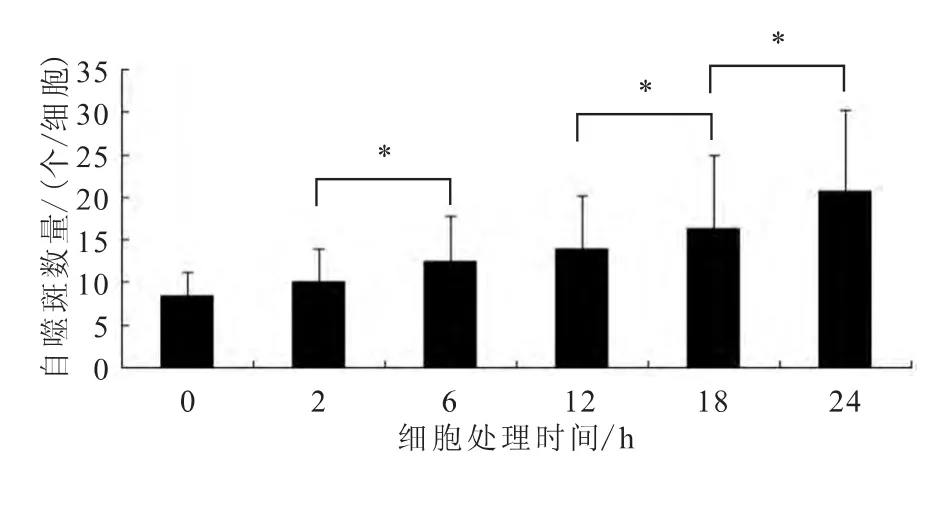
图6 各组细胞中GFP-LC3荧光斑点数量(±s)
2.4 Western blot检测各时间梯度组细胞中LC3-Ⅰ和LC3-Ⅱ表达
利用Western blot检测各组细胞中LC3-Ⅰ和LC3-Ⅱ的表达情况,结果表明,随着鱼藤酮处理时间的延长,PC12细胞中LC3-Ⅱ的表达呈先增高后降低的趋势,进一步的分析结果显示,随着处理时间的增加,衡量细胞自噬水平的LC3-Ⅱ/LC3-Ⅰ比值也呈先增高后降低的趋势(图7~8)。
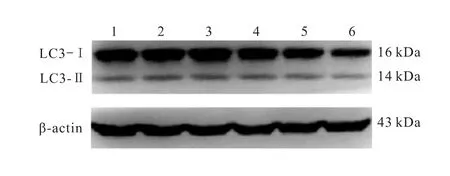
图7 Western blot检测各组细胞中LC3-Ⅰ和LC3-Ⅱ的表达
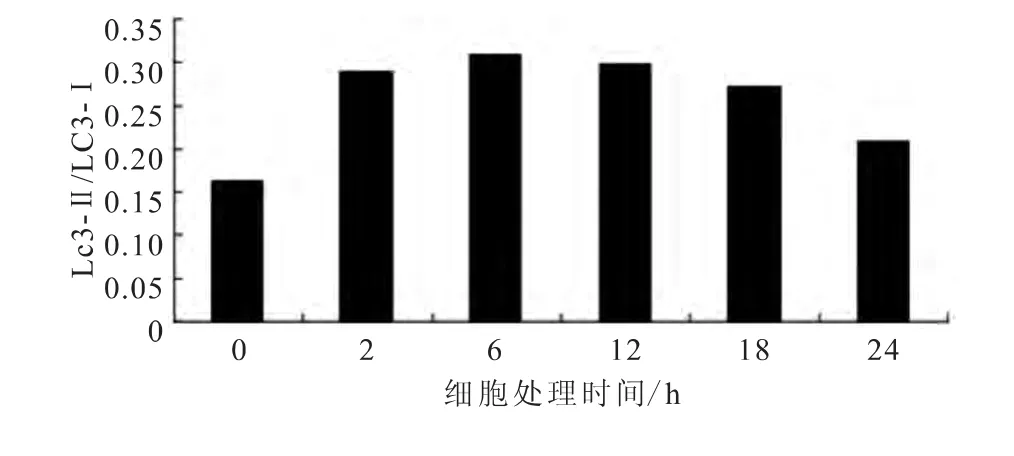
图8 各组细胞中LC3-Ⅱ/LC3-Ⅰ表达
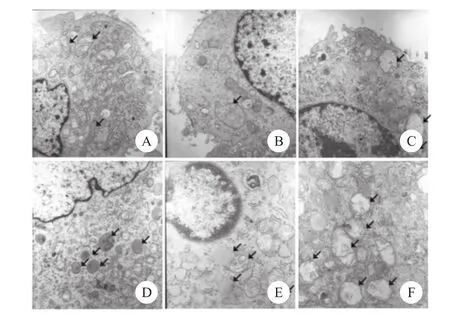
图9 电镜观察1μmol/L鱼藤酮处理对PC12细胞自噬影响(×1 2000)
2.5 透射电镜观察各时间梯度组细胞显微结构
采用透射电镜观察1μmol/L鱼藤酮处理PC12细胞后,细胞自噬随时间变化的情况,发现2h细胞内即可观察到部分线粒体发生明显肿胀;6h和12 h细胞内均有明显增多的自噬体和自噬溶酶体,并且线粒体数量明显减少;18h和24h多数细胞均有核浓缩变小,细胞内充满液泡样结构,同时多数细胞死亡脱落(图9)。
3 讨论
LC3-Ⅱ/LC3-Ⅰ比值法和LC3荧光斑点计数是广泛用于细胞自噬水平检测的两种方法,本研究主要采用这两种方法研究鱼藤酮处理对PC12细胞自噬水平的影响。结果显示,随着鱼藤酮处理浓度的升高,各组细胞中LC3-Ⅱ/LC3-Ⅰ比值和LC3荧光斑点数量均呈上升趋势,表明鱼藤酮处理浓度与细胞自噬水平有较大的相关性。同时,鱼藤酮处理浓度由0.5μmol/L增加为1μmol/L时,PC12细胞形态发生显著改变,如细胞突触明显减少、多数细胞收缩变圆等。已有研究[8-11]证实,细胞形态改变是细胞发生大量自噬导致的细胞主要变化之一,表明1μmol/L鱼藤酮处理可以诱导PC12细胞发生明显自噬。因此,选择1μmol/L鱼藤酮处理PC12细胞进行后续的时间梯度实验。
在时间梯度实验中,随着鱼藤酮处理时间延长,PC12细胞中LC3荧光斑点数量也随之增加,二者表现出较好的一致性。但是,各组细胞中的LC3-Ⅱ/LC3-Ⅰ比值,在0~6h处理时间段内增高,而在6~24h处理时间段内却降低。已有研究[12-14]表明,在神经细胞中,LC3-Ⅰ的含量明显高于LC3-Ⅱ,这与LC3-Ⅱ在自噬的发生过程中很快被清除有关,并且在自噬的发生过程中,LC3-Ⅰ会转化成LC3-Ⅱ,因此,可以用LC3-Ⅰ的变化来说明自噬的程度。本实验结果也表明,从6h开始细胞内LC3-Ⅰ的含量在逐渐降低,并在24h达到最低值,表明从6h开始LC3-Ⅰ转化成LC3-Ⅱ的速度增快,使得LC3-Ⅰ的生成速度低于LC3-Ⅰ的转化速度,从另一方面也揭示此时细胞的自噬水平在增加。
为了进一步揭示鱼藤酮处理时间对PC12细胞自噬的影响,本研究采用透射电镜观察细胞超微结构的改变。随着鱼藤酮处理时间延长,PC12细胞中的线粒体首先发生肿胀等异常改变,同时细胞内的自噬体和自噬溶酶体也随之增加,而经过长时间(18h后)的处理,多数细胞内充满液泡样结构,同时细胞死亡脱落,这一过程类似于细胞自噬性死亡,但还需要进一步的实验证实。
综上所述,鱼藤酮处理浓度和处理时间与PC12细胞的自噬水平存在一定的相关性,并且1μmol/L鱼藤酮处理6h,即可诱导PC12细胞形态发生明显改变。而电镜观察结果表明,鱼藤酮处理会导致细胞线粒体损伤,从而诱导PC12细胞自噬的发生。
[1]Shacka JJ,Roth KA,Zhang J.The autophagy-lysosomal degradation pathway:role in neurodegenerative disease and therapy[J].Front Biosci,2008,13:718-736.
[2]Narendra D,Tanaka A,Suen DF,et al.Parkin is recruited selectively to impaired mitochondria and promotes their autophagy[J].J Cell Biol,2008,183(5):795-803.
[3]Narendra DP,Jin SM,Tanaka A,et al.PINK1is selectively stabilized on impaired mitochondria to activate Parkin[J].PLoS Biol,2010,8(1):1000298.
[4]Geisler S,Holmström KM,Treis A,et al.The PINK1/Parkin-mediated mitophagy is compromised by PD-associated mutations[J].Autophagy,2010,6(7):871-878.
[5]Klionsky DJ,Abeliovich H,Agostinis P,et al.Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes[J].Autophagy,2008,4(2):151-175.
[6]韩威,孙立忠,胡林森,等.鱼藤酮与帕金森病[J].中国老年学杂志,2011,31(12):2376-2378.
[7]Tyurina YY,Polimova AM,Maciel E,et al.LC/MS analysis of cardiolipins in substantia nigra and plasma of rotenonetreated rats:Implication for mitochondrial dysfunction in Parkinson′s disease[J].Free Radic Res,2015,49(5):681-691.
[8]赵黔鲁,柴锡庆.鱼藤酮致PC12细胞线粒体功能及超微结构的影响[J].第三军医大学学报,2005,27(7):632-635.
[9]黄晓峰,尹文,王文勇,等.鱼藤酮诱导的多巴胺能神经细胞死亡与免疫[J].细胞与分子免疫学杂志,2010,26(10):1059-1061.
[10]邓有才,赛燕,董兆君,等.西罗莫司对鱼藤酮诱导PC12细胞凋亡的抑制作用[J].中国药理学与毒理学杂志,2010,24(3):201-206.
[11]竺飞燕,张雄,王百辰,等.鱼藤酮诱导PC12细胞凋亡及线粒体膜电位变化[J].中国药理学通报,2014,30(2):266-269.
[12]Klionsky DJ,Abdalla FC,Abeliovich H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2012,8(4):445-544.
[13]Castino R,Fiorentino I,Cagnin M,et al.Chelation of lysosomal iron protects dopaminergic SH-SY5Yneuroblastoma cells from hydrogen peroxide toxicity by preduding autophagy and Akt dephosphorylation[J].Toxicol Sci,2011,123(2):523-541.
[14]Michiorri S, Gelmetti V, Giarda E,et al. The Parkinsonassociated protein PINK1interacts with Beclin 1 and promotes autophagy[J].Cell Death Differ,2010,17(6):962-974.
