丙型肝炎病毒基因型与慢性丙型肝炎患者预后的相关性研究*
2015-12-06唐先梅董玉虹
唐先梅,董玉虹
1.汉中市中心医院 感染科(汉中 723000);2.青岛市传染病医院 肝病四区(青岛 266000)
现行慢性丙型肝炎(HCV)病毒感染患者的标准治疗为注射聚乙二醇干扰素(PEG-IFN)α-2a或2b联合口服利巴韦林(RBV)[1]。该方法不仅治疗成本高昂,还易降低患者顺应性,治疗后仅50%患者实现持续病毒学应答(sustained virological response,SVR)。有学者[2-3]报道,HCV 基因 2、3型患者经过24周的治疗,SVR率达70%~80%;感染HCV基因1型的患者经48周治疗后,SVR率仅40%左右。本研究进一步探讨了HCV基因型与PEG-IFN联合RBV治疗实现SVR反应之间的相关性,现报道如下。
1 资料与方法
1.1 临床资料
选取2012年10月至2014年7月汉中市中心医院收治的HCV患者45例,均符合《病毒性肝炎防治方案》及《慢性丙型肝炎防治指南》诊断标准,并排除乙型肝炎合并感染、人类免疫缺陷病毒-1型、肝移植及不接受PEG-IFN联合RBV治疗的患者。其中男29例,女16例;年龄16~69(43.44±15.59)岁。经PEG-IFN联合RBV治疗后,根据患者SVR结果分为非SVR组(n=31)和SVR组(n=14)。本研究经医院伦理委员会批准,所有患者知情同意。
1.2 方法
45例慢性HCV患者注射PEG-IFN 180μg,联合口服RBV 800~1 200mg进行抗病毒治疗,采用线性探针反向杂交法(INNO-LiPA)检测HCV基因型。HCV基因1型治疗48周,HCV基因2、3型治疗24周[4]。疗程结束后对患者SVR进行检测,并行肝穿刺活检留取肝组织,根据METAVIR评分测定肝纤维化程度。采集患者外周血,定量分析血清HCV-RNA高低病毒载量比值比(OR值)。
1.3 评价标准
按肝纤维化程度(F0~F4)分为轻、中、重度3级:F0~F1为轻度,F2为中度,F3~F4为重度。SVR定义为治疗结束后24周HCV-RNA降低至不可检测水平。未完成SVR患者包括治疗结束后SVR仍可测,以及SVR水平反弹患者治疗结束后HCV-RNA水平不可测,但停止治疗24周后又可检测出HCV-RNA。对血清HCV-RNA定量测定并分析高低病毒载量,<600 000IU/mL为低病毒载量,≥600 000IU/mL为高病毒载量,并计算病毒载量OR值。OR=1,表示该因素对疾病的发生不起作用;OR>1,表示该因素是危险因素;OR<1,表示该因素是保护因素。
1.4 观察指标
观察两组患者的治疗结果,并分析影响治疗结果的相关因素,包括年龄、HCV基因型、肝纤维化评分和高低病毒载量等。
1.5 统计学方法
应用SPSS 19.0统计学软件进行数据处理,计数资料以百分比表示,采用等级资料的秩和检验;SVR相关因素分析采用logistic回归,显著性水平采用双侧检验。检验水准α设定为0.05。
2 结果
2.1 两组临床结果与HCV基因型的相关性
非SVR组中HCV基因1型患者占90.32%(28/31),多于SVR 组的57.14%(8/14);非 SVR组2、3型患者占9.68%(3/31),低于 SVR 组的42.86%(6/14)。非SVR组患者肝轻、中、重度纤维化 比例 为 16.13%(5/31)、38.71%(12/31)、45.16%(14/31),SVR 组 为 21.43%(3/14)、42.86%(6/14)、35.71%(5/14),差异无统计学意义(P=0.533);非 SVR 组低病毒载量占32.26%(10/31),与SVR组42.86%(6/14)比较,差异无统计学意义(P=0.497);非SVR组高病毒载量占67.74%(21/31),与SVR组57.14%(8/14)比较,差异无统计学意义(P=0.725)(表1)。

表1 两组HCV基因型经PEG-IFN/RBV治疗后临床结果比较[n(%)]
2.2 OR值与PEG-IFN联合RBV治疗后SVR预测因素的关系
各因素OR值计算:年龄(每年)、HCV基因型(2/3vs.1)、纤维化(轻度vs.中度vs.重度)和病毒载量(低vs.高)。结果显示:HCV基因型与PEGIFN联合RBV治疗有显著相关性,HCV基因2、3型(OR=7.20,P=0.000 3)是与治疗反应相关的最强因素,且独立于其他变量之外。其他相关因素包括年龄(OR=0.92,P=0.040 1)和低病毒载量(OR=3.58,P=0.007 6)(表2)。
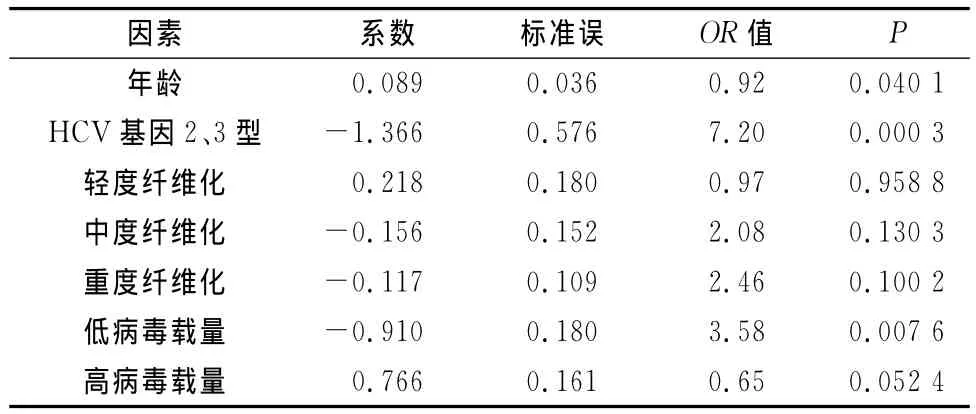
表2 OR值与PEG-IFN/RBV治疗后HCV患者中SVR预测因素比较
3 讨论
HCV感染是引起慢性肝病的首要原因,通常无症状。大量病毒在宿主细胞内发生免疫应答,大多伴随慢性持续性病毒血症出现。HCV慢性感染与肝内炎症浸润有关,通常发展成进行性肝纤维化,并进一步导致肝硬化,最终发展成肝细胞癌[5]。HCV感染诱导IFN生成,尤其是IFNL3,一部分通过病毒核酸作用于具有明显模式识别受体的病原体相关分子,如细胞表面Toll样受体,细胞内的传感器如在感染的宿主细胞中的RNA解旋酶维甲酸诱导基因-Ⅰ(RIG-Ⅰ)[6]。通过干扰素信号通路激活干扰素刺激基因(ISGs),在阻止病毒复制和增强机体细胞免疫反应对宿主HCV病毒感染的先天防御中起关键作用[7]。
据报道,全世界有超过3%的人口感染HCV[8],如果治疗不当,慢性HCV经常会发展成慢性肝病(CH),如肝硬化(LC)、肝细胞癌(HCC)等[9]。过去抗病毒治疗主要依靠干扰素,近10年逐渐发展为干扰素联合RBV治疗,目前则将PEGIFN联合RBV作为慢性HCV的标准治疗模式[10-11]。长期临床研究[12]发现,SVR和复发患者肝癌的发病率明显低于未经应答及干扰素治疗患者。最近 有研究[13-14]表明,PEG-IFN 联合 RBV 治疗可以提高慢性HCV患者的SVR响应率,但该疗法仍未能治愈所有患者,总SVR率低于85%。
研究[15]表明,HCV基因1型属于感染率最高的基因型,HCV-1患者通过PEG-IFN联合RBV治疗48周,SVR率仅40%左右;基因2、3型患者经PEG-IFN联合RBV连续治疗24周,SVR率可达70%~80%。提示SVR率与HCV基因型有关,但需要明确HCV基因型是否为PEG-IFN联合RBV治疗后影响HCV患者SVR的独立因素。本研究分析了HCV基因型和SVR的关系,并进一步探讨了影响PEG-IFN联合RBV治疗结果的独立因素,结果表明,年龄、低病毒载量和HCV基因型均是独立预测因素,其中HCV基因2、3型是与治疗反应相关的最强因素。虽然本研究中样本含量仅为45例,而构建模型的自变量有6个,不能排除因样本含量偏低导致的模型估计值误差,但一定程度上提示在慢性HCV感染临床治疗中HCV基因型鉴别的重要性,建议患者行个体化医疗模式,从而提高SVR率、降低不良反应、缩短治疗时间、减少住院成本。
[1]谭英征,陈双华,傅京力,等.聚乙二醇干扰素α-2a和重组人干扰素α-2b治疗慢性丙肝临床疗效观察[J].实用临床医药杂志,2010,14(8):75-76.
[2]Katz LH,Goldvaser H,Gafter-Gvili A,et al.Extended peginterferon plus ribavirin treatment for 72weeks versus standard peginterferon plus ribavirin treatment for 48weeks in chronic hepatitis C genotype 1infected slow-responder adult patients[J].Cochrane Database Syst Rev,2012,9:CD008516.
[3]Liu CH,Huang CF,Liu CJ,et al.Pegylated interferon-α2a with or without low-dose ribavirin for treatment-naive patients with hepatitis C virus genotype 1receiving hemodialysis:a randomized trial[J].Ann Intern Med,2013,159(11):729-738.
[4]中华医学会肝病学分会肝癌学组.乙型肝炎、丙型肝炎病毒相关性肝细胞癌抗病毒治疗专家建议[J].中华消化杂志,2013,33(2):73-79.
[5]Rollet-Kurhajec KC,Moodie EE,Walmsley S,et al.Hepatic Fibrosis Progression in HIV-Hepatitis C Virus Co-Infection-The Effect of Sex on Risk of Significant Fibrosis Measured by Aspartate-to-Platelet Ratio Index[J].PLoS One,2015,10(6):129868.
[6]Blonski W,Reddy KR.Hepatitis C virus infection and hepatocellular carcinoma[J].Clin Liver Dis,2008,12(3):661-674.
[7]Saito T,Owen DM,Jiang F,et al.Innate immunity induced by composition-dependent RIG-I recognition of hepatitis C virus RNA[J].Nature,2008,454(7203):523-527.
[8]Mohd Hanafiah K,Groeger J,Flaxman AD,et al.Global epidemiology of hepatitis C virus infection:New estimates of age ‐ specific antibody to HCV seroprevalence[J].Hepatology,2013,57(4):1333-1342.
[9]李元元,徐向升,于双杰,等.Telaprevir联合治疗慢性丙型肝炎新进展[J].肝脏,2012,17(7):521-523.
[10]黄建伟,王永忠,钱留喜.丙肝病毒IL-28B基因多态性与干扰素抗病毒治疗疗效的相关性[J].实用临床医药杂志,2014,18(17):141-142.
[11]邵清,张健,李梵,等.聚乙二醇干扰素α-2a联合利巴韦林治疗慢性丙型肝炎对肝纤维化的影响[J].传染病信息,2013,26(3):152-154.
[12]李颖,杨帆.一项新的关于对聚乙二醇干扰素和利巴韦林联合治疗持续应答的慢性丙型肝炎患者进展为肝癌的预测评分系统[J].中国感染与化疗杂志,2013(3):172.
[13]张晓红,洪春霞,许镇,等.聚乙二醇干扰素联合利巴韦林治疗慢性丙型肝炎患者效果的影响因素[J].中华传染病杂志,2012,30(7):416-420.
[14]陈冬玲,冯淑焕,李萍,等.聚乙二醇干扰素α-2α与利巴韦林联合胸腺肽α1治疗慢性丙型肝炎疗效观察[J].现代医药卫生,2010,26(6):901.
[15]魏君锋.ISDR变异对聚乙二醇干扰素联合利巴韦林治疗1b型慢性丙型病毒性肝炎疗效的影响[D].南方医科大学,2011.
