人肝再生增强因子基因慢病毒表达载体的构建与鉴定*
2015-12-06王伯庆尹继炜
薛 峰,王伯庆,尹继炜,易 超
新疆医科大学附属肿瘤医院 肝胆胰外科(乌鲁木齐 830011)
改善肝部分切除术后余肝再生能力一直是困扰肝脏外科医生的难题。随着分子生物学技术的不断发展,肝细胞损伤修复过程的分子生物学机制研究逐步成为肝脏基础研究的核心内容。肝再生增强因子(augmenter of liver regeneration,ALR)是近年来发现的一种高表达于肝细胞中的特异性分裂原,在肝细胞损伤修复过程中发挥着至关重要的作用[1-2]。本研究通过构建携带人ALR基因的慢病毒表达载体,并转染BLR 3A大鼠肝细胞验证其安全性与有效性,以期为深入研究ALR在肝再生过程中的作用机制奠定良好的实验基础。
1 材料与方法
1.1 仪器与试剂
PCR扩增试剂盒购自生工生物工程(上海)有限公司;ALR PCR扩增引物由生工生物工程(上海)有限公司设计合成;SacⅡ限制性内切酶、大量质粒提抽试剂盒、dNTP、Taq DNA 聚合酶、1Kb plus DNA Marker、T4连接酶购自NEB公司;pCDALR由深圳大学附属罗湖区人民医院李海军教授惠赠;中间克隆载体pUC57、pLenti6/V5-D-TOPO重组慢病毒载体、ViraPowerTMPackaging Mix慢病毒包装体系、病毒定量引物、TaKaRaMiniBEST Viral RNA/DNA Extraction kit试剂盒购自百奥迈科生物技术有限公司;BLR 3A大鼠肝细胞、Top10化学感受态细胞与293T病毒包装细胞由中国科学院上海细胞库提供;LipofectamineTM2000转染试剂盒购自Invitrogen公司;两部法反转录-聚合酶链反应试剂盒、琼脂糖胶回收试剂盒、Trizol试剂盒购自北京天恩泽生物有限公司;DMEM培养基、胎牛血清、胰蛋白酶、LB培养基、OptiMEM培养基、SDSPAGE凝胶制备试剂盒购自Gibco公司;多功能凝胶电泳槽、96孔梯度PCR仪、CO2细胞培养箱、倒置荧光显微镜、NU-437-400E型生物安全柜、-80℃低温冰柜及PBS缓冲液等常用分子生物化学试剂由新疆医科大学附属肿瘤医院肿瘤研究所提供。
1.2 方法
1.2.1 ALR基因扩增与检测 根据GenBank提供的人ALR基因全长信息,设计PCR扩增引物,以人胎肝cDNA为模板进行PCR扩增,扩增产物与pCD-ALR质粒(阳性对照,成功合成的ALR基因片段载体)酶切产物共同电泳对比鉴定,利用琼脂糖胶回收试剂盒回收扩增产物送生工生物工程(上海)有限公司测序验证。将扩增得到经验证无误的ALR基因片段平端连接入pUC57载体后,转染Top10化学感受态细胞,37℃倒置培养过夜,次日扩大培养生长较好的菌落2h后行PCR菌检,利用大量质粒提抽试剂盒提取阳性克隆质粒(pUC57-ALR)行测序鉴定。ALR基因PCR扩增引物,上游引 物:5′-GCGGAATTCGCAACGGAATGCGGA CCCACCAGAAGCGGGAC-3′;下游引物:5′-GCT GGATCCTTAGTCACAGGAGGCGTCCTTCC-3′。
1.2.2 构建pLenti6/V5-D-TOPO-ALR质粒 将含有与GenBank提供的人ALR基因信息相吻合的ALR基因片段的pUC57-ALR质粒与pLenti6/V5-D-TOPO载体用SacⅡ限制性内切酶酶切后进行连接,连接产物转染Top10化学感受态细胞,37℃倒置培养过夜,次日同前法行PCR菌检后SacⅡ限制性内切酶酶切鉴定,鉴定无误的阳性克隆提抽质粒送测序后,-80℃冻存。
1.2.3 慢病毒包装 培养293T细胞至对数生长期后,行胰蛋白酶消化制成单细胞悬液,293T细胞按5×106个/mL浓度铺10cm板,37℃、5%CO2培养箱培养至细胞生长到90%汇合度后,培养基更换为无血清培养基。用OptiMEM培养基洗涤细胞3次后,将293T细胞加入5mL OptiMEM培养基,37℃、5%CO2培养箱孵育20min。参照LipofectamineTM2000转染试剂盒说明书,将5μg LipofectamineTM2000 与 10 μg ViraPowerTMPackaging Mix、5 μg pLenti6/V5-D-TOPO-ALR质 粒 混 合 后,37 ℃、5%CO2培养箱孵育20min。加入孵育后的293T细胞中培养8h,去除培养基,并用PBS缓冲液冲洗细胞3次。加入DMEM培养基25mL,37℃、5%CO2培养箱培养72h。完成转染后,荧光显微镜下观察293T细胞荧光蛋白表达情况,评价转染效果,确定转染成功后,收集培养瓶内上清液,4℃、离心15min(离心半径20cm,转速4 000r/min),上清液0.45μm微孔滤膜过滤。相同条件下再次离心15min,上清液即为病毒浓缩液,分装后-80℃冻存。
1.2.4 病毒滴度测定 TaKaRaMiniBEST Viral RNA/DNA Extraction kit试剂盒提取250μL病毒液RNA后,稀释至30μL,取2μL RNA以101~1 011copies/μL的pLenti6质粒作为标准样品,进行实时定量PCR检测测定病毒滴度。
1.2.5 携带人ALR基因慢病毒表达载体转染BLR 3A大鼠肝细胞 BLR 3A大鼠肝细胞培养至对数生长期后,行胰蛋白酶消化制成单细胞悬液,同前293T细胞铺10cm板培养24h至90%汇合度。37℃预热的0.01mol/L PBS缓冲液冲洗细胞3次后,加入2mL DMEM培养基,37℃、5%CO2培养箱孵育20min。参照LipofectamineTM2000转染试剂盒说明书,加入500μL病毒液与10μg LipofectamineTM2000,37 ℃、5%CO2培养箱孵育72h后,观察BLR 3A大鼠肝细胞生长情况及荧光蛋白表达情况。
1.2.6 RT-PCR法检测BLR3A大鼠肝细胞人ALR基因表达 上述转染72h的BLR 3A大鼠肝细胞,取1×107个细胞胰蛋白酶消化后,采用Trizol试剂盒提取细胞总RNA。参照两步法RTPCR试剂盒说明书,检测人ALR基因表达,反应参数设定为:95 ℃、5min;94 ℃、30s;52 ℃、40s;72℃、30s;72℃、7min;28个循环,内参照β-actin。以加入空慢病毒载体与等量PBS缓冲液的BLR 3A大鼠肝细胞为对照。ALR基因PCR扩增引物,上游引物:5′-GCGGAATTCGCAACGGAATGCGG ACCCACCAGAAGCGGGAC-3′;下游引物:5′-GC TGGATCCTTAGTCACAGGAGGCGTCCTTCC-3′。
2 结果
2.1 ALR基因扩增电泳检测
扩增的目的基因与pCD-ALR质粒中ALR基因片段位置一致,均位于 Marker的300~400bp,与GenBank报道ALR基因长度(378bp)一致(图1)。
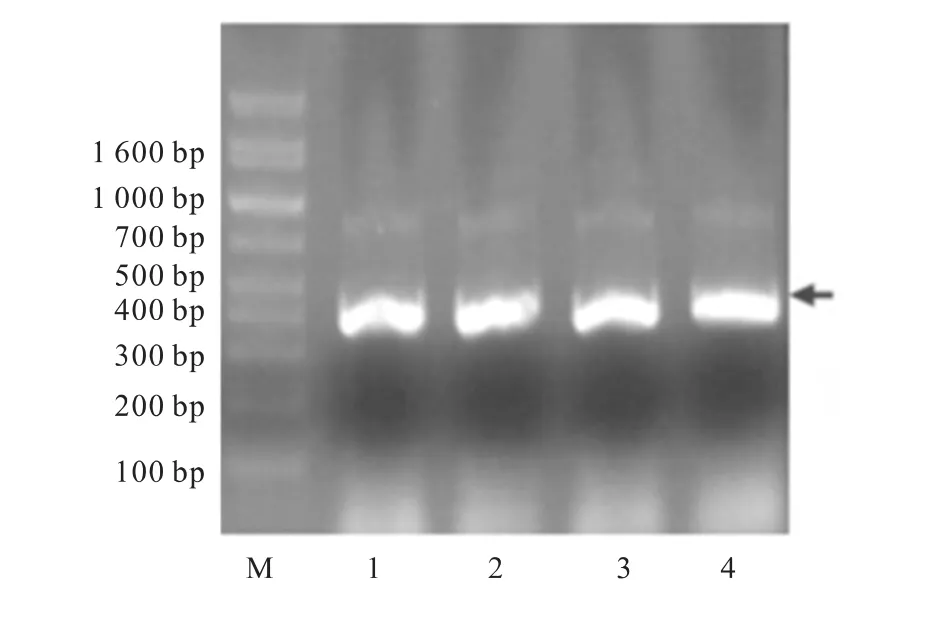
图1 ALR基因与pCD-ALR质粒酶切产物凝胶电泳图
2.2 pLenti6/V5-D-TOPO-ALR质粒酶切电泳检测
经酶切后获得大小约7 000bp(慢病毒表达载体质粒)和378bp两个条带,证实ALR基因片段成功插入pLenti6/V5-D-TOPO载体中(图2)。
2.3 基因测序
扩增产物、pUC57-ALR质粒与pLenti6/V5-DTOPO-ALR质粒酶切后测序结果经DNAStarSeqMan软件分析显示,合成的ALR基因与GenBank报道一致,无碱基错排、缺失与突变。

图2 pLenti6/V5-D-TOPO-ALR质粒酶切电泳图
2.4 病毒滴度及慢病毒包装293T细胞荧光蛋白表达
实时定量PCR测得病毒滴度为1.48×107v.p./mL。慢病毒质粒转染293T细胞72h后荧光显微镜下观察荧光蛋白表达情况,转染率为92.31%,培养72h过程中仅有少量细胞出现病变脱落(图3)。

图3 转染293T细胞72h后荧光显微镜下观察(×100)
2.5 构建的携带人ALR基因慢病毒表达载体转染BLR 3A大鼠肝细胞
转染后72h培养过程中,仅少量BLR 3A细胞发生病变脱落,荧光显微镜下观察荧光蛋白表达结果显示,转染率达88.49%。RT-PCR电泳结果显示,仅人ALR慢病毒表达载体转染的BLR 3A大鼠肝细胞表达人ALR基因,加入空慢病毒载体与等量PBS缓冲液的BLR 3A大鼠肝细胞均未见有阳性表达条(图4~5)。
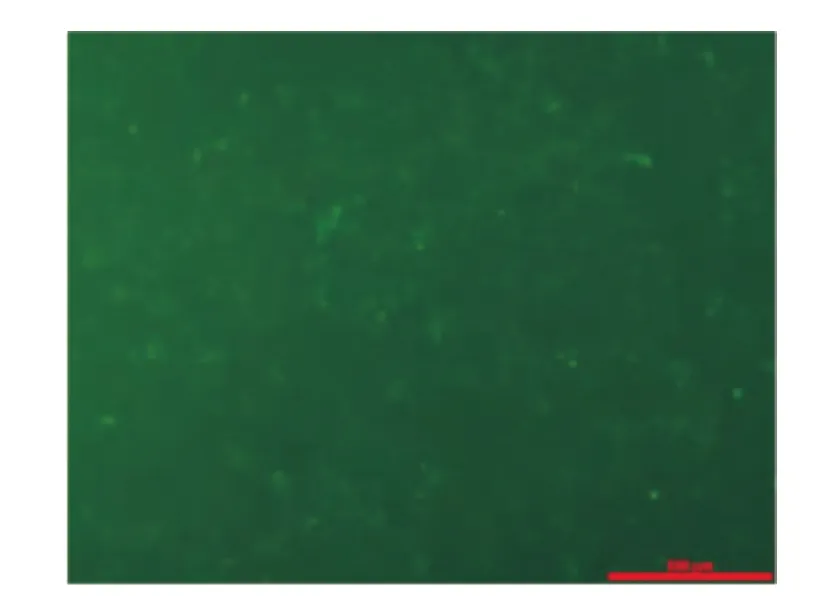
图4 BLR 3A大鼠肝细胞转染72h后荧光显微镜下观察(×100)
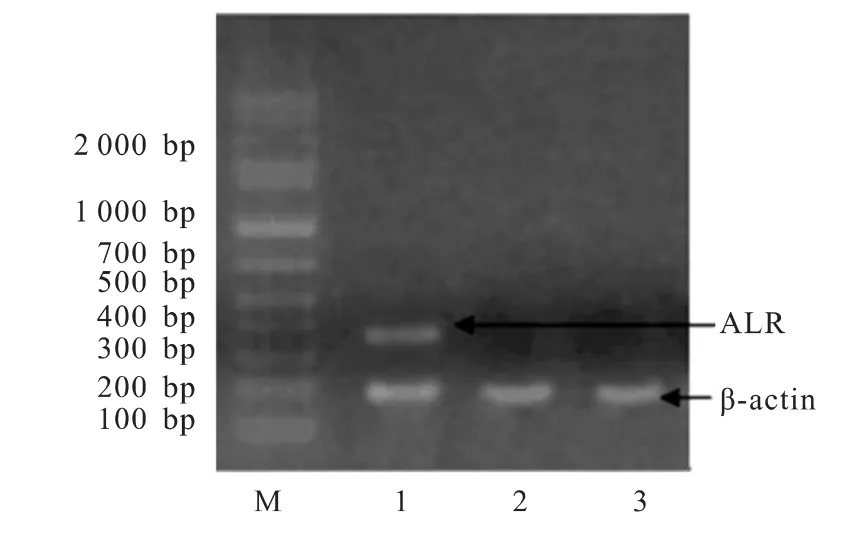
图5 BLR 3A细胞RT-PCR凝胶电泳照片
3 讨论
由于肝脏外科技术的飞速发展,肝部分切除或肝移植术后,肝脏再生能力及其调控机制逐步成为肝脏基础研究领域的核心问题。目前已知与肝脏再生相关的因子超过百种,但多数不具有肝脏特异性[3]。ALR是近年发现的一种在肝细胞内高度表达且高效促肝细胞增殖的分裂原,其在肝脏损失修复过程中发挥着至关重要的作用[1-2]。
ALR由Hagiya等[4]于1994年在大鼠肝组织中发现,随后学者们依据大鼠ALR基因扩增引物,利用PCR技术从人胎肝中筛选成功获得人ALR cDNA克隆。ALR在促进肝细胞增殖方面的高效性已成为共识。最近,Tang等[5]研究显示,在胆道梗阻诱导的急性黄疸性肝炎模型中,ALR可显著促进肝细胞的增殖,以加速受损肝脏的修复。Wang等[6]研究显示,ALR在大鼠肝移植模型肝脏损伤修复中发挥着关键性作用,外源性重组ALR可明显加速移植肝脏组织的生长,并有效提高大鼠生存率。上述研究证实了ALR在肝脏损伤修复过程中的关键性作用,但其机制尚不明确。为深入研究ALR基因在肝脏部分切除后余肝再生中作用机制,本研究采用基因重组技术构建了携带ALR基因的慢病毒表达载体,并通过电泳、酶切鉴定及基因测序分析的方法证实了其准确性,为进一步研究奠定了实验基础。
无论是基因功能的研究还是基因治疗的实现,最关键的环节是如何选择合适载体。理想的载体既要保证实现有效的基因转移,又可使目的基因得到稳定表达,同时还可兼顾安全性。慢病毒表达载体是一种来源于人类免疫缺陷病毒-1的新型病毒载体,具有高效转染能力,目前已广泛用于分子生物化学研究的各个领域[7-10]。安全性方面,选择与病毒载体成分不同源的包装体系即可防止其恢复为野生免疫缺陷病毒-1,从而避免致病的可能[11]。与以往常用的反转录病毒载体和腺病毒载体相比,慢病毒载体具有可感染处于分裂期和非分裂期细胞,可连接基因片段长,可实现基因稳定表达且免疫反应小等优点[12-15]。
本研究采用酶切连接的方法成功构建了携带目的基因的慢病毒表达载体,保证了目的基因插入方向的准确性,防止反义基因的表达。转染BLR 3A大鼠肝细胞的过程中,仅有少部分大鼠肝细胞发生脱落坏死,转染率达88.49%,且RT-PCR结果显示,被转染的大鼠肝细胞可稳定表达ALR基因。研究结果证实,慢病毒表达载体是用于基因研究乃至基因治疗的理想载体,兼具安全性与有效性。但值得注意的是,本研究中获得的慢病毒滴度仅为1.48×107v.p./mL,尚不足以应用于临床研究,其临床应用的安全性也需深入研究证实。
[1]Li Y,Zhang L,Liu Q,et al.Exogenous augmenter of liver regeneration(ALR)attenuates inflammatory response in renal hypoxia re-oxygenation injury[J].Ren Fail,2014,36(3):432-436.
[2]Schaefer-Ramadan S,Gannon SA,Thorpe C.Human augmenter of liver regeneration:probing the catalytic mechanism of a flavin-dependent sulfhydryl oxidase[J].Biochemistry,2013,52(46):8323-8332.
[3]冯仁鑫,邓星,张新,等.肝再生研究进展[J].胃肠病学,2015,20(3):169-173.
[4]Hagiya M,Francavilla A,Polimeno L,et al.Cloning and sequence analysis of the rat augmenter of liver regeneration(ALR)gene:expression of biologically active recombinant ALR and demonstration of tissue distribution[J].Proc Natl Acad Sci USA,1994,91(17):8142-8146.
[5]Tang C,Lin H,Wu Q,et al.Recombinant human augmenter of liver regeneration protects hepatocyte mitochondrial DNA in rats with obstructive jaundice[J].J Surg Res,2015,196(1):90-101.
[6]Wang N,Wang Z,Sun H,et al.Augmenter of liver regeneration improves therapeutic effect of hepatocyte homotransplantation in acute liver failure rats[J].Int Immunopharmacol,2013,15(2):325-332.
[7]廖张元,叶静,关云谦,等.水通道蛋白4慢病毒表达载体的构建与临床应用[J].中华医学杂志,2010,90(3):208-212.
[8]邱志兵,陈鑫,段超,等.靶向STAT3的慢病毒表达载体的构建及其对血管平滑肌细胞增殖凋亡的影响[J].中华实验外科杂志,2011,28(4):506-509.
[9]高巧艳,李燕,高雪明,等.小鼠ST2基因慢病毒表达载体的构建及鉴定[J].细胞与分子免疫学杂志,2014,30(9):944-947.
[10]刘玥,帅春,尹虹,等.miR-196b慢病毒表达载体的构建和功能鉴定[J].基础医学与临床,2014,34(5):674-678.
[11]徐晓明,杨慧,王晓萍,等.慢病毒载体的构建及优化[J].中国临床康复,2006,10(9):147-149.
[12]周玲丽,曹骥,李薇,等.沉默FABP-5基因对人肝癌 HepG2细胞的影响[J].世界华人消化杂志,2015,23(2):179-188.
[13]张婵,董文斌,赵帅,等.慢病毒载体靶向介导p66shc基因沉默[J].重庆医学,2015,44(1):73-75,83.
[14]Prieto C,Fontana D,Etcheverrigaray M,et al.A strategy to obtain recombinant cell lines with high expression levels.Lentiviral vector-mediated transgenesis[J].BMC Proc,2011,8:7.
[15]Liu S,Liu X,Wang H,et al.Lentiviral vector-mediated doxycycline-inducible USP39shRNA or cDNA expression in triple-negative breast cancer cells[J].Oncol Rep,2015,33(5):2477-2483.
