胶质瘤相关性癫痫致痫灶组织中高迁移率族蛋白B1的表达*
2015-12-04王新军杨如意周少龙杨永辉武跃辉谢井伟
王新军,杨如意,周少龙,杨永辉,武跃辉,王 振,谢井伟,梁 博
1)郑州大学第五附属医院神经外科 郑州450052 2)郑州大学第三附属医院儿童脑瘫康复科 郑州450052
△男,1965年7月生,博士,教授,主任医师,研究方向:脑肿瘤的基础与临床,E-mail:wangxj@zzu.edu.cn
目前,癫痫发病机制尚不明确。成人期癫痫最常见的病因为脑肿瘤,大部分低病理级别胶质瘤伴癫痫发作[1]。胶质瘤并致痫灶切除术是治疗胶质瘤相关性癫痫的常用方法,且疗效显著[2-3]。高迁移率族蛋白B1(high-mobility group box-1,HMGB1)作为一种染色质非组蛋白核蛋白,几乎存在于所有真核细胞内[4]。已有研究[5-6]证实HMGB1 及其受体TLR4 参与癫痫鼠模型的发病和复发,并且人类颞叶癫痫病例海马中HMGB1 和TLR4 表达的组织病理学模式与癫痫鼠模型相似;HMGB1 及其受体TLR4、RAGE 通过参与免疫反应促使癫痫的发生。作者对人脑胶质瘤相关性癫痫致痫灶组织中HMGB1 的表达进行了检测,探讨其临床意义。
1 对象与方法
1.1 研究对象 选取郑州大学第五附属医院神经外科2007年1月1日至2009年12月30日手术治疗的82例胶质瘤相关性癫痫患者手术切除的致痫灶组织、胶质瘤组织、瘤周非致痫灶脑组织蜡块标本。82例患者年龄15~68岁,其中男60例,女22例;术前均有典型癫痫发作症状,脑电监测可确认癫痫;24例患者致痫灶位于额叶,40例位于颞叶,18例位于顶叶;术前癫痫发作持续时间≤5 min 40例,>5 min 42例;术前癫痫平均发作频率≤3次/月24例,>3次/月58例;21例为低病理级别胶质瘤,61例为高病理级别胶质瘤;所有患者术前均未接受放化疗及其他治疗。肿瘤组织均经病理诊断为胶质瘤。术中参考脑皮层和深部电极监测结果取非功能区致痫灶组织标本。瘤周非致痫灶脑组织为术中未引发异常脑电、且术后病理未见胶质瘤细胞的非功能区脑组织。入选标本及临床信息均已获患者、家属及医院伦理委员会同意。
1.2 主要试剂和仪器 兔抗人HMGB1 单克隆抗体购自美国Sigma 公司,羊抗兔二抗试剂盒及DAB显色试剂盒购自上海拜沃生物科技有限公司,荧光显微镜购自日本Nikon 公司。
1.3 HMGB1 蛋白的检测 标本包埋后以3 μm 厚连续切片,置于防脱剂预处理后的载玻片上。滴加HMGB1 单克隆抗体(稀释20 倍)4℃过夜,PBS 清洗后滴加生物素标记二抗,室温孵育20 min,PBS 清洗,加辣根过氧化物酶标记的链霉卵白素工作液,室温孵育15 min,DAB 显色,苏木精复染,常规乙醇脱水,二甲苯透明,中性树胶封片后显微镜下观察。以PBS 液代替一抗作阴性对照。选择每张切片免疫反应较强的区域,高倍视野下(×400)观察5个不重复视野,计数染色阳性细胞及视野内总细胞数,计算阳性细胞百分比。根据阳性细胞百分比评分:无阳性细胞为0 分,阳性细胞百分比≤25%为1 分,≤50%为2 分,≤75%为3 分,>75%为4 分;根据染色程度评分:无染色为0 分,淡黄色为1 分,深黄色为2 分。最后以两种评分方式相加的综合得分为最终得分,0 分为阴性,1~6 分为阳性;其中1~3 分为低表达,4~6 分为高表达。
1.4 统计学处理 利用SPSS 17.0 进行统计学处理。致痫灶、胶质瘤与瘤周非瘤脑组织中HMGB1表达的比较采用配对χ2检验,不同临床病理因素患者致痫灶组织中HMGB1 表达的比较应用χ2检验,检验水准α=0.05。
2 结果
2.1 各种脑组织中HMGB1 的表达 HMGB1 在瘤周非致痫灶脑组织中有少量表达(图1),致痫灶组织、胶质瘤组织中HMGB1 的表达明显高于瘤周非致痫灶脑组织(表1、2)。
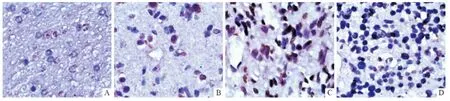
图1 胶质瘤、致痫灶、瘤周非致痫灶脑组织中HMGB1 的表达(SP,×400)
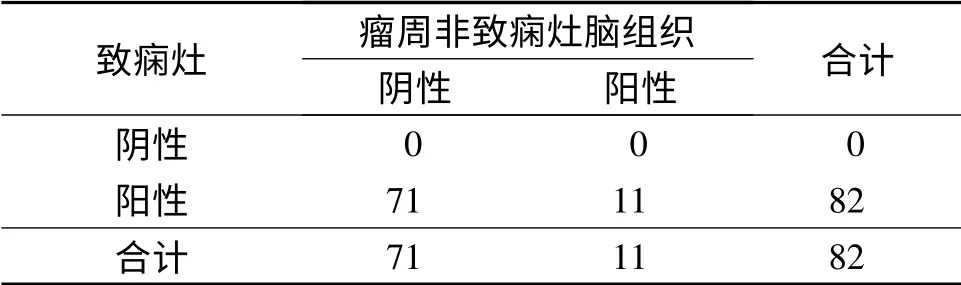
表1 致痫灶、瘤周非致痫灶脑组织中HMGB1 表达的比较例
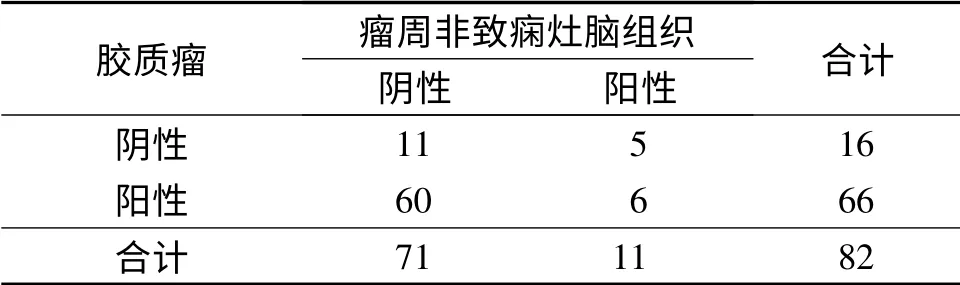
表2 胶质瘤、瘤周非致痫灶脑组织中HMGB1 表达的比较例
2.2 致痫灶组织中HMGB1 的表达与临床病理因素的关系 胶质瘤相关性癫痫患者致痫灶组织中HMGB1 表达与性别、年龄、致痫灶位置无关,而与癫痫持续时间、癫痫发作频率、胶质瘤病理级别有关(表3)。
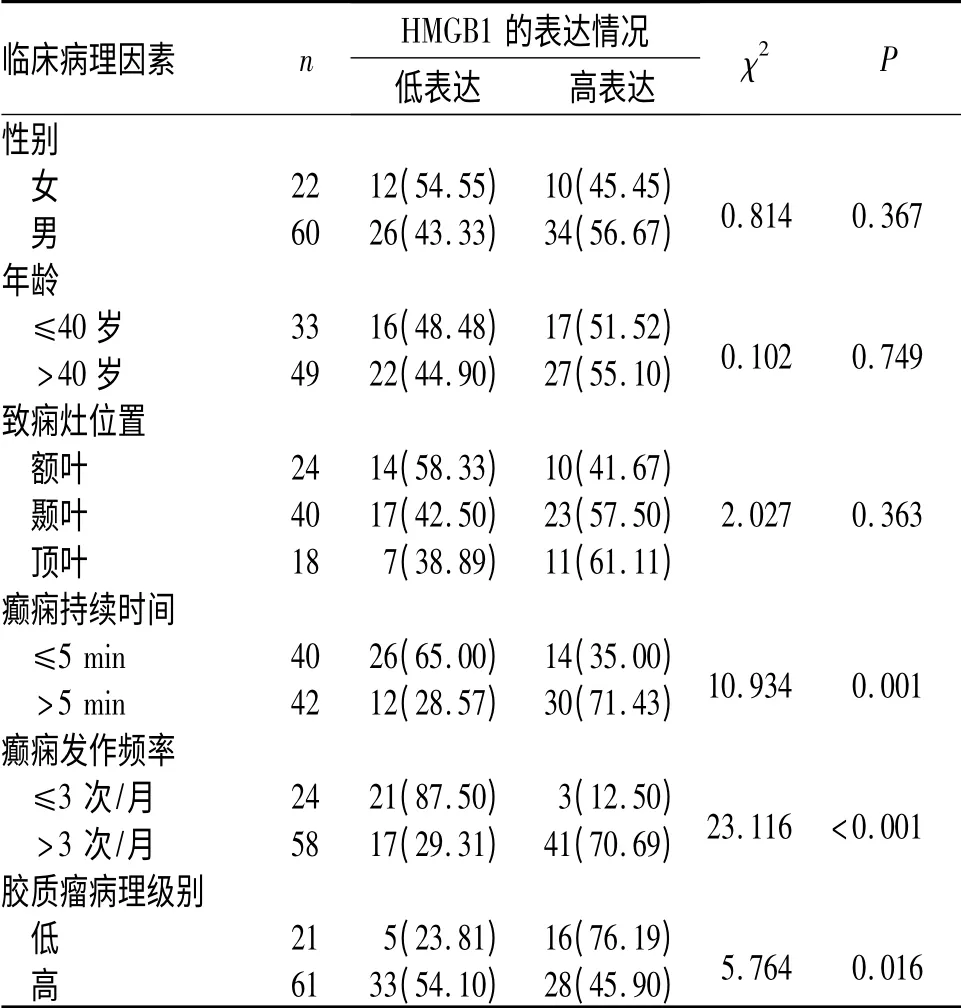
表3 致痫灶组织中HMGB1的表达与临床病理因素的关系例(%)
3 讨论
目前,对癫痫的发病机制研究较多,国内外研究[5-6]提示HMGB1 在原发性癫痫的发病、复发中均起到重要作用,对于胶质瘤相关性癫痫,国内外鲜见类似报道。胶质瘤相关性癫痫药物治疗效果欠佳,属难治性癫痫。针对这类患者,郑州大学第五附属医院神经外科通常采用的方法为术中皮层脑电监测准确定位致痫灶,切除胶质瘤的同时,尽可能地切除致痫灶,这样才能使胶质瘤相关性癫痫的手术效果得以保障[7-8]。这种手术治疗的方法是该研究标本获取的前提。
该研究中,HMGB1 在胶质瘤组织、致痫灶组织中的表达均高于瘤周非致痫灶脑组织,提示HMGB1 不仅参与了胶质瘤的生长、浸润[9],对癫痫的发病也起到重要作用。胶质瘤在生长、浸润过程中HMGB1 高表达,影响瘤周组织的微环境,HMGB1 与其受体共同作用使皮层异常放电、信号传递紊乱,这可能是胶质瘤继发性癫痫的发病机制,HMGB1 及其作用机制可能成为胶质瘤相关性癫痫研究的新方向。
该研究发现,致痫灶组织中HMGB1 的表达与患者的性别、年龄、致痫灶位置无关,而与癫痫持续时间、发作频率关系密切,该结果进一步表明HMGB1 表达与胶质瘤相关性癫痫的发病有直接关系,换言之,胶质瘤相关性癫痫的发作可能随致痫灶组织中HMGB1 表达的增高而剧烈。推测HMGB1在致痫灶中高表达将直接影响致痫灶异常放电的强度、频率,致使癫痫发作频繁、持续时间延长。接下来的研究中作者将会验证这种推测,若成立,则HMGB1 将可能成为药物控制癫痫的新靶点。
研究[10]表明,胶质瘤中HMGB1 表达与其病理级别关系密切。该研究发现胶质瘤相关性癫痫致痫灶组织中HMGB1 的表达与胶质瘤病理级别有关,这与Lynam 等[11]回顾性研究的癫痫发生率与组织学分级呈负相关的结论基本吻合。胶质瘤相关性癫痫常由低病理级别胶质瘤引起,低病理级别胶质瘤中包含分化良好的细胞,其可释放神经传导物质,这些传导物质可参与癫痫的发生;低病理级别胶质瘤生长时间长,其炎症反应亦可引发癫痫[12]。低病理级别胶质瘤更易引起癫痫发作,并且其致痫灶组织中HMGB1 高表达的可能原因有:①肿瘤性病变中神经元、胶质细胞的酶、蛋白质表达及免疫反应异常影响脑功能,引发癫痫。②肿瘤本身产生并刺激致痫灶产生大量HMGB1,HMGB1 与其受体(如TLR4[5]、RAGE[6]等)形成异常放电通路,形成癫痫发作的基础。研究[13-14]表明,IL-1β 和HMGB1 参与炎症反应,降低癫痫发作的阈值,通过干预炎症反应径路可减少癫痫发作频率、降低发作程度和病理损害程度。上述研究结果均提示HMGB1 对癫痫的发生、发作有重要意义。
综上所述,该研究揭示了致痫灶组织中HMGB1 表达与胶质瘤相关性癫痫临床病理因素之间的关系,对临床治疗、预后判断均有一定意义,但胶质瘤、致痫灶组织中HMGB1 促发癫痫的具体机制尚需进一步探讨。
[1]Rosati A,Tomassini A,Pollo B,et al.Epilepsy in cerebral glioma:timing of appearance and histological correlations[J].J Neurooncol,2009,93(3):395
[2]郭韬,康进生,杜亚丽,等.低级别胶质瘤继发癫痫的手术治疗[J].中华神经外科杂志,2011,5(27):554
[3]刁芳明,李花,胡湘蜀,等.癫痫患者致痫灶切除前后头皮脑电图的比较[J].实用医学杂志,2010,26(12):2083
[4]Ellerman JE,Brown CK,De Vera M,et al.Masquerader:high mobility group box-l and cancer[J].Clin Canc Res,2007,13(10):2836
[5]Maroso M,Balosso S,Ravizza T,et al.Toll-like receptor 4 and high-mobility group box-1 are involved in ictogenesisand can be targeted to reduce seizures[J].Nat Med,2010,16(4):413
[6]Zurolo E,Iyer A,Maroso M,et al.Activation of Toll-like receptor,RAGE and HMGB1 signalling in malformations of cortical development[J].Brain,2011,134(Pt 4):1015
[7]Hauptman JS,Mathern GW.Surgical treatment of epilepsy associated with cortical dysplasia:2012 update[J].Epilepsia,2012,53(Suppl 4):98
[8]Englot DJ,Han SJ,Berger MS,et al.Extent of surgical resection predicts seizure freedom in low-grade temporal lobe brain tumors[J].Neurosurgery,2012,70(4):921
[9]Zhang J,Liu C,Hou R.Knockdown of HMGB1 improves apoptosis and suppresses proliferation and invasion of glioma cells[J].Chinese Journal of Cancer Research,2014,26(6):658
[10]王新军,周少龙,付旭东,等.人脑胶质瘤组织HMGB1表达临床意义初步分析[J].中华肿瘤防治杂志,2014,21(17):1339
[11]Lynam LM,Lyons MK,Drazkowski JF,et al.Frequency of seizures in patients with newly diagnosed brain tumors:a retrospective review[J].Clin Neurol Neurosurg,2007,109(7):634
[12]You G,Sha Z,Jiang T.The pathogenesis of tumor-related epilepsy and its implications for clinical treatment[J].Seizure,2012,21(3):153
[13]Chiavegato A,Zurolo E,Losi G,et al.The inflammatory molecules IL-1β and HMGB1 can rapidly enhance focal seizure Generation in a brain slice model of temporal lobe epilepsy[J].Front Cell Neurosci,2014,11(8):155
[14]Vezzani A,Balosso S,Ravizza T.The role of cytokines in the pathophysiology of epilepsy[J].Brain Behav Immun,2008,22(6):797
