GPR30下调对子宫内膜癌细胞及裸鼠移植瘤组织PI3K/AKT信号通路的影响*
2015-12-04雷冬梅郭瑞霞刘泇希乔玉环
雷冬梅,郭瑞霞,刘泇希,葛 新,乔玉环
1)郑州大学第三附属医院病理科 郑州450052 2)郑州大学第一附属医院妇产科 郑州450052
子宫内膜癌是女性生殖系统最常见的恶性肿瘤之一,其发生与雌激素密切相关[1]。G 蛋白偶联受体30(G protein-coupled estrogen receptor 30,GPR30)是一种新型雌激素受体,可以快速与微量雌激素结合,激活细胞内第二信使,通过更快的非基因组细胞信号转录途径对雌激素发生反应[2]。作者所在的课题组前期研究[3]表明,GPR30 在子宫内膜癌细胞系HEC-1A 和Ishikawa 中均有不同程度的表达。GPR30 可能通过激活PI3K/Akt 信号通路参与肿瘤的发生发展[4-5];应用PI3K 抑制剂可以抑制子宫内膜癌细胞的增殖,促进细胞凋亡[6]。该研究观察了下调GPR30 的表达对子宫内膜癌细胞及裸鼠移植瘤组织中PI3K/Akt 信号通路的作用,探讨GPR30 用作治疗子宫内膜癌新靶点的可能。
1 材料与方法
1.1 材料 人子宫内膜癌腺癌细胞系HEC-1A 和Ishikawa 由北京大学人民医院魏丽惠教授惠赠。BALB/c 裸鼠28只(5~6 周龄,雌性,SPF 级)购自北京维通利华实验动物技术有限责任公司,饲养于河南省实验动物中心。兔抗人GPR30 多克隆抗体购自英国Abcam 公司,Akt 和磷酸化Akt(p-Akt)抗体购自美国Santa Cruz 公司,DMEM 培养基和胰蛋白酶购自北京索莱宝科技有限公司,免疫组化染色SP 法检测试剂盒购自北京中杉金桥生物技术有限公司,脂质体2000 购自Invitrogen 公司,干扰质粒购自GriGene 公司。
1.2 Ishikawa 和HEC-1A 细胞中GPR30、Akt 和p-Akt 蛋白表达部位的检测 采用免疫细胞化学SP法检测。Ishikawa 和HEC-1A 细胞加入含体积分数10%胎牛血清的DMEM 培养基,置于37℃、体积分数5%CO2中静置培养。取对数生长期的Ishikawa和HEC-1A 细胞用胰蛋白酶进行消化,以5 ×105/孔接种于6 孔板,铺满80%时终止培养,并于体积分数10%中性甲醛中固定10 min,封闭孵育30 min 后滴加一抗(GPR30、Akt 和p-Akt 抗体均按1∶1 000稀释)孵育,4℃过夜,滴加二抗,DAB 显色后苏木素复染。以PBS 代替一抗作为阴性对照。结果判定标准:细胞膜、细胞质或细胞核内存在清晰的棕黄色颗粒者判定为阳性表达。
1.3 GPR30 表达下调后Ishikawa 和HEC-1A 细胞中GPR30 及p-Akt 蛋白表达水平的变化 将pGFP-V-RS(对照)或pGFP-V-RS-GPR30(干扰)分别用脂质体2000 转染Ishikawa 和HEC-1A 细胞,传代扩大培养,加入潮霉素筛选稳定细胞株。取对数生长期的稳定转染细胞,应用蛋白印迹法检测。离心收集细胞,加入适量苯甲基磺酰氟和细胞裂解液,冰上裂解,离心后取上清。制胶、上样、电泳、转膜、洗膜。一抗均按1∶1 000 稀释;二抗按1∶5 000 稀释。最后曝光并扫描各蛋白条带,具体操作见文献[4]。以p-Akt 与Akt 蛋白条带灰度值的比值表示p-Akt 蛋白的相对表达水平;以GPR30 与β-actin 蛋白条带灰度值的比值表示GPR30 蛋白的相对表达水平。实验重复3次。
1.4 裸鼠移植瘤组织中p-Akt 蛋白表达的变化28只裸鼠适应喂养3 d,分4组,每组7只。收集对数生长期的干扰组和对照组的Ishikawa 和HEC-1A细胞,接种于BALB/c 裸鼠右背部皮下,1 周左右可触及肿瘤小结节,当移植瘤生长至直径15~20 mm时,处死裸鼠,取部分肿瘤组织,用体积分数10%中性甲醛固定、切片。通过脱蜡、抗原修复后,加入血清封闭,分别添加p-Akt 一抗(按1∶1 000 稀释)、二抗(按1∶5 000 稀释),PBS 冲洗,滴加SP,加显色剂、复染、脱水、封片。以PBS 代替一抗作为阴性对照。结果判定标准:细胞质内有清晰的棕黄色颗粒者判定为阳性表达。
1.5 统计学处理 应用SPSS 17.0 处理数据,经方差齐性检验后,行两独立样本的t 检验分析对照组和干扰组两种细胞中GPR30 和p-Akt 蛋白表达水平的差异,检验水准α=0.05。
2 结果
2.1 Ishikawa 和HEC-1A 细胞中GPR30、Akt 和p-Akt 蛋白的表达部位 免疫细胞化学SP 法结果显示,Ishikawa 和HEC-1A 细胞中GPR30、Akt、p-Akt蛋白均在细胞质表达,呈棕黄色染色。见图1。
2.2 GPR30 表达下调后Ishikawa 和HEC-1A 细胞中p-Akt 及GPR30 蛋白表达水平的变化 结果见图2,表1、2。
2.3 裸鼠移植瘤组织中p-Akt 蛋白的表达 免疫组化结果(图3)显示,接种对照组肿瘤细胞的裸鼠移植瘤组织中p-Akt 的表达强于接种干扰组肿瘤细胞的裸鼠移植瘤组织。
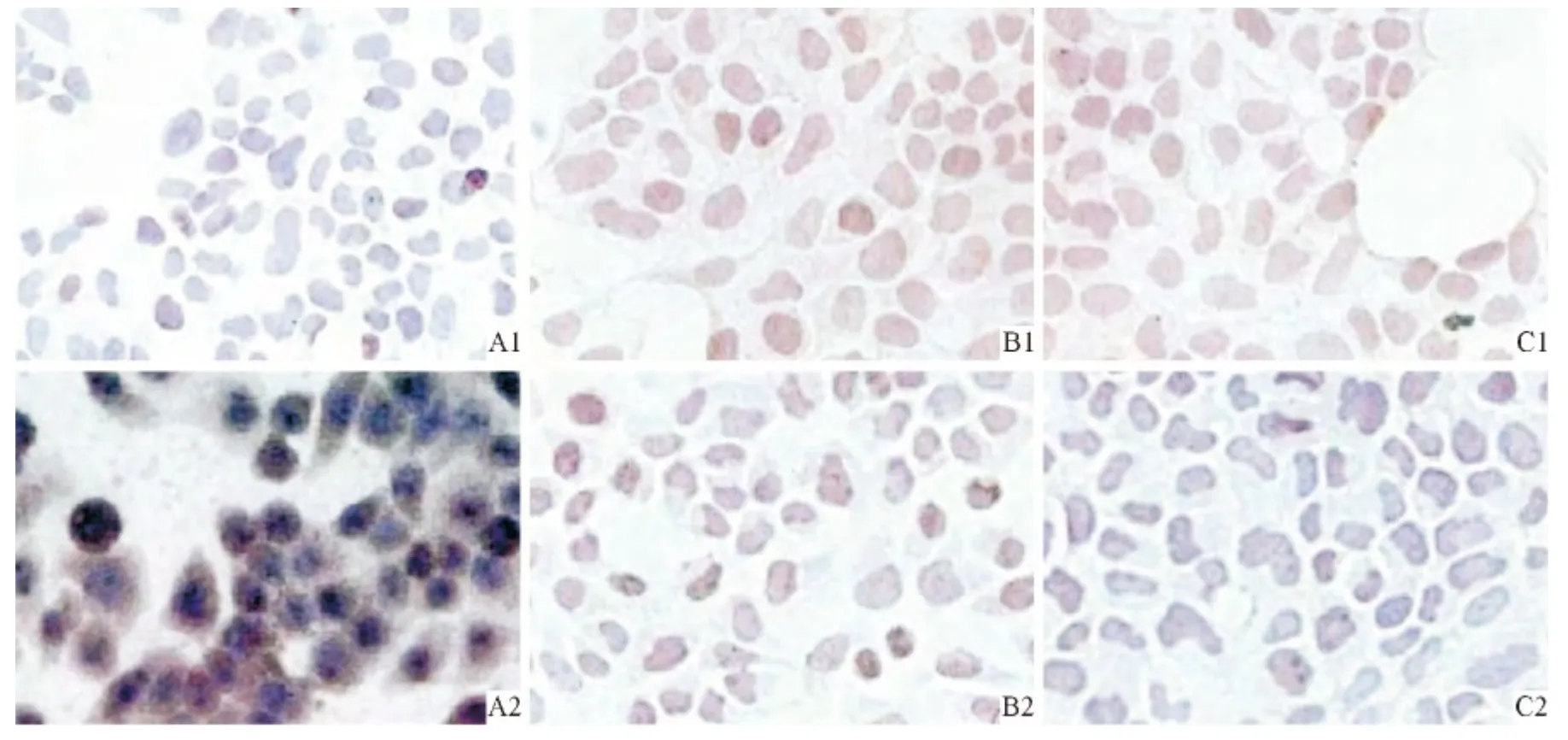
图1 HEC-1A 和Ishikawa 细胞中2种蛋白的表达(SP,×200)
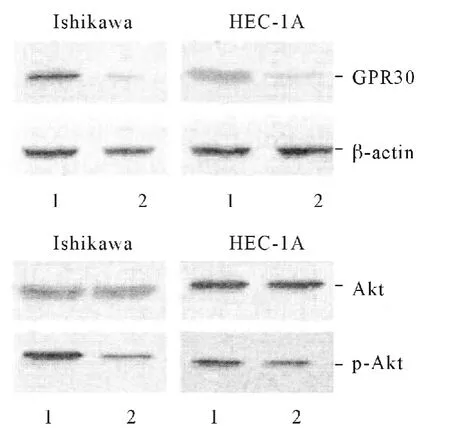
图2 Ishikawa 和HEC-1A细胞中GPR30 及p-Akt 蛋白的表达水平
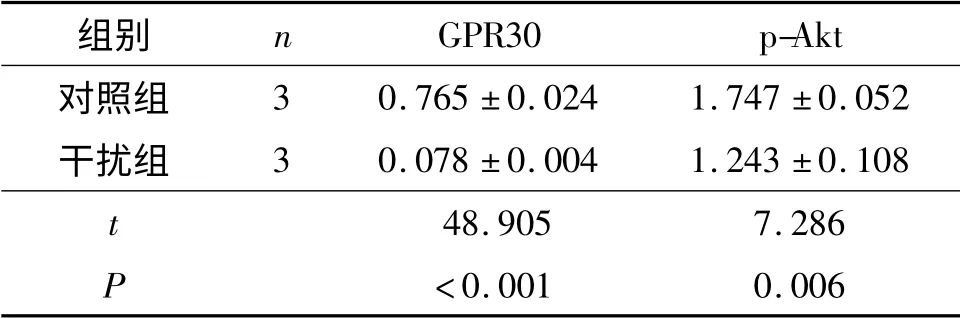
表1 Ishikawa 细胞中GPR30、p-Akt 蛋白的表达水平
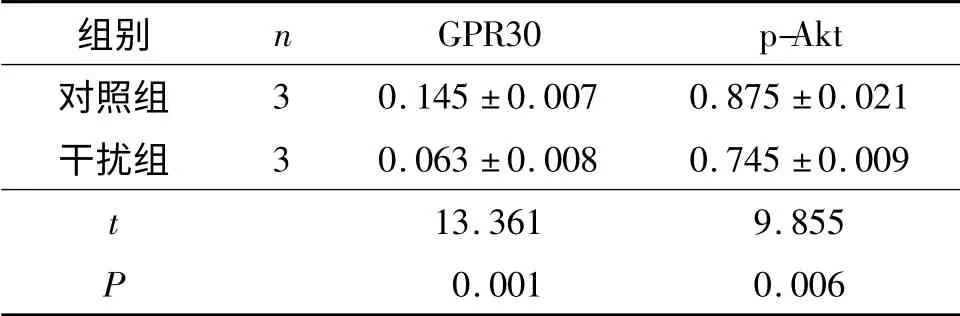
表2 HEC-1A 细胞中GPR30、p-Akt 蛋白的表达水平
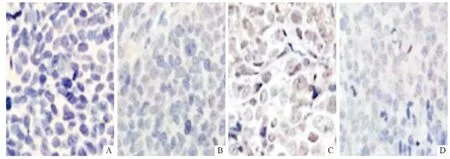
图3 裸鼠移植瘤组织中p-Akt 蛋白的表达(SP,×200)
3 讨论
GPR30 基因位于7p22.3,并广泛表达于心脏、脑、淋巴、卵巢、乳腺、子宫、肝脏、肾脏等[7]组织中。有关GPR30 的表达和定位一直存在争议,以往多认为GPR30 存在于细胞膜上。该研究结果显示,GPR30 蛋白在子宫内膜癌细胞Ishikawa 和HEC-1A中定位于胞质,这一结果与Revankar 等[8-9]用免疫组化和荧光标记等方法发现的GPR30 定位于内质网的结果一致。
Akt 是一种丝氨酸苏氨酸蛋白激酶,Akt 活化需要苏氨酸磷酸化位点和丝氨酸磷酸化位点的磷酸化[10]。Akt 异常活化对肿瘤的发生发展起着重要的作用。雌激素与其受体结合后可通过“基因转录效应”发挥作用,也可以通过快速的“非基因转录效应”发挥作用。近年来,部分学者[11]开始重视信号通路和子宫内膜癌的关系。Revankar 等[8]发现在雌激素核受体表达缺失且GPR30 表达阳性的乳癌细胞中,雌激素可通过GPR30 激活PI3K/Akt 信号通路,从而促进乳癌细胞的增殖。前期研究[12]显示,17β-E2处理后Ishikawa 和HEC-1A细胞中PI3K/Akt 的信号通路被激活。该研究通过转染下调GPR30 蛋白的表达,观察Ishikawa 和HEC-1A 细胞中GPR30 和p-Akt 蛋白表达的变化。结果显示,p-Akt 表达下降,说明两种细胞PI3K/Akt 信号通路的活化均受到抑制。此外,接种干扰组两种肿瘤细胞的裸鼠移植瘤组织中p-Akt 蛋白的表达均较接种对照组肿瘤细胞的裸鼠移植瘤组织减弱,与体外细胞实验结果一致,提示下调GPR30 蛋白的表达可能会抑制PI3K/Akt 信号通路的活化。
综上所述,下调GPR30 的表达可能抑制了PI3K/Akt 信号通路的活化,为GPR30 成为治疗子宫内膜癌的新靶点提供了参考和依据。
[1]郭瑞霞,王建六,赵丹,等.子宫内膜癌细胞系Ishikawa和HEC-1A 细胞雌激素受体表达[J].中国妇产科临床杂志,2005,6(4):272
[2]张燕彩,郭瑞霞,葛新,等.GPER 在雌激素激活的子宫内膜癌细胞内PI3K/Akt 信号通路中的作用[J].中华妇产科杂志,2012,47(4):292
[3]郭瑞霞,郭会敏,苑中甫,等.G 蛋白偶联受体30 和磷酸化AKT 在子宫内膜腺癌中表达及意义[J].现代妇产科进展,2009,18(12):881
[4]葛新.G 蛋白偶联雌激素受体介导子宫内膜癌细胞雌激素的非转录效应的研究[D].郑州:郑州大学,2013.
[5]张燕彩.GPER 在子宫内膜癌细胞雌激素激活PI3K/Akt信号传导通路中的作用[D].郑州:郑州大学,2012.
[6]郭瑞霞,乔玉环,魏丽惠,等.磷脂酰肌醇3 激酶抑制剂对17β-雌二醇作用下Ishikawa、HEC-1A 细胞增殖和凋亡的影响[J].郑州大学学报:医学版,2007,42(2):322
[7]Li Y,Birnbaumer L,Teng CT.Regulation of ERRalpha gene expression by estrogen receptor agonists and antagonists in SKBR3 breast cancer cells:differential molecular mechanisms mediated by g protein-coupled receptor GPR30/GPER-1[J].Mol Endocrinol,2010,24(5):969
[8]Revankar CM,Cimino DF,Sklar LA,et al.A transmembrane intracellular estrogen receptor mediates rapid cell signaling[J].Science,2005,307(5715):1625
[9]Revankar CM,Mitchell HD,Field AS,et al.Synthetic estrogen derivatives demonstrate the functionality of intracellular GPR30[J].ACS Chem Biol,2007,2(8):536
[10]Cantley LC.The phosphoinositide 3-kinase pathway[J].Science,2002,296(5573):1655
[11]乔玉环,侯艺芳,郭瑞霞,等.人子宫内膜癌组织中磷酸化细胞外信号调节激酶的检测[J].郑州大学学报:医学版,2008,43(2):273
[12]Guo RX,Wei LH,Tu Z,et al.17 beta-estradiol activates PI3K/Akt signaling pathway by estrogen receptor(ER)-dependent and ER-independent mechanisms in endometrial cancer cells[J].J Steroid Biochem Mol Biol,2006,9(1):9
