盐酸奥洛他定片处方及制备工艺研究
2015-12-03
(海南省药品审核认证管理中心 海南海口 570216)
盐酸奥洛他定是新一代强效、安全的抗过敏药,由日本协和发酵公司开发,于1997年和2001年分别在美国和日本上市,具有抑制组胺释放及选择性拮抗H1受体的双重作用,且无H1受体拮抗剂类抗过敏药常见的中枢神经系统抑制及心脏毒副作用,临床多用于治疗过敏性鼻炎、荨麻疹、皮炎等,是新一代的抗过敏首选药。本文主要对盐酸奥洛他定的制剂片剂进行处方工艺研究。
1 仪器与试药
1.1 仪器
LC-20A高效液相色谱仪(日本岛津);PD211D电子天平(赛多利斯科学仪器);CJY-300B脆碎度检查仪(上海黄海药检仪器厂);ZBS-8G型智能崩解仪(天津市天大天发科技有限公司);旋转式压片机(上海天祥健台制药机械有限公司);YD-1硬度仪(天津市光学仪器厂)
1.2 试药
盐酸奥洛他定(武邑慈航药业有限公司)、微晶纤维素(湖州展望药业有限公司)、乳糖(深圳市优普惠药品有限公司)、交联羧甲基纤维素钠(上海昌为医药辅料技术有限公司)、硬脂酸镁(湖州展望药业有限公司)、包衣粉(天津爱勒易医药材料有限公司)
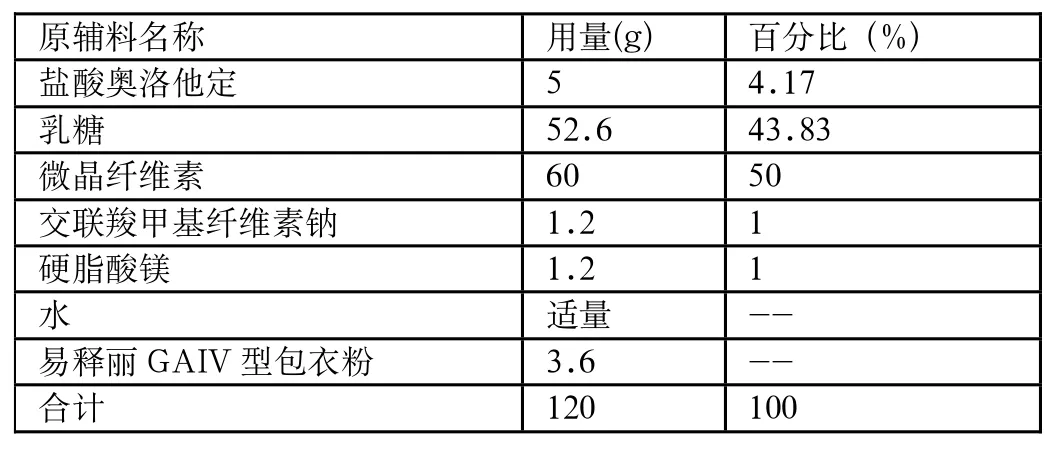
原辅料名称 用量(g) 百分比(%)盐酸奥洛他定 5 4.17乳糖 52.6 43.83微晶纤维素 60 50交联羧甲基纤维素钠 1.2 1硬脂酸镁 1.2 1水 适量 --易释丽GAIV型包衣粉 3.6 --合计 120 100

表1 处方初试实验结果表

表2 崩解剂用量考察试验
2 方法与结果
2.1 处方初试
盐酸奥洛他定片于2001年3月在日本上市(商品名:Allelock;规格:2.5mg,5mg),参照日本IF文件[1]及中国上市说明书[2],上市的盐酸奥洛他定片(规格5mg)的处方中辅料的组成为:微晶纤维素、乳糖、交联羧甲基纤维素钠、硬脂酸镁和包衣粉(氧化铁黄,巴西棕榈蜡,氧化钛,氧化铁红,羟丙甲纤维素2901,聚乙烯醇,聚乙二醇6000)。参照处方信息中所列的辅料,依据各辅料的常用量(微晶纤维素用量为20%-90%,乳糖可达85%,交联羧甲基纤维素钠用量可达5%,硬脂酸镁用量0.25%-5%,包衣粉增重约3%),初拟小试处方。
2.1.1 处方:(1000片)
2.1.2 制备工艺
原辅料过100目筛备用,按处方量称取各原辅料过40目筛混合3次,加入纯化水适量制软材,置20目筛制粒,60℃干燥,烘干,用20目整粒,压片,包衣即得。

表3 崩解剂用量考察试验结果

表4 硬度考察试验
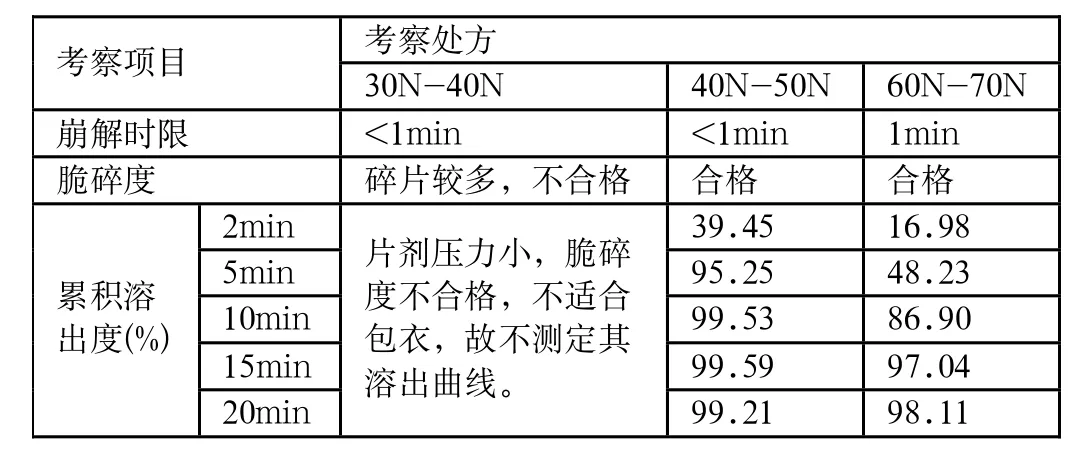
表5 硬度考察试验结果
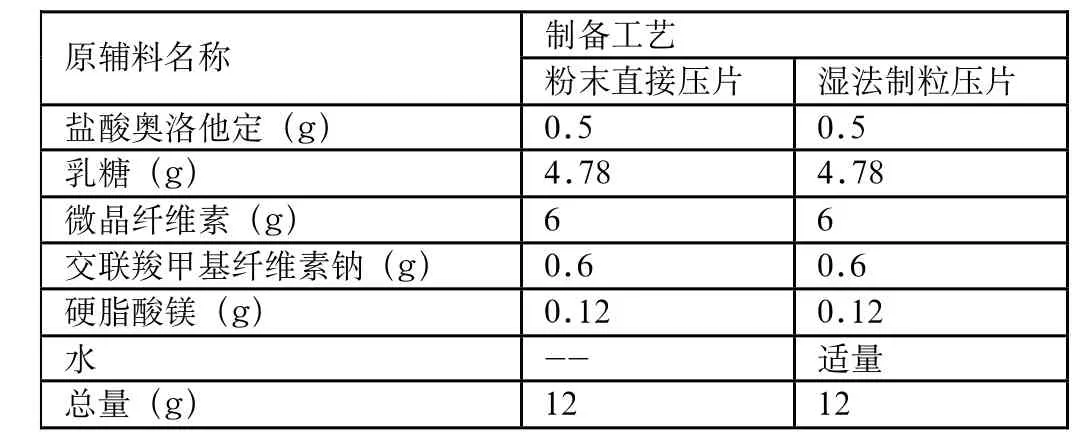
表6 制备工艺考察试验

表7 制备工艺考察试验结果
2.1.3 检验指标:外观性状,含量,有关物质,溶出度。试验结果见表1。
由试验结果可知:本品选用纯化水作润湿剂,制粒效果较好,确定本品的润湿剂为纯化水。经对处方初试实验样品进行检测,溶出过程中,片剂溶散较慢,除溶出度和崩解时限有差异外,其余各项指标均符合片剂要求。因此需要对辅料的用量进行调整,使得各项下检查与原研对照品保持基本一致。
2.2 崩解剂用量考察
由于崩解时限和溶出度曲线与上市品有很大的区别,需要调整处方中崩解剂的用量。初试实验处方中崩解剂用量为1%,溶出时片剂溶散较慢,故加大崩解剂用量,分别调整崩解剂用量至3%、5%进行筛选,片剂硬度固定为40N-50N。处方量为100片。实验结果见表2、3。
由实验结果可知,当崩解剂的用量达到5%时,溶出曲线的溶出趋势与对照药品基本一致,并且溶出度也符合要求。因此,将崩解剂的用量定为5%。
2.3 片剂硬度的筛选
在实验过程中发现,压片时不同压力压制的片剂的硬度也不同,硬度对于片剂的崩解和溶出也有较大的影响,分别以不同的压力压制一定量的片,测定硬度后,以崩解时限、脆碎度和溶出度为指标进行筛选。实验结果见表4、5。
由实验结果可知,硬度的大小直接影响到片剂的崩解和溶出速度。主要是由所选用的崩解剂的崩解机制不同引起的。交联羧甲基纤维素钠以湿法制粒加入,其崩解机制是溶胀,硬度的大小决定崩解剂溶胀的速度。实验表明,在此处方里,片剂硬度在40N-50N为最佳压力,其脆碎度适合包衣,并且溶出度也与上市品基本一致。
2.4 粉末直接压片和湿法制粒工艺考察
分析原研处方中各辅料作用,采用粉末直接压片也可制备出片剂。分别采用粉末直压和湿法制粒两种不同工艺进行压片,以压制过程中流动性、可压性和片剂的崩解时限、溶出度为指标进行考察。实验结果见表6、7
由实验结果可知,两种制备工艺相比较,粉末直接压片法的流动性和可压性均尚可,但相比较而言,湿法制粒后压片颗粒的流动性更好,更易于压制成片。崩解时限和溶出度实验表明湿法制粒制得的片剂与上市品更为接近,同时因为此片剂的主药成分与水没有特殊的反应,并且粉末直接压片法对压片机的要求比较高,所以选择以水作为润湿剂的湿法制粒工艺来制备片剂。

表8 混合工艺考察试验

表9 混合工艺考察试验结果
?
2.5 主药与辅料混合工艺的考察
盐酸奥洛他定片的规格为5mg,片重120mg,属于小规格的片剂。在制备过程中,采用何种方式保证含量的均匀度是片剂制备的关键。小试中采用等量递加法和普通的混匀方式进行混合,湿法制粒后压片,以含量均匀度为指标来进行考察。实验结果见表8、9。
(1)等量递加方式:称取处方量主辅料,将主药与交联羧甲基纤维素钠混合后,采用等量递加的方式与其余主药相混合,以水为润湿剂制粒,烘干,整粒,压片。
(2)普通混合方式:称取处方量的主辅料,过40目筛3次使之混匀,以水为润湿剂制粒,烘干,整粒,压片。
由实验结果可知,虽然两种混合工艺都能满足含量均匀度的要求,但是等量递加法混合方式的含量标准偏差相对较小,能更好的满足小规格药物对于含量均匀度的要求,因此选用等量递加法来混合。
2.6 结果
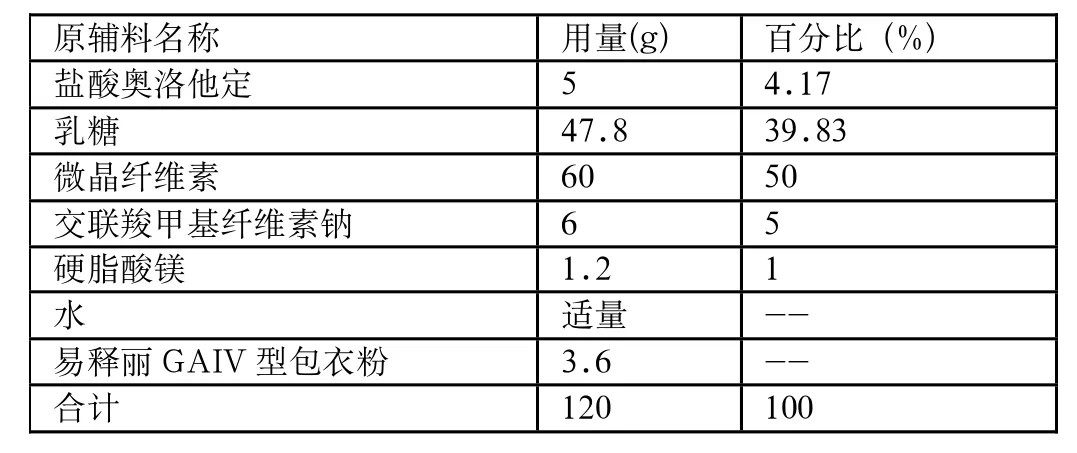
2.6.1 最终处方确定为:(1000片)
2.6.2 最终确定制备工艺为:
(1)原辅料分别过100目筛;
(2)称取处方量的原辅料,以等量递加法将原辅料混合均匀;混匀后,加入纯化水制软材,20目筛制粒;
(3)60℃干燥,烘干;20目整粒;
(4)加入处方量的硬脂酸镁;混匀后压片,压力控制在40N-50N;
(5)、包衣。
3 讨论
(1)根据查询到的处方信息,选取乳糖、微晶纤维素、交联羧甲基纤维素钠、硬脂酸镁和包衣粉分别与主药以一定的比例进行相容性研究,考察项目为性状,含量和有关物质的变化。采用HPLC法测定,测定方法参考盐酸奥洛他定片进口药品注册标准(标准号JX20090318)[3],对原料药、原料药和乳糖(1:5)、原料药和微晶纤维素(1:5)、原料药和交联羧甲基纤维素钠(20:1)、原料药和硬脂酸镁、包衣粉(20:0.5:0.5)5组样品进行相容性试验。结果表明,放置10天后,光照(4500LX)样品稳定;高温(60℃)、高湿(RH75%)样品增失重变化不明显且含量、样品性状、有关物质无明显变化,说明盐酸奥洛他定与研究中所用的辅料相容性均较好。并且原料药对湿热稳定,可以选用湿法制粒工艺进行片剂制备。
(2)处方初试实验过程中将原料药过100目筛,所有原料药几乎全部通过,过筛率达到99.5%。并且原料药盐酸奥洛他定的生物药剂学分类(BCS分类)属于第一类,高溶解性高渗透性药物,表明能够在胃肠道快速溶出,口服吸收好。所以原料药粒度对制剂溶出的影响并不明显,故不予考察不同粒径的原料药对此制剂的影响。
[2]盐酸奥洛他定片说明书.
[3]国家食品药品监督管理局,进口药品注册标准,盐酸奥洛他定片,标准号:JX20090318.
