盐碱胁迫下玄参幼苗的抗性生理响应研究Δ
2015-12-03付英杰曲晓欢李艳芝王建安济宁医学院药学院山东日照276826
付英杰,曲晓欢,李艳芝,王建安(济宁医学院药学院,山东日照276826)
玄参为玄参科植物玄参Scrophularia ningpoensisHemsl.的块根,主要成分为环烯醚萜苷类、挥发油、甾醇、多糖等成分,具有清热凉血、泻火解毒等功效,为传统“浙八味”中药之一[1]。玄参喜温暖湿润气候,耐寒,对土壤品质要求较低,通常选择肥沃、排水良好的砂质壤土及富含腐殖质的土壤栽培;原产于浙江笕桥,现多为栽培品,主产于浙江、山东、陕西[2]。笔者在黄河三角洲考察时发现,玄参能够在盐碱地中生存,因此考虑玄参有可能成为盐碱地新栽培药用品种。目前我国拥有6.7×106hm2的次生盐碱地,并且还存在约有1.7×107hm2的潜在盐碱土[3],其开发利用受到高度重视。目前治理盐碱地较有优势的方法是种植耐盐植物,可抑制土壤返盐,增加土壤有机质以改善土壤结构。而种植耐盐植物首先要考察植物耐盐生理,其次对植物耐盐能力的提高进行研究[4],从而确定该植物的耐盐碱特性,并能够初步探究其耐盐碱机制。
目前玄参栽培方面的研究多集中在肥料种类、施肥技术、管理技术、栽培类型及遗传性等[5-6],而尚未见在盐碱化土壤中种植玄参的研究性文献。因此,笔者拟通过对盐碱胁迫下玄参幼苗的生长指标及抗性生理响应机制进行系统研究,以探讨抗氧化防御和渗透调节机制在玄参幼苗对盐碱胁迫适应中的作用。
1 材料
1.1 仪器
UV-2450型紫外分光光度计(日本岛津公司);LD4-2A型低速离心机(北京医用离心机厂);HWSY11-K2C型恒温水浴锅(北京长风仪器仪表公司);DL-PNT3000土壤盐碱度(活度)检测仪(德国STEPS公司);DDL-9604型电导率仪(北京格乐普高新技术有限公司)。
1.2 幼苗与试剂
玄参幼苗产自浙江省磐安县;硫酸钛(CP,批号:20131213,纯度:98%)、核黄素(批号:F20080123,纯度:98%)均购自国药集团化学试剂有限公司;脯氨酸(Pro,中国食品药品检定研究院,批号:140677-201308,纯度:98%);2-硫代巴比妥酸(批号:T108505,纯度:98%)、甲硫氨酸(批号:M104886,纯度:99%)、愈创木酚(批号:G112735,纯度:99%)均购自上海晶纯生化科技股份有限公司;牛血清白蛋白、各指标测定试剂盒均购自上海生工生物工程有限公司;其余试剂均为分析纯。
2 方法
2.1 幼苗的栽培
取玄参幼苗110株,栽培于塑料花盆(上口径30 cm,高25 cm,具底盘)中。基础土壤选取砂质土(土壤养分测定为有机质14 g/kg、全氮0.95 g/kg、有效磷17 mg/kg、速效钾135 mg/kg,土壤肥力为中等稍低)。缓苗期浇水、正常管理,每隔4 d浇灌100 ml含大量元素的Hoagland营养液[7]。叶片长至5片时,选取10株长势相同的为一组,分别以NaCl、NaHCO3和蒸馏水浇灌(见表1)。每隔4 d浇灌1次,并采用土壤盐碱度检测仪及pH计测定土壤平均盐碱度,使其维持在表1含盐量(变动幅度±10%)、pH(变动幅度±0.1)条件,同时测定相同浓度下储备土壤的碱化度。幼苗置于光照培养箱中,控制温度(20±2)℃,光暗周期13 h/11 h,光照强度2000 lx,培养时间16 d(表中J1~J5、Y1~Y5为碱、盐不同浓度,CK为空白对照,简称对照)。
2.2 指标的测定
测定玄参幼苗生长指标(株高、干质量、鲜质量)。参考文献[8-17]测定超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性与叶绿素(Chl)、过氧化氢(H2O2)、Pro、可溶性糖(SS)、可溶性蛋白(SP)、丙二醛(MDA)含量,以及膜透性(RMP)。
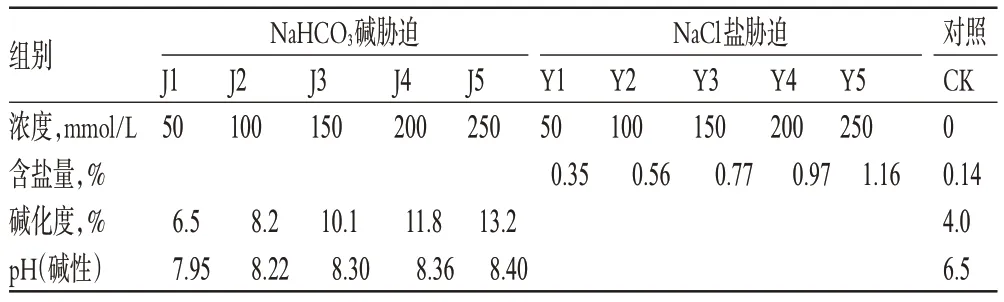
表1 盐碱胁迫条件及分组Tab 1 Conditions of saline-alkali stress and grouping
2.3 统计学方法
采用SPSS 13.0软件处理试验数据。各组数据均为计量资料,弃去最小、最大值后数据以±s表示,采用LSD检验进行分析。P<0.05为差异有统计学意义。
3 结果
3.1 各组玄参幼苗生长指标测定结果
本研究显示,随盐碱浓度升高,玄参幼苗株高逐渐降低。当碱胁迫超过150 mmol/L后,株高出现较大幅度降低;当盐胁迫超过50 mmol/L后,株高开始降低。在碱胁迫超过150 mmol/L、盐胁迫超过50 mmol/L后,玄参幼苗鲜质量明显降低;在碱胁迫超过150 mmol/L、盐胁迫超过100 mmol/L后,玄参幼苗干质量明显降低。结果表明,玄参幼苗具有一定的耐盐碱性,但两者抗性有区别,其耐碱性强于耐盐性。各组玄参幼苗生长指标测定结果见图1。
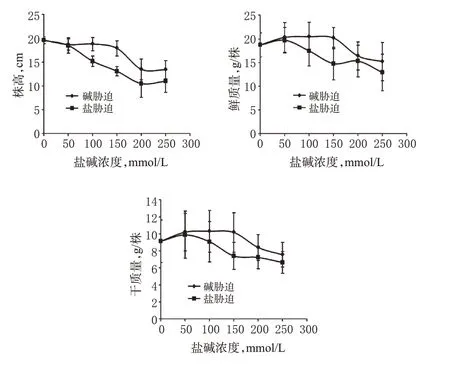
图1 各组玄参幼苗生长指标测定结果Fig 1 Determination results of growth indexes of S.ning poensis seedlings in all groups
3.2 各组玄参幼苗Chl含量测定结果
非盐生植物受盐胁迫后,其光合作用直接受到抑制,Chl解体,且合成受抑制,最终不能通过光合作用来获取植物生长所用的能量而导致生长受抑制;而盐生植物则不同,一定浓度的盐反而可以促进光合作用,但当盐浓度超过阈值后也会发生抑制[18]。本研究显示,当碱胁迫超过150 mmol/L、盐胁迫超过50 mmol/L时,玄参幼苗Chl含量减少,叶片颜色黄化。该结果印证了生长指标测定的结论,同时推断玄参幼苗在低浓度盐碱胁迫下光合作用反而可能被促进。各组玄参幼苗Chl含量测定结果见图2。
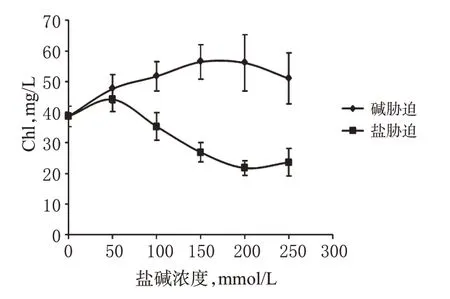
图2 各组玄参幼苗Chl含量测定结果Fig 2 Determination results of Chl contents of S.ningpoen sis seedlings in all groups
3.3 各组玄参幼苗酶促抗氧化体系生理指标测定结果
本研究显示,当盐胁迫为50 mmol/L、碱胁迫为150 mmol/L时,玄参幼苗SOD、POD活性最强;当盐胁迫为150 mmol/L、碱胁迫为50 mmol/L时,CAT活性最强;随盐碱浓度升高,H2O2、MDA含量逐渐增加;随盐碱浓度增加,RMP水平升高,即膜稳定性逐渐降低。结果表明,盐碱胁迫均造成了细胞质膜的损伤,盐碱能刺激植物迅速产生抗氧化保护酶对抗活性氧。CAT、POD、SOD依次为低、中、高浓度碱胁迫的主要保护酶,POD、SOD、CAT依次为低、低、中浓度盐胁迫的主要保护酶,且盐胁迫中的H2O2、MDA含量及细胞质膜受损程度明显高于碱胁迫,因此可以认为玄参幼苗的耐碱性较耐盐性强,这也与Chl测定结果相吻合。值得指出的是,尽管在150 mmol/L盐浓度时CAT活性较高,植株却普遍出现萎蔫、黄化、倒伏等现象。综合考虑,玄参幼苗耐碱性仍强于耐盐性。各组玄参幼苗酶促抗氧化体系生理指标测定结果见图3。
3.4 各组玄参幼苗渗透调节生理指标测定结果
植物在逆境中,Pro作为蛋白分解产物,具有渗透调节、稳定大分子、降低氨毒性、作为能量库等多重作用;SS具有渗透调节、作为碳架及能量库的多重作用,可稳定细胞膜及原生质,一般情况下,随SS累积,植物抗逆性逐渐增加。本研究显示,当盐碱浓度大于100 mmol/L时,Pro含量停止累积,但碱浓度下Pro含量明显高于盐浓度下;随盐碱浓度升高,SP含量逐渐减少;当盐浓度大于100 mmol/L、碱浓度大于150 mmol/L时,SS量停止积累,但两胁迫组玄参幼苗SS含量及趋势差别不大,推测玄参幼苗耐碱性强的原因之一是Pro的大量积累起到了缓冲的作用。各组玄参幼苗渗透调节生理指标测定结果见图4。
4 讨论
在盐碱条件下,植物一般可通过渗透调节、抗氧化能力的提升、营养元素平衡、改变代谢类型、维护膜的完整性等方法来减轻伤害,其中前2种方法存在于大多数耐盐碱植物中:(1)渗透调节,如可溶性糖、脯氨酸、甜菜碱、无机离子、逆境蛋白等物质浓度的改变。其中脯氨酸可形成类似亲水胶体的聚合物,以维持渗透平衡,并保持细胞膜的稳定性;而可溶性糖则能在细胞中积累以维持细胞膨压;逆境蛋白如胚胎发育晚期丰富蛋白(LEA蛋白)的产生是水分胁迫的一种保护反应;(2)抗氧化物质及抗氧化酶的产生。由于盐碱胁迫时植物体产生的大量活性氧极易造成组织氧化损伤,因此植物自身能够产生清除活性氧的酶和抗氧化物。抗氧化酶主要包括CAT、POD、SOD、谷胱甘肽还原酶(GR)、谷胱甘肽过氧化物酶(GP)等[19]。同时,盐碱胁迫会引起植物的水分紊乱、生长限制、气孔关闭、CO2固化率降低等[20]。这些植物生长的促进或抑制,与光合作用直接相关,如对光能吸收与转化的影响和对光合电子传递、碳同化的影响,因此,叶绿素含量变化也间接反映了植物的抗逆性。
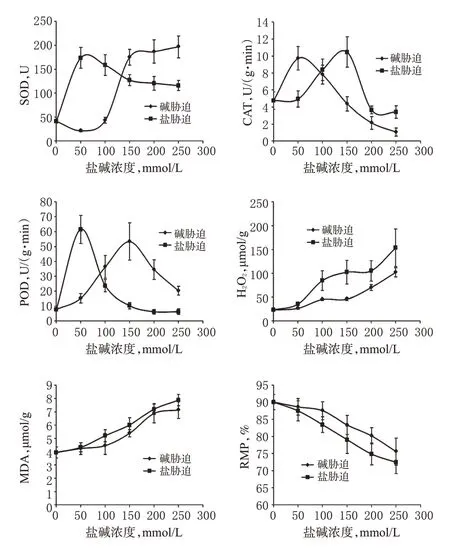
图3 各组玄参幼苗酶促抗氧化体系生理指标测定结果Fig 3 Determination results of physiological indexes of enzymatic antioxidative systems of S.ningpoensis seedlings in all groups
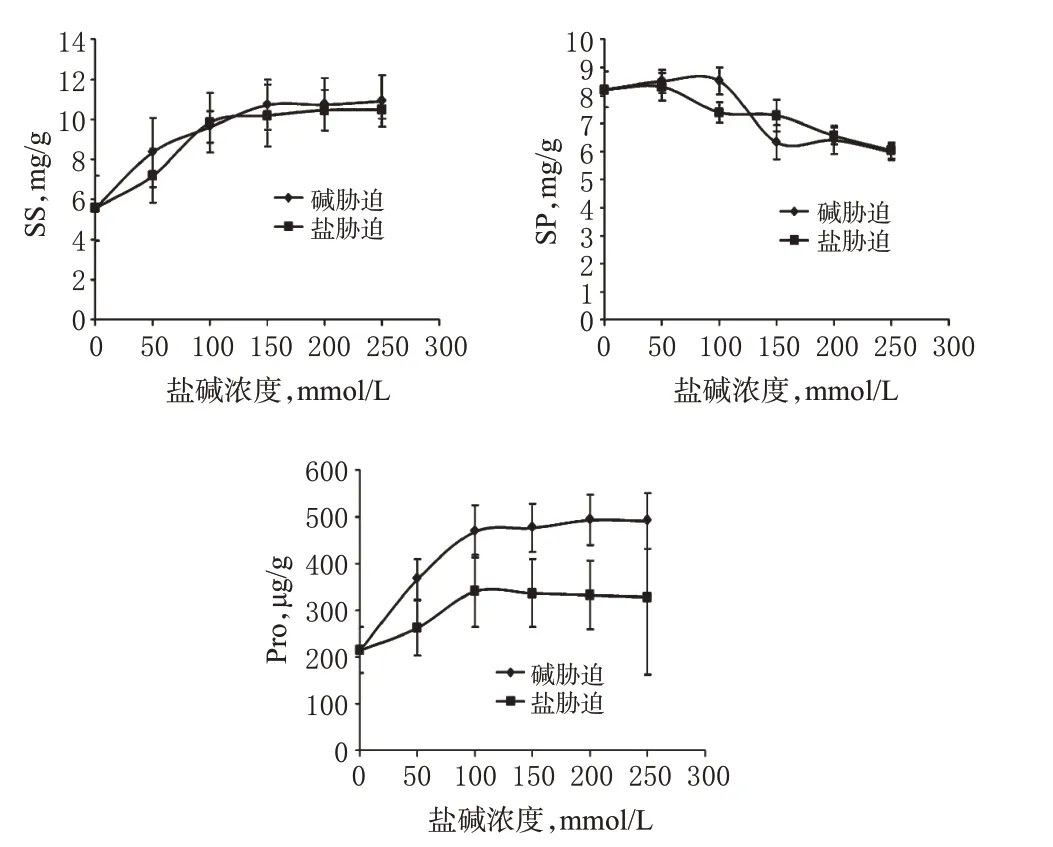
图4 各组玄参幼苗渗透调节生理指标测定结果Fig 4 Determination results of physiological indexes of osmotic regulation of S.ningpoensis seedlings in all groups
本研究结果表明,盐、碱胁迫对玄参幼苗的生长有不同程度的影响,一定浓度范围中其幼苗的株高、干质量及鲜质量均有不同程度的下降,并伴随着细胞质膜透性的降低以及MDA、H2O2的产生,其结果证明了一定浓度的盐、碱对玄参幼苗的细胞具有毒害作用。在此环境下,玄参幼苗通过改变SOD、CAT、POD等保护酶活性而清除活性氧,以及增加Pro及SS等渗透调节剂的途径来保持抗渗透胁迫能力,从而减少伤害。值得提出的是,一般盐碱胁迫情况下,植物光合作用通常下降,但本文发现玄参幼苗在一定浓度的碱胁迫下反而出现了光合作用增强的现象,可能与碱抗性有一定关系,有待深入研究。
通过研究,笔者还发现玄参幼苗对盐、碱的胁迫具有不同程度的耐性:可耐受相当于150 mmol/L NaHCO3浓度(pH≈8.3)的碱化土壤或50 mmol/L NaCl浓度(含盐量≈0.35%)的盐化土壤。因此在今后的推广种植中,可以适当考虑选择中碱度或低盐度的土壤。这为今后其他中药的种植及开发适合盐碱地种植的中药品种提供了相应的理论依据。
本研究旨在考察玄参对盐碱的抗性,为耐盐碱玄参品种选育研究提供参考,因此选用幼苗作为研究对象。而成熟玄参的有效物质含量,留作下一步考察研究。
[1]高学敏.中药学[M].2版.北京:中国中医药出版社,2007:145.
[2]李杰,詹琤琤,段时振,等.中药玄参研究概况[J].湖北中医杂志,2013,35(8):73.
[3]马鸿翔,张大栋.沿海滩涂发展能源植物的潜力分析[J].中国农学通报,2006,22(12):445.
[4]刘建红.盐碱地开发治理研究进展[J].山西农业科学,2008,36(12):51.
[5]胡凤莲.玄参的栽培与管理技术[J].陕西农业科学,2009(4):210.
[6]陈大霞,李隆云,彭锐,等.玄参3种栽培类型遗传关系和遗传多样性的SRAP研究[J].中国中药杂志,2009,34(2):138.
[7]周霞,黄春琼,张绪元,等.狗牙根耐盐性材料初步筛选[J].热带农业科学,2010,30(4):20.
[8]刘秀丽,宋平,孙成明.植物叶绿素测定方法的再探讨[J].江苏农业研究,1999,20(3):46.
[9]自俊青,邓希贤,金虬,等.氮蓝四唑光照法实验操作的改进及效果[J].北京师范大学学报:自然科学版,1998,34(1):101.
[10]谷建田,范双喜,宋学锋,等.番茄种子衰老过程中过氧化氢酶(CAT)活性变化[J].华北农学报,1998,13(2):112.
[11]陶萌春,赖钟雄,潘良镇.中国水仙花芽分化期POD活性的变化[J].福建农业大学学报,1998,27(3):257.
[12]刘俊,吕波,徐朗莱.植物叶片中过氧化氢含量测定方法的改进[J].生物化学与生物物理进展,2000,27(5):548.
[13]史玉炜,王燕凌,李文兵,等.水分胁迫对刚毛柽柳可溶性蛋白、可溶性糖和脯氨酸含量变化的影响[J].新疆农业大学学报,2007,30(2):5.
[14]李晓旭,李家政.优化蒽酮比色法测定甜玉米中可溶性糖的含量[J].保鲜与加工,2013,13(4):24.
[15]邓丽莉,潘晓倩,生吉萍,等.考马斯亮蓝法测定苹果组织微量可溶性蛋白含量的条件优化[J].食品科学,2012,33(24):185.
[16]尤佳,王文瑞,卢金,等.盐胁迫对盐生植物黄花补血草种子萌发和幼苗生长的影响[J].生态学报,2012,32(12):3 825.
[17]刘铁铮,赵习平.电导法测定杏叶片细胞质膜相对透性的研究[J].河北农业科学,2008,12(1):33.
[18]郭菊梅,陈红刚,曹瑞,等.氯化钠浓度对黄芩幼苗生长情况及生理指标的影响[J].中国药房,2014,25(17):4 497.
[19]韩燕燕,鲁艳.吕光辉.植物耐盐的生理机制及基因工程新进展[J].生物技术通报,2007,27(14):10.
[20]周丽,郎多勇,张文晋,等.NaCl胁迫对银柴胡生长及生理生化特性的影响[J].中草药,2014,45(19):2 829.
