他克莫司胶囊在4种溶出介质中的体外溶出特性研究
2015-05-21马苗锐张莉吴谧周立明张丽霞华北制药集团新药研究开发有限责任公司微生物药物国家工程研究中心河北省工业微生物代谢工程技术研究中心石家庄050000
马苗锐,张莉,吴谧,周立明,张丽霞(华北制药集团新药研究开发有限责任公司/微生物药物国家工程研究中心/河北省工业微生物代谢工程技术研究中心,石家庄 050000)
他克莫司是一种具有强免疫抑制活性的大环内酯类抗生素,临床上应用于器官移植术后的排斥反应和自身免疫性疾病。与同类药物相比,他克莫司具有较强的免疫抑制作用和较低的不良反应,在国内外已成为器官移植免疫抑制疗法的一线药物。他克莫司几乎不溶于水,水中的溶解度约为1~2µg/ml[1],平均口服生物利用度约为25%[2],制剂中往往应用各种技术以提高其溶出度和生物利用度。
他克莫司胶囊首先由日本藤泽制药公司研发成功,商品名为普乐可复(Prograf),1995年在美国上市,1998年进入中国市场。他克莫司胶囊属于生物药剂学分类系统(BCS)中的第Ⅱ类药品,即低溶解性、高渗透性药品。药物的溶出直接影响其在体内的吸收和利用[3],溶出度试验的深入研究和溶出曲线的精确、客观绘制,既可初步为体内生物利用度研究提供参考,也可以揭示各制剂工艺的差别和内在品质的优劣[4]。故本研究以国外上市的原研他克莫司胶囊为参比制剂,考察了自研他克莫司胶囊在不同溶出介质中的溶出情况,并采用相似因子(f2)法评价了其内在质量。
1 材料
1.1 仪器
2690型高效液相色谱(HPLC)仪、2487型紫外检测器(美国Waters公司);RC-806型溶出试验仪、CJL-3型沉降篮(天津市天大天发科技有限公司);TGL-20B型离心机(上海安亭科学仪器厂)。
1.2 药品与试剂
原研他克莫司胶囊[安斯泰来制药(中国)有限公司,批号:1D5579A,规格:每粒1mg];自研他克莫司胶囊(华药集团新药研究开发有限责任公司,批号:130501,规格:每粒1mg);他克莫司对照品(华药集团新药研究开发有限责任公司,批号:091229,纯度:99.8%);羟丙基纤维素(HPC,日本曹达株式会社);乙腈、甲醇为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液的制备 精密称取他克莫司对照品10.14mg,置于50ml量瓶中,加乙腈溶解并定容至刻度;精密量取上述溶液0.7ml,置于50ml量瓶中,加乙腈溶解并定容至刻度,摇匀,作为对照品贮备液。精密量取对照品贮备液20ml,加入溶出介质50ml,混匀,即得相应的对照品溶液。
2.1.2 供试品溶液的制备 将自研他克莫司胶囊置于相应溶出介质中后,分别于0、15、30、45、60、90min时取10ml溶出液(同时补充相应同温新鲜介质10ml),以离心半径为10 cm、3000 r/min离心10min,取上清液2.0ml,加入溶出介质5.0ml,混匀,即得相应的供试品溶液。
2.2 色谱条件与系统适用性试验
色谱柱:Hypersil C18(150mm×4.6mm;5 μm);流动相:乙腈-甲醇-水-6%磷酸(46∶18∶36∶0.1,V/V/V/V,pH约3.3),流速:1ml/min;检测波长:210nm;柱温:50 ℃;进样量:400 µl;取对照品溶液[溶出介质为pH 4.5磷酸溶液(含0.005%HPC),简称B]和供试品溶液(溶出介质B,90min时取样,按“2.1.2”项下方法制得)分别按上述色谱条件进样,记录色谱图。结果,理论板数按他克莫司峰计算不低于3000,他克莫司与他克莫司异构体Ⅱ的分离度大于1.5,他克莫司峰拖尾因子小于1.5,表明该方法适用性较好。色谱见图1。

图1 高效液相色谱图a.对照品溶液;b.供试品溶液;1.他克莫司异构体Ⅱ;2.他克莫司Fig 1 HPLC chromatogramsa.reference solution;b.test solution;1.tacrolimus isomerⅡ;2.tacrolimus
2.3 溶出介质及溶出度测定方法
溶出度测定按照2010年版《中国药典》(二部)附录ⅩC第二法(桨法)进行。参考《美国药典》[5],分别以pH 1.0盐酸溶液(含0.005%HPC,简称A)、B、pH 6.8磷酸盐缓冲液(含0.005%HPC,简称C)和水(含0.005%HPC,简称D)为溶出介质,体积为 900ml,温度为(37±0.5)℃,转速为 50 r/min。以HPLC法为他克莫司含量的检测方法。
2.4 滤膜吸附考察
取自研他克莫司胶囊,按“2.3”项下方法,以B 900ml为溶出介质,于90min(释放完全)时取适量溶出液,分成2份,1份按“2.1.2”项下操作离心处理;另一份分别采用3 μm和0.45 μm混合纤维素酯滤膜滤过,弃去不同体积的初滤液,取续滤液测定溶出度随初滤体积的变化,结果见表1。初滤不同体积时不同孔径滤膜对他克莫司的吸附率(吸附率=│初滤一定体积的溶出度-离心溶出度│/离心溶出度×100%)见图2。
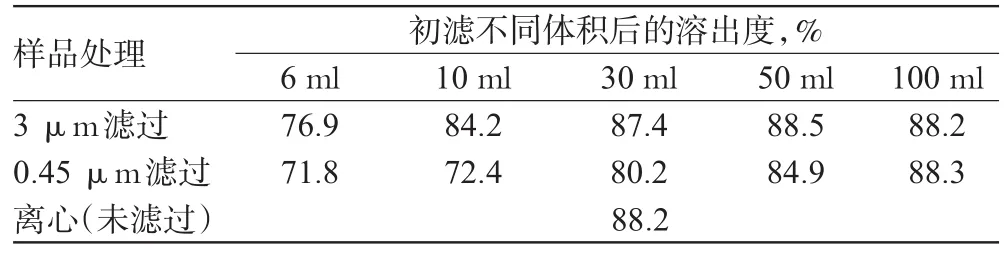
表1 离心处理及初滤不同体积后自研他克莫司胶囊的溶出度Tab 1 Dissolution of self-prepared Tacroimus capsules with centrifugal treatment and initial filtration of different volume

图2 不同滤膜对他克莫司的吸附率Fig 2 Adsorbability rate of different filter membranes to tacroimus
上述结果表明,滤膜对他克莫司的吸附作用明显。初滤6ml时,3 μm滤膜吸附率在12%左右,初滤50ml达到吸附饱和;初滤6ml时,0.45 μm小孔径滤膜吸附率高达20%左右,初滤100ml达到吸附饱和。可见,达到饱和时需要初滤的初滤液体积较大,会引起累积溶出度的计算误差。为保证溶出数据的准确性,应先对溶出液进行离心操作,取上清液采用HPLC法测定他克莫司含量,计算累积溶出度并绘制溶出曲线。
2.5 稳定性试验
按照“2.1.1”项下方法,分别制备A、B、C、D 4种溶出介质的对照品溶液,于25 ℃下放置6、8、10、12、18、24h后,分别按“2.2”项下色谱条件进样测定,记录色谱图。结果,在4种溶出介质中峰面积的RSD分别为1.75%、1.42%、1.46%和1.57%(n=6),表明在25℃条件下各对照品溶液在6~24h内稳定。
取自研他克莫司胶囊,按“2.3”项下方法,分别以900ml A、B、C、D为溶出介质,于90min时取适量溶出液,按“2.1.2”项下方法制备4种溶出介质的供试品溶液,于25℃下放置2、4、6、8、12、18、24h后,分别按“2.2”项下色谱条件进样测定,记录色谱图。结果,在4种溶出介质中峰面积RSD分别为1.78%、1.55%、1.22%和1.43%(n=7),表明在25℃条件下供试品溶液在2~24h内稳定。
2.6 重复性试验
取自研他克莫司胶囊1粒,按“2.3”项下方法,溶出介质为B 900ml,于90min时取适量溶出液,按“2.1.2”项下方法分别制备供试品溶液6份,按“2.2”项下色谱条件进样测定,记录色谱图。结果,6份供试品溶液峰面积的RSD为0.67%(n=6),表明方法重复性良好。
2.7 线性关系考察
精密吸取对照品贮备液1.0、3.0、5.0、8.0、10.0ml,分别加乙腈稀释至10.0ml,精密加入溶出介质A 25ml,摇匀,制备成他克莫司质量浓度为0.08、0.24、0.41、0.65、0.81μg/ml的对照品溶液;同法制备其他3种溶出介质的对照品溶液。按“2.2”项下色谱条件进样测定,分别以他克莫司的峰面积(y)为纵坐标、质量浓度(x,ug/ml)为横坐标进行线性回归,他克莫司在不同溶出介质中的回归方程见表2。结果表明,他克莫司质量浓度在0.08~0.81μg/ml范围内,在4种溶出介质中线性关系均良好。

表2 自研他克莫司胶囊在4种溶出介质中的回归方程Tab 2 Regression equation of self-prepared Tacrolimus capsules in 4 kinds of dissolution mediums
2.8 方法回收率试验
分别精密称取他克莫司对照品6.00、8.06、10.14mg,置于50ml量瓶中,加乙腈溶解并定容至刻度;精密量取上述溶液0.7ml,各3份,分别置于50ml量瓶中,加乙腈溶解并定容至刻度;再精密量取上述溶液20ml,加入含有自研他克莫司胶囊空白制剂的溶出介质A 50ml,制备成低、中、高质量浓度(0.48、0.64、0.81μg/ml)的供试品溶液。同法制备其他3种溶出介质的供试品溶液。25℃放置6h后,分别按“2.2”项下色谱条件进样,记录色谱图,将测得值代入“2.7”项下回归方程,计算方法回收率。结果显示,4种低、中、高质量浓度供试品溶液的平均回收率均在98%~102%范围内(RSD为0.7%~1.0%,n=3),表明在所选择的溶出条件及测定条件下,方法准确度较好。
2.9 定量限试验
精密量取对照品贮备液4.0ml于量瓶中,加入含自研他克莫司胶囊空白制剂的溶出介质B 10ml,混匀,用溶出介质与乙腈的混合溶液(5∶2)稀释,按“2.2”项下色谱条件进样,记录色谱图,按信噪比为10计算,他克莫司定量限为12.8 ng。
2.10 溶出曲线的测定与评价
2.10.1 溶出曲线测定 按“2.1”项下方法制备对照品和供试品溶液,按“2.3”项下方法及条件测定溶出度,按“2.2”项下色谱条件进样测定,记录色谱图,并按外标法以峰面积计算0、15、30、45、60、90min(若溶出度均达到85%以上,且差值在5%以内,试验可提前结束)时的溶出度并计算累积溶出度,绘制溶出曲线。2种制剂在4种溶出介质中的溶出曲线见图3。
2.10.2 溶出曲线评价
采用美国FDA有关口服固体药物利用度和生物等效性研究指南推荐使用的f2法[6-7],评价自研他克莫司胶囊的质量,计算公式[8]如下:

其中,Rt为t时间内原研他克莫司胶囊平均累积溶出百分率;Tt为t时间内自研他克莫司胶囊平均累积溶出百分比率;n为取样点的个数(n为3~5,且R>85%的点不超过1个)。若50≤f2<100,则表示自研他克莫司胶囊与原研他克莫司胶囊溶出行为相似。选择15、30和60min 3点进行计算,2种制剂在A、B、C、D 4种溶出介质中的溶出曲线的f2分别为63.1、54.8、56.6、68.3,均大于50,说明自研他克莫司胶囊和原研他克莫司胶囊的体外溶出行为具有相似性。但自研他克莫司胶囊和原研他克莫司胶囊的体内生物利用度是否等效,有待进一步考察。
3 讨论
他克莫司难溶于水,故制备他克莫司对照品时需加入乙腈溶解;供试品溶液加入一定比例的乙腈,是为了保证供试品溶液和对照品溶液的溶剂组成一致,避免产生溶剂效应造成的测定误差。他克莫司有2个体内生物等效的互变异构体,在溶液中存在转化平衡[9],因此供试品溶液需要放置2 h后进样,对照品溶液需要放置6h后进样,以保证他克莫司及其异构体的转化达到平衡,进而保证测定的准确性。
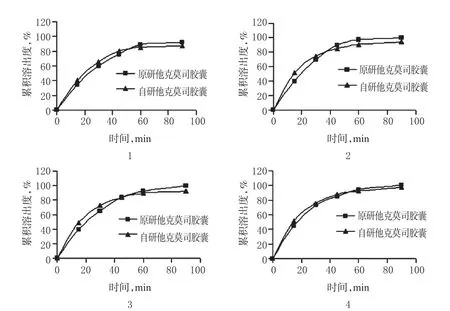
图3 自研和原研他克莫司胶囊在4种溶出介质中的溶出曲线(n=12)1.溶出介质A;2.溶出介质B;3.溶出介质C;4.溶出介质DFig 3 Dissolution curves of self-prepared and original Tacrolimus capsules in 4 kinds of dissolution mediums(n=12)1.dissolution medium A;2.dissolution medium B;3.dissolution medium C;4.dissolution medium D
他克莫司为大环内酯类化合物,溶出介质中加入适量的HPC,可以减少其在试验仪器表面的吸附影响,从而获得接近100%的方法回收率[10]。由于制成胶囊时采用了固体分散技术,使原料药高度分散在水溶性载体中,比表面能变大,吸附能力增强;又由于自研他克莫司胶囊规格小,溶出液浓度低,使达到饱和时初滤液的体积较大,引起累积溶出度的计算误差,因此在测定溶出曲线时,建议采用离心处理。在溶出90min时,他克莫司胶囊释放完全,溶出液中他克莫司浓度最高,但滤膜吸附仍不能通过初滤消除。在进行溶出度测定时,溶出液可以采用合适的滤膜过滤[11],但需要充分考虑滤膜的吸附,通过增加初滤体积,使滤膜达到吸附饱和。
[1]Yamashita K,Nakate T,Okimoto K,et al.Establishment of new preparation method for solid dispersion formulation of tacrolimus[J].Int J Pharm,2003,267(1/2):79.
[2]Overhoff KA,McConville JT,Yang W,et al.Effect of stabilizer on the maximum degree and extent of supersaturation and oral absorption of tacrolimus made by ultra-rapid freezing[J].Pharm Res,2008,25(1):167.
[3]苗燕飞,戈文兰,陈国广,等.阿戈美拉汀片在4种溶出介质中的体外溶出研究[J].中国药房,2013,24(29):2760.
[4]陆步实,孙磊,周立新,等.多条溶出曲线评价缬沙坦氨氯地平片的质量[J].中国医院药学杂志,2012,32(9):704.
[5]The United States Pharmacopeial Convention.USP36[S].Washington:The United States Pharmacopeial Convention,2013:5257.
[6]谢沐风,张启明,陈洁,等.国外药政部门采用溶出曲线评价口服固体制剂内在品质情况简介[J].中国药事,2008,22(3):257.
[7]张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志,2009,40(12):946.
[8]谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308.
[9]Namiki Y,Fujiwara A,Kihara N,et al.Determination of the immunosuppressive drug tacrolimus in its dosage forms by high-performance liquid chromatography[J].Chromatographia,1995,40(5/6):253.
[10]藤泽药品工业株式会社.延释制剂:中国,99806415.7[P].2001-06-27.
[11]周立明,张莉,赵晓娟,等.他克莫司自微乳的制备和质量评价[J].中国医院药学杂志,2012,32(24):1975.
