采用反义寡核苷酸聚乳酸可降解微球建立小鼠肾阳虚模型
2015-05-21李晓清应坚重庆市中医院肿瘤科重庆404100
李晓清,应坚(重庆市中医院肿瘤科,重庆 404100)
肾阳虚证在中医基础理论研究和临床应用中均有重要地位,其模型研究一直是肾阳虚证研究的关键,已有的肾阳虚证模型先后采用了衰老大鼠、外源性药物、手术切除性腺等方法[1-4]。上述动物模型对该证型的实验研究产生了重要的促进作用。但随着研究的深入,这些模型某些方面尚不能完全满足实验要求:(1)大鼠的遗传背景复杂,可能会对机体的发病及治疗反应产生影响。(2)肾上腺轴的变化和证型之间的因果关系不能完全确定。长期生命活动中各种应激以及肾虚都可能造成HPA轴功能下降。(3)外源性糖皮质激素肾阳虚证模型中外源性糖皮质激素与肾阳虚证之间因果关系不直接。糖皮质激素不仅可与糖皮质激素受体(GR)结合,而且可与盐皮质激素受体(甚至其他受体)结合,进而导致机体产生复杂变化[5-8]。
反义寡核苷酸(AS-ODN)可选择性抑制目的基因的表达,但天然AS-ODN的半衰期一般只有15~20min,笔者将AS-ODN经硫代磷酸化修饰后,用可降解聚乳酸微球包埋,以达到持续、稳定地抑制GR表达的效果。本实验拟通过小鼠皮下注射AS-ODN聚乳酸可降解微球抑制GR表达以建立肾阳虚模型。
1 材料
1.1 仪器
55P27型超速冷冻离心机(日本Hitachi公司);高效液相色谱仪,包括紫外检测器(美国Agilent公司);DigBeh-LM16型小鼠自主活动计算机视频分析系统(上海吉量软件科技有限公司)。
1.2 药品与试剂
聚乳酸-羟基乙酸共聚物75/25(PLGA75/25,成都一平医药有限公司,黏度:0.2 dl/g,分子质量:15000);Trizol®抽提试剂(美国Invitrogen公司);逆转录(RT)试剂盒、聚合酶链反应(PCR)试剂盒和DL2000标志物(Marker)(日本TaKaRa公司);AS-ODN(委托北京赛百盛基因技术有限公司合成,批号:2728142,纯度:99.9%)。
1.3 动物
3周龄C57小鼠30只,♂,体质量5~7 g,第三军医大学大坪医院野战科外研究所实验动物中心提供,动物合格证号:SCXK(渝)2008-0003。本研究通过我院医学伦理会论证。
2 方法与结果
2.1 AS-ODN聚乳酸可降解微球的制备
根据Gene bank小鼠基因序列(序列号为X04435)设计,AS-ODN的序列为5′-TAAAAACAGGCTTCTGATCCT-3′,对所有碱基采用硫代磷酸化修饰(由北京赛百盛基因科技有限公司代为合成)。首先在5ml二氯甲烷中加入50mg丙交酯和己交酯1∶1的共聚物,以及AS-ODN(已硫代磷酸化)的水溶液[5mg AS-ODN+100μl聚乙烯醇(0.4%,m/V)],以4000 r/min搅拌5min,然后加入160ml水性分散介质(0.9%无菌生理盐水),以6000 r/min搅拌5min,通过溶剂蒸发形成中心球(直径在5~15 μm);以离心半径6.3 cm、6000~8000 r/min离心10min,水洗3次,冷冻干燥48 h收集,在双蒸水中洗涤去除未被包裹的AS-ODN,最后冷冻干燥,得可降解微球。采用高效液相色谱法[9-10]测定其载药量为9~11.5μg/mg。
2.2 分组与给药
小鼠随机分为A、B、C、D、E组,每组6只,以组为单位将小鼠饲养在12h明亮/12h黑暗、恒温21℃、湿度为55%的清洁级环境中,自由摄食和饮水。A组小鼠皮下注射0.2ml生理盐水,B~E组依次皮下注射AS-ODN聚乳酸可降解微球0.1、0.2、0.4、0.8mg(0.2ml生理盐水溶解),每周给药1次,连续给药4周。
2.3 指标观察
2.3.1 一般情况 给药后每日观察各组小鼠的眼神(眼球运动)、呼吸、睡眠、皮毛光滑程度等,记录给药后每周小鼠的体质量,以了解小鼠发育情况。
2.3.2 活动度 给药4周后,采用多功能小鼠自主活动记录仪进行自主活动度检测,即将小鼠放置于测量筒内静置5min,然后连续记录15min内小鼠的活动度,计算每1min平均活动度,以“次/min”为单位。
2.3.3 脏器中GR mRNA表达 给药4周后取各组小鼠,断颈处死,收集肝脏、肾上腺、脑等标本,按照Trizol®抽提试剂说明书方法提取肝脏、肾上腺、脑组织的RNA。取样本RNA溶液1μl加入99μl超纯水,测定260nm、280nm波长处光密度(OD),计算OD260/280比值。若OD260/280比值介于1.8~2.0,表示样本RNA溶液纯度高。按照RT试剂盒产品说明书方法将RNA逆转录成cDNA,逆转录条件为:30℃10min,42℃20min,99℃5min,4℃5min。反应完毕后在-20℃保存。按照PCR试剂盒说明进行目的片段扩增,扩增条件为:94℃预变性5min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 1min,35个循环;最后72 ℃延伸5min。PCR引物序列:GR上游引物为5′-AGTTCTCCTCCGTCCAGCTC-3′,下游引物为5′-AACACCTCAGGCTCGATCAC-3′,目的产物大小为414 bp。甘油醛-3-磷酸脱氢酶(GAPDH)序列:上游引物为 5′-ACCACAGTCCATGCCATCA-3′,下游引物为5′-TCCACCACCCTGTTGCTGTA-3′,产物大小为450 bp。以120 V电压在加有核酸染料Gold view的2.0%琼脂糖凝胶上电泳15min,经凝胶紫外扫描成像仪观察,凝胶成像扫描仪分析,记录积分光密度(IOD)。以GR目的条带IOD值与GAPDH条带IOD的比值表示GR mRNA表达情况。
2.4 统计学方法
以SPSS 13.0统计分析软件进行统计学处理。所有数据用表示,各组数据采用单因素方差分析。以P<0.05表示差异具有统计学意义。
3 结果
3.1 小鼠一般情况
与A组比较,其余组小鼠给药后在第4周开始逐渐出现体毛稀疏无光泽、拱背、少动、扎堆、竖毛、反应迟钝等肾阳虚表现;其体质量逐渐减轻,其中B组小鼠从给药后3周开始减轻,C、D组小鼠从给药后1周开始减轻,E组小鼠从给药后2周开始减轻,差异具有统计学意义(P<0.05)。各组小鼠不同时期的体质量见表1。
表1 各组小鼠不同时期的体质量(,n=6,g)Tab 1 Weights of mice in all groups at different stages(,n=6,g)

表1 各组小鼠不同时期的体质量(,n=6,g)Tab 1 Weights of mice in all groups at different stages(,n=6,g)
注:与A组比较,*P<0.05Note:vs.groupA,*P<0.05
组别A组B组C组D组E组7周龄21.50±1.8719.00±1.79*15.17±2.22*17.67±2.73*15.33±1.21*3周龄6.00±1.795.83±1.766.00±1.416.50±1.876.33±1.634周龄12.12±2.0411.27±1.649.17±6.33*10.83±1.17*10.11±1.415周龄18.17±1.7216.33±3.2713.50±1.05*14.33±2.07*12.67±1.37*6周龄20.83±1.4718.50±1.97*14.67±1.97*16.33±2.16*14.83±1.72*
3.2 小鼠活动度变化
A、B、C、D、E组小鼠给药4周后的活动度分别为(2.82±0.75)、(1.42±0.25)、(1.25±0.31)、(1.35±0.21)、(1.51±0.13)次/min。与A组比较,其余组小鼠的活动度降低,差异具有统计学意义(P<0.05)。
3.3 小鼠脏器中GR mRNA表达情况
与A组比较,其余组小鼠肝、肾上腺、脑组织中GR mRNA表达降低,差异有统计学意义(P<0.05)。各组小鼠肝脏、肾上腺、脑组织中GR mRNA表达的电泳图见图1,表达水平测定结果见表2。
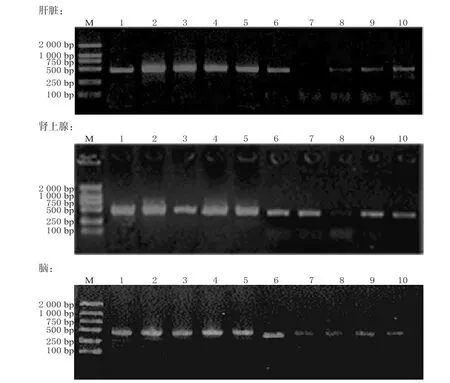
图1 各组小鼠肝脏、肾上腺、脑中GR mRNA表达的电泳图注:M表示Marker;1~5依次为A~E组的GAPDH产物;6~10依次为A~E组的GR mRNA产物Fig 1 Electrophoretograms of GR mRNA expression in liver,adrenal gland and brain of mice in all groupsNote:M refers to Marker;1-5 respectively represent the GAPDH products of groups A-E;6-10 respectively represent the GR mRNA products of groupsA-E
表2 各组小鼠肝脏、肾上腺、脑中GR mRNA表达水平的测定结果(,n=6)Fig 2 GR mRNA expressions in liver,adrenal gland and brain of mice in all groups(,n=6)

表2 各组小鼠肝脏、肾上腺、脑中GR mRNA表达水平的测定结果(,n=6)Fig 2 GR mRNA expressions in liver,adrenal gland and brain of mice in all groups(,n=6)
注:与A组比较,*P<0.05Note:vs.groupA,*P<0.05
组织肝脏肾上腺脑E组0.68±0.10*0.57±0.08*0.56±0.09*A组0.85±0.100.88±0.030.94±0.06 B组0.54±0.04*0.68±0.05*0.54±0.04*C组0.58±0.02*0.50±0.09*0.58±0.06*D组0.63±0.04*0.52±0.05*0.70±0.06*
4 讨论
肾阳虚证模型的建立是肾阳虚证试验研究的基础。肾阳虚患者GR表达降低,温补肾阳能够提高GR表达水平[6,11]。由此提出假设:抑制GR的表达可以作为建立肾阳虚模型的方法。前期研究发现,淫羊藿苷能提高肾阳虚细胞GR表达水平,并呈现出剂量依赖性[8],在细胞水平通过抑制GR表达建立了肾阳虚证模型。本实验拟在动物水平通过抑制GR表达建立小鼠肾阳虚证模型,希望在一定程度上再次验证假设。采用遗传背景单一的C57小鼠复制模型可以有效地降低遗传背景复杂性对实验本身的干扰。复制模型过程中仅抑制GR表达,影响条件单一,GR表达抑制与动物出现的症状之间的因果关系清楚,也使HPA轴和症候之间的关系更加明确。从小鼠幼年开始抑制GR表达使笔者首次观察到GR表达抑制对小鼠生长发育的影响,这也符合“肾主生长发育”的理念。在研究中除A组外,各组小鼠均出现了拱背、少动、扎堆、竖毛、体质量增长缓慢、发育迟缓等肾阳虚证的外在表现。由实验结果可见,与A组相比,其余各组小鼠体质量都表现出下降趋势,此为抑制GR而影响小鼠生长发育的表现。
目前主要通过腔室、给药泵等方式注射AS-ODN,能够达到较好的局部基因表达抑制效果,使基因mRNA表达水平下降20%~56%[12-13],但全身基因表达抑制未见报道。本实验采用皮下注射的方式以达到全身GR抑制的目的,对肝、肾上腺、脑组织进行GR表达的测定结果均显示GR表达下调。
Islam A等[10]采用AS-ODN聚乳酸可降解微球400μg对Wistar大鼠颅内注射,成功使目的基因mRNA表达下调了39%、目的蛋白下降了80%。目前AS-ODN皮下注射抑制GR表达的有效剂量未见报道。本文参考文献[10],设立0.1、0.2、0.4、0.8mg 4个剂量组。从实验结果可见,各个剂量AS-ODN聚乳酸可降解微球均可抑制GR基因的表达,GR抑制效果与剂量不完全呈剂量依赖关系,其中原因有待进一步研究。另外,各个剂量AS-ODN聚乳酸可降解微球均使小鼠表现出发育迟缓、活动度降低等肾阳虚表现。
本实验通过AS-ODN聚乳酸可降解微球皮下注射使小鼠呈现出肾阳虚症状,而且与GR基因表达抑制相关。这是对肾阳虚动物模型建立的初步探讨,在后续实验中还需要进一步验证。
[1]宋彩梅,王红梅,刘新民,等.肾虚型老年痴呆动物模型的建立[J].现代中西医结合杂志,2011,20(22):2744.
[2]李长禄,王红梅,王立为.肾虚型老年痴呆大鼠模型的复制[J].安徽中医学院学报,2013,32(3):62.
[3]吕银娟,周安方,张智华,等.双侧肾上腺大部切除肾阳虚动物模型的建立[J].湖北中医药大学学报,2013,15(5):21.
[4]姚长风,赵永见,牛凯,等.去卵巢致肾虚的腰椎间盘退变模型的实验研究[J].中国骨伤,2013,26(12):1015.
[5]肖诚,赵宏艳,王燕,等.益肾蠲痹丸对肾虚证与脾虚证胶原诱导性关节炎大鼠的疗效比较[J].中日友好医院学报,2014,28(2):102.
[6]吴欣莉,高菁,李彤,等.肾虚证物质基础研究的初步探讨[J].中国中西医结合肾病杂志,2013,14(2):131.
[7]Müller M,Holsboer F,Keck ME.Genetic modification of corticosteroid receptor sigaling:novel insights into pathophysiology and treatment strategies of human affective disorders[J].Neuropeptides,2002,36(2/3):117.
[8]钟瑜,李晓清,徐晓玉,等.淫羊藿苷对肾阳虚细胞糖皮质激素受体表达影响的研究[J].中国药房,2007,18(36):2801.
[9]Hyon SH.Biodegradable poly(lactic acid)microspheres for drug delivery systems[J].Yonsei Med J,2000,41(6):720.
[10]Islam A,Thompson KS,Akhtar S,et al.Increased 5-HT2Areceptor expression and function following central glucocorticoid receptor knockdown in vivo[J].European Journal of Pharmacology,2004,502(3):213.
[11]杜娟,凌昌全,陈永安.淫羊藿和熟地煎剂对糖皮质激素受体下调模型大鼠糖皮质激素受体的影响[J].中国中西医结合杂志,2008,28(1):64.
[12]Xie J,Li X,Jiang CJ,et al.Novel PLGA microspheres for sustained delivery of antisense oligonucleotide[J].Chemical Research in Chinese Universities,2013,29(5):1003.
[13]Wang WW,Wang SJ,Li GF,et al.Survivin ASODN targeted therapy in XWLC-05 cell transplanted nude mice[J].Chinese-German Journal of Clinical Oncology,2012,11(6):324.
