预测自发性脑出血短期临床结局的相关因素分析
2015-12-02张硕马爽冯娟
张硕,马爽,冯娟
预测自发性脑出血短期临床结局的相关因素分析
张硕,马爽,冯娟
目的:对预测自发性脑出血短期预后的相关危险因素进行分析。方法:回顾性分析自发性脑出血患者的临床资料。将可能影响发病后30 d临床结局的危险因素进行单因素分析及多因素Logistic回归分析。结果:纳入自发性脑出血患者418例,其中结局良好组105例,结局不良组146例。年龄≥75岁(OR=2.57,P<0.01)、幕下来源血肿(OR=6.51,P<0.01)、血肿体积≥30 cm3(OR=13.41,P<0.01)、收缩压≤110或≥200mmHg (OR=4.05,P<0.01)、血肿破入脑室(OR=4.01,P<0.01)、合并慢性疾病(OR=4.18,P<0.01)为自发性脑出血短期预后不良的独立危险因素。结论:明确自发性脑出血短期预后不良的相关因素可指导临床决策。
脑出血;危险因素;结局;预后;多因素分析
自发性脑出血是脑血管病的重要类型,占所有卒中的10%~15%,占颅内出血的78%~88%。一般认为,自发性脑出血是没有确切继发性病因所引起的脑实质出血[1]。与动脉瘤及动静脉畸形等其他引起的颅内出血的类型不同,自发性脑出血的预后并未随着外科治疗手段及重症监护技术的更新而得到改善[2]。自发性脑出血的短期病亡率明显高于缺血性卒中及血管畸形等原因所致颅内出血,长短期预后均极差[3]。明确影响临床结局的相关危险因素,在自发性脑出血的发病早期即可对预后进行评价,是制定切实可行的诊疗计划,规范临床试验方案的理论基础。在某种程度上,基于神经功能状态评分、生命体征、各种临床及神经影像学表现的评估模式可能对自发性脑出血的临床结局进行预测,这对临床有重要的指导性意义[2,4]。
为了能够在早期即对患者预后作出适当评价,恰当制订个体化临床决策,指导临床诊治,本研究拟基于本地区患者临床特点,对自发性脑出血住院患者病例资料进行相关性分析,筛选出自发性脑出血短期预后不良的潜在临床指标,明确影响其短期预后不良的独立危险因素[5]。
1 资料与方法
1.1 一般资料
连续收集2011年6月至2014年12月于我院住院的自发性脑出血患者,纳入标准:自发性脑出血符合中国脑血管病防治指南(2010年版)诊断标准,无年龄及性别限定范围;经头颅CT等影像学检查证实;发病24 h内可采集到相关临床资料;除于急诊因病死亡外,所有患者均在脑出血急性期开始诊治,均参照指南采用相同的治疗原则及公认标准。排除标准:发病24 h后入院及24 h内实施不复苏(do not resuscitate,DNR)[6]指令的患者;不能获得发病24 h内的相关临床资料;发病前3月内曾使用抗凝药物者;既往有急性脑血管病病史且遗留神经功能缺失症状者;血液系统疾病所引起、创伤性、经影像学证实有明确脑血管畸形病因或肿瘤性的脑出血者;病情进展,有外科手术指征但拒绝手术者。
1.2 方法
采集临床资料,包括人口学特征、既往史、临床表现,慢性并发症(参照APACHE-Ⅱ[9]评分系统中慢性健康状况评分所规定的慢性疾病),Glasgow昏迷评分(Glasgow coma scale,GCS),头颅CT表现,血压(包括收缩压、舒张压),心率等生命体征;为避免血肿扩大所引起的数据选择性偏倚,头颅CT表现以发病后24 h内最后一次记录为标准,其中头颅CT评价指标包括:血肿体积(脑实质内使用ABC/2方法计算[10],脑室内出血量采用改良Graeb评分评估[11]),是否存在脑室内出血(包括双侧侧脑室,第三、四脑室,使用改良Graeb评分[11]),血肿主要位置及来源(分为幕上或幕下)。如以上数据有多次结果或存在动态演变,则记录发病24 h内最后一次结果。
1.3 临床结局的判定
临床结局的评估采用改良Rankin评分(modified Rankin scale,mRS)[7]:死亡及严重残障被认定为结局不良,mRS 5或6分;存活但留有中度残疾,mRS 3或 4分;临床结局良好,mRS≤2分。对患者临床结局进行随访,临床结局的判定时间点在发病后第30天;如无法取得发病后30 d患者的临床资料及结局信息,以患者出院时的临床结局作为最终结局;如在患者入院24 h后,放弃诊治,GCS等神经功能评分未见好转的情况下自动退院,则认为患者短期临床结局为不良(即mRS 5或6分)[8]。
1.4 统计学处理
采用SPSS16.0软件分析数据,参考相关研究结论[12],将可能影响自发性脑出血短期预后的相关因素进行单因素分析,计量资料以(均数±标准差)表示,独立样本t检验;计数资料采用Pearson’sχ2检验。将上述有统计学差异的观测指标作为结局不良的危险因素,进一步采用Logistic回归分析确定相关独立危险因素,P<0.05为差异有统计学意义。
2 结果
2.1 影响自发性脑出血预后的单因素分析结果
共纳入自发性脑出血患者418例,男217例,女201例。其中,结局良好组105例,结局不良组146例,mRS 3或4分167例(不纳入统计分析),单因素分析显示2组在年龄≥75岁、GCS、收缩压≤110 mmHg(1 mmHg=0.133 kPa)或≥200mmHg、合并慢性疾病(APACHE-Ⅱ评分系统所规定心肺肝肾严重功能不全),血肿体积、血肿位置、血肿破入脑室方面差异有统计学意义(P<0.05),见表1。
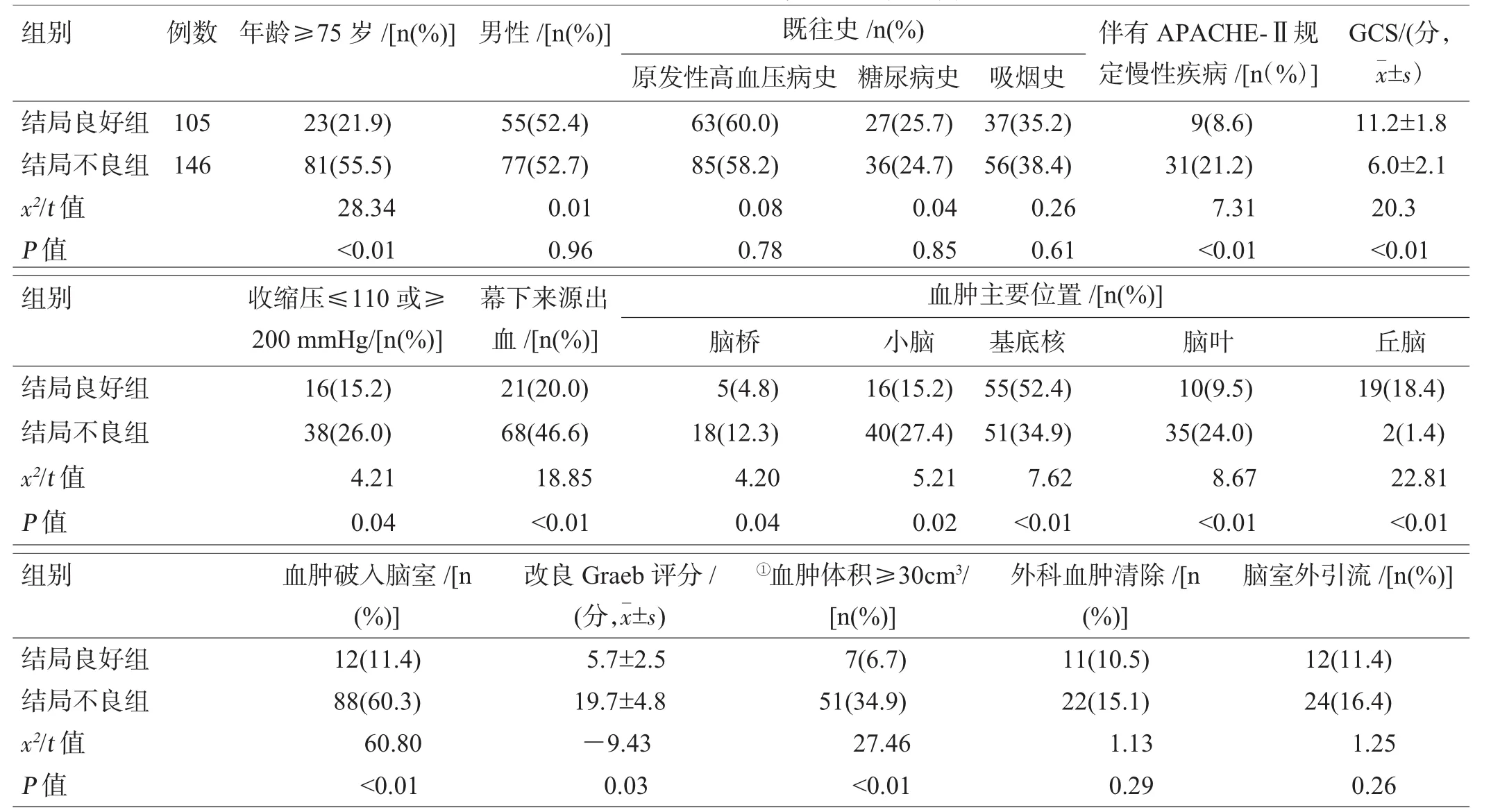
表1 影响自发性脑出血临床结局的单因素分析
2.2 影响自发性脑出血不良结局的Logistic回归分析
以自发性脑出血患者结局不良为因变量,以年龄≥75岁、收缩压≤110mmHg或≥200mmHg、合并慢性疾病、血肿体积、血肿位置、血肿破入脑室为自变量进行Logistic多元逐步回归分析,显示上述因素均与结局不良独立相关(P≤0.01),可作为自发性脑出血预后不良的独立危险因素,见表2。
3 讨论
本研究利用多元回归分析得出自发性脑出血预后不良相关独立危险因素,主要包括高龄(≥75岁)、幕下来源血肿、血肿体积、收缩压≤110或≥200mmHg、血肿破入脑室、合并慢性疾病,对脑出血患者短期临床结局的具有一定的预测价值。
大部分脑出血患者起病后会首先于急诊科就诊,这段时间也是治疗和评估患者的最佳时期,但不同患者从起病到医院就诊的时间不同,在急诊停留的时间也有差异,一些评估指标可能随时间的不同而发生变化,如血肿量的变化、脑室内出血等情况。血肿体积与自发性脑出血患者的预后密切相关,本研究也证实较大的血肿体积是预后不良的独立危险因素。传统观点认为,在患者凝血功能正常的情况下,活动性出血会在发病后数分钟内停止。但近些年的回顾性研究表明,自发性脑出血发病后的早期,约有14%~38%的患者会血肿扩大(24 h内血肿体积增大33%以上)[13],而增强CT血管成像的“亮点征”(spotsign)是预测血肿扩大的重要影像学指标[14]。Rodriguez-Luna等[15]的研究表明血肿扩大是自发性脑出血患者死亡和预后不良的独立危险因素,血肿扩大往往发生在自发性脑出血后的超早期,即发病后的6 h内,患者在入院后可保持清醒状态,但在随后的时间里如发生血肿扩大,其神经功能缺失严重程度可随之升高,相应的NIHSS、GCS、血肿体积、血肿破入脑室内等指标会相应发生变化。目前对于非凝血功能障碍引起的血肿扩大缺乏有效的干预措施,伴有血肿扩大的自发性脑出血患者相对预后不良[16]。因此,进行评估的时机非常重要,但目前尚未明确进行自发性脑出血评分的适宜时间,一般认为24 h后患者血肿体积不会再增大,相应指标基本趋于稳定[17]。
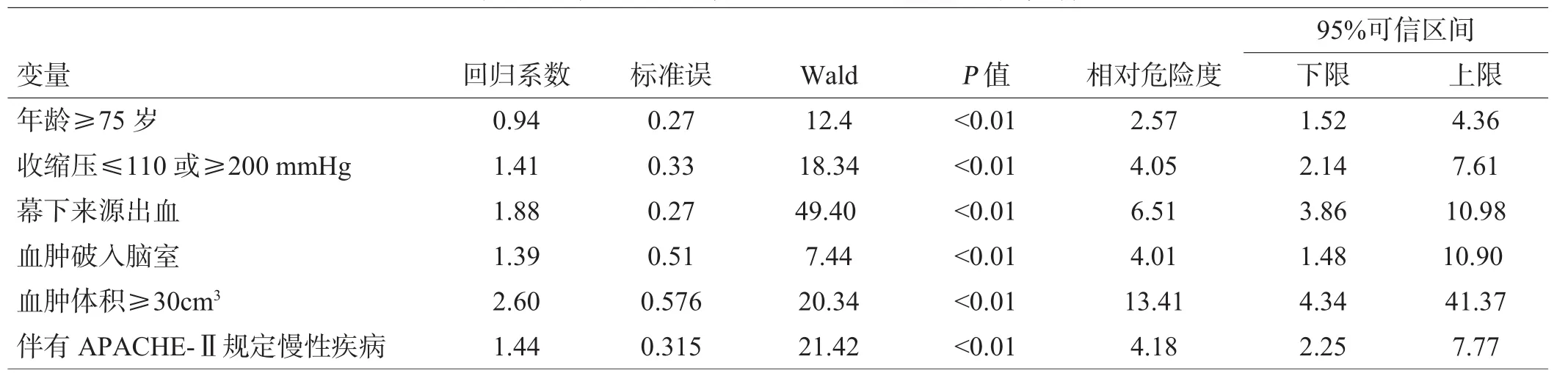
表2 导致脑出血患者预后不良的Logistic回归分析
在某些情况下,脑出血的诊治不能理想化。患者家属的治疗意向往往受社会因素及价值取向的影响,年龄是各评分量表一个重要的预后因素,最近的一项多中心流行病学调查显示脑出血的死亡率随年龄增长而增高。年轻患者在发病后更易被及时送往医院,尽早治疗会给患者带来更好的预后结局[18]。反复发作的慢性疾病往往使高龄自发性脑出血患者的病情加重,高龄以及合并其它慢性疾病常常是延误治疗,放弃生命支持,实施DNR指令的重要因素之一,这种情况在脑出血患者中也常见[19]。在许多临床试验中,很大一部分老年患者被排除试验或因其它原因失访。部分家属对高龄脑出血患者诊治的依从性较差,甚至放弃治疗,这类患者的临床结局也较差。目前研究对脑出血的高龄的分界点不尽相同,在本研究人群中,年龄≥75岁是脑出血预后不良的独立危险因素,将年龄与慢性共存疾病进行联合评分更具有实际意义。慢性疾病依据APACHEⅡ评分系统,此评分系统在重症监护中广泛使用,且被临床证实评价病情危重程度较好。进一步研究仍需结合其它因素,确定何年龄段是自发性脑出血预后不良的绝对高危因素。
原发性高血压既是自发性脑出血患病的危险因素,又是自发性脑出血预后的独立危险因素,这种情况在中国人群更为常见[20]。在许多研究中入院时的血压值也被看成独立危险因素之一,血压过高时自发性脑出血的早期复发率明显增高,且可加重脑水肿。有研究表明,血压升高会直接增加血肿扩大的风险,导致神经功能恶化,影响预后[21]。然而,最近的一项纳入2 794例脑出血患者的大规模前瞻性研究表明,强化降压并不能改善短期死亡率及致残风险[22]。Geeganage等[23]的Meta回归分析认为,无论收缩压还是平均动脉压升高均是自发性脑出血预后不良的因素,该系统评价纳入的研究异质性较大,高血压的界定、随访时间、预后指标差异较大,未完全均衡混杂因素。有研究表明,血压水平与结局呈U型曲线分布,血压过低可能是患者合并慢性心脏疾病的表现,心功能不全常使机体不能承受急性自发性脑出血的应激,且血压过低导致脑灌注不足,减少出血组织周围的缺血半暗带供血而影响预后[23,24]。脑出血急性期患者血压的控制水平仍值得探讨。本研究证实在不同临床结局组中,收缩压≤110或≥200mmHg患者人数所占的比例不同,差异有统计学意义,且与预后密切相关。有研究表明,这种U型曲线关系在合并有慢性心功能不全或透析的自发性脑出血患者更为常见[25]。
脑室出血是自发性脑出血患者病情恶化的重要危险因素,但有时脑室出血对预后的影响是随时间变化的动态过程,发病早期可能有血肿扩大的可能,出血量小时,患者可能仅有头痛、呕吐症状,意识一般清楚;出血量大时,可使患者意识障碍加重,如波及至丘脑下部,常伴有中枢性高热,上消化道出血,水电解质紊乱等对预后的不利因素;晚期如造成脑脊液循环障碍,可能会引起脑室扩张,造成梗阻性积水,长期预后不良[26]。目前认为改良Graeb评分可相对客观准确评估脑室出血的严重程度[11]。
已有研究证实[12,27],白细胞、D二聚体、纤维蛋白原浓度、即时血糖等某些实验室化验指标同样是自发性脑出血死亡或短期预后不良的独立危险因素。但本研究考虑到上述化验指标缺乏特异性,因此未将实验室化验指标纳入到相关因素分析中。在自发性脑出血发病过程中,上述化验指标的升高仅仅代表机体存在因严重出血引起的应激状态或炎症反应,并不能代表疾病存在进展或恶化趋势,但可能与血肿体积扩大、脑室内出血所引起的神经功能恶化程度相关[28]。
目前,国内外已提出某些基于量表的自发性脑出血预测模型,这其中最为可靠及简便易行的是由Hemphill提出的脑出血评分及其衍生量表[29,30],但其中某些量表只适用于幕上出血的评价。组成量表的相关因素包括:性别、年龄、意识障碍程度(GCS、NIHSS)、血肿体积及位置、存在脑室内血肿及脑积水、入院时神经功能缺失程度、血肿累及蛛网膜下腔、脉压差等。某些量表在进行评分时需要在APACHE-Ⅱ评分系统、Graeb评分及GCS评分基础上进行协同评价,一般来说,复杂量表评估程度相对简单量表准确,但并不易行,这种“复杂”组成可能提高预测的评估效能。目前尚无公认的适用于中国人群的预测自发性脑出血临床结局量表,进一步研究仍需将上述危险因素进行适当综合,将研究结论实用化,制订出适用于本地区人群的脑出血临床结局预测量表。
本研究得出的结论仍需要扩大规模多中心临床试验加以验证,并确定其是否可同样预测长期(如90 d)的自发性脑出血临床结局。相关危险因素分析能够对自发性脑出血患者诊治方案的制定提供切实可靠的参考依据,在临床实践中应结合患者个体化差异进行综合性分析。快速准确地评价患者的危重程度不仅能为临床医生制订诊治方案提供佐证,而且可为规范化临床研究方案提供参考标准。
[1]Gokhale S, Caplan LR, James ML, et al. Sex differences in incidence, pathophysiology, and outcome of primary intracerebral hemorrhage[J]. Stroke, 2015, 46: 886-892.
[2]JiR,Shen H,Pan Y,etal.A novel risk score to predict 1-year functional outcome after intracerebral hemorrhage and comparison with existing scores[J].Crit Care,2013,17:R275.
[3]Gokhale S,Caplan LR,James ML.Sex differences in incidence,pathophysiology,and outcome of primary intracerebral hemorrhage[J]. Stroke,2015,46:886-892.
[4]Meyer DM,Begtrup K,Grotta JC.Is the ich score a valid predictor of mortality in intracerebral hemorrhage?[J].J Am Assoc Nurse Pract. 2015,27:351-355.
[5]Wang CW,Liu YJ,Lee YH,etal.Hematoma shape,hematoma size,glasgow coma scale score and ich score:Which predicts the30-daymortality better for intracerebral hematoma?[J].PLoS One,2014,9:e102326.
[6]Ebrahim S.Do not resuscitate decisions: flogging dead horsesora dignified death?Resuscitation should notbewithheld from elderly people without discussion [J].BMJ,2000,320: 1155-1156.
[7]Banks JL,Marotta CA.Outcomes validity and reliability of the modified rank in scale:Implications for stroke clinical trials:A literature review and synthesis [J].Stroke,2007,38: 1091-1096.
[8]Jennett B,Teasdale G,Braakman R,et al. Predicting outcome in individual patients after severe head injury [J].Lancet,1976,1: 1031-1034.
[9]Bian Y,Zhang P,Xiong Y,etal.Application of the APACHE IIscore to assess the condition of patients with critical neurological diseases[J]. Acta NeurolBelg,2015,[Epub ahead of print].
[10]Newman GC.Clarification of abc/2 rule for ICH volume[J].Stroke,2007,38:862-862.
[11]Morgan TC,Dawson J,Spengler D,et al. The modified Grab score:An enhanced tool for intraventricular hemorrhage measurement and prediction of functional outcome [J].Stroke, 2013,44:635-641.
[12]Specogna AV,Turin TC,Patten SB,et al. Factors associated with early deterioration after spontaneous intracerebral hemorrhage:A systematic review and meta-analysis[J].PLoS One, 2014,9:e96743.
[13]Zhang XQ,Zhang ZM,Yin XL,et al.Exploring the optimal operation time for patients with hypertensive intracerebral hemorrhage: tracking the expression and progress of cellapoptosis of prehematomalbrain tissues[J].Chin Med J(Engl),2010,123:1246-1250.
[14]Huynh TJ,Demchuk AM,Dow latshahi D, etal.Spotsign number is the most important spot sign characteristic for predicting hematoma expansion using first-pass computed tomography angiography:analysis from the PREDICT study [J].Stroke,2013,44:972-977.
[15]Rodriguez-Luna D,Rubiera M,Ribo M,et al.Ultraearly hematoma growth predicts poor outcome after acute intracerebral hemorrhage[J]. Neurology,2011,77:1599-1604.
[16]Steiner T,Bösel J.Options to restrict hematoma expansion after spontaneous intracerebral hemorrhage[J].Stroke,2010,41:402-409.
[17]Brouwers HB,Greenberg SM.Hematoma expansion following acute intracerebral hemorrhage[J].Cerebrovasc Dis,2013,35:195-201.
[18]Hemphill JC 3rd,Greenberg SM,Anderson CS,et al.Guidelines for the Management of Spontaneous Intracerebral Hemorrhage: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association[J].Stroke,2015,46:2032-2060.
[19]Silvennoinen K,Meretoja A,Strbian D,et al.Do-not-resuscitate (DNR)orders in patients with intracerebral hemorrhage[J].Int JStroke, 2014,9:53-58.
[20]Wei JW,Heeley EL,Wang JG,et al.Comparison of recovery patterns and prognostic indicators for ischemic and hemorrhagic stroke in china the chinaquest(quality evaluation of stroke care and treatment)registry study[J].Stroke, 2010,41:1877-1883.
[21]Rodriguez-Luna D,Muchada M,Piñeiro S, etal.Potential blood pressure thresholds and outcome in acute intracerebral hemorrhage[J].Eur Neurol,2014,72:203-208.
[22]Anderson CS,Heeley E,Huang Y,et al. Rapid blood-pressure lowering in patients with acute intracerebral hemorrhage[J].N Engl JMed, 2013,368:2355-2365.
[23]Geeganage CM,Bath PM.Relationship between therapeutic changes in blood pressure and outcomes in acute stroke:A meta regression[J]. Hypertension,2009,54:775-781.
[24]Gioia LC,Kate M,Dow latshahi D,et al. Blood pressure management in acute intracerebral hemorrhage:Current evidence and ongoing controversies[J].Curr Opin Crit Care,2015,21: 99-106.
[25]Huang BR,Liao CC,Huang WH,et al. Prognostic factors of spontaneous intracerebral haemorrhage in haemodialysis patients and predictors of 30-day mortality[J].Intern Med J, 2008,38:568-574.
[26]Mustanoja S,SatopääJ,Meretoja A,et al. Extent of secondary intraventricular hemorrhage is an independent predictor of outcomes in intracerebral hemorrhage:Data from the Helsinki ICH study[J].Int JStroke,2015,10:576-581.
[27]Kim KH.Predictorsof 30-daymortality and 90-day functional recovery after primary intracerebral hemorrhage:Hospital based multivariate analysis in 585 patients[J].JKorean Neurosurg Soc,2009,45:341-349.
[28]Hanley DF.Intraventricular hemorrhage: Severity factor and treatment target in spontaneous intracerebral hemorrhage[J].Stroke,2009, 40:1533-1538.
[29] Ruiz-Sandoval JL, Chiquete E, Romero-Vargas S,etal.Grading scale for prediction of outcome in primary intracerebral hemorrhages[J].Stroke,2007,38:1641-1644.
[30]Hemphill JC 3rd,Bonovich DC,Besmertis L,etal.The ICH score:a simple,reliablegrading scale for intracerebral hemorrhage[J].Stroke, 2001,32:891-897.
(本文编辑:王晶)
Risk Factors of Short-term Clinical Outcome in Patients with Spontaneous Intracerebral Hemorrhage
ZHANG Shuo,MA Shuang,FENG Juan.Department of Neurology,Shengjing Hospital,China Medical University,Shenyang 110004,China
Objective:To identify risk factors which may be closely associated with short-term clinical outcomes in patients with spontameous intracerebral hemorrhage(SICH). Methods: A retrospective study with SICH patients was performed. Univariate analysis and multivariate logistic regression analysis were performed to determine the risk factors. Results: In all 418 patients with SICH were enrolled, including 105 cases in favorable outcome group and 146 cases in poor outcome group. Independent prognostic factors of 30-day poor outcome after SICH were, age≥75 years(OR=2.57,P<0.01),comorbidities(OR=4.18,P<0.01),systolic blood pressure≤110 or≥200mmHg (OR=4.05,P<0.01),presence of intraventricular hematoma (OR=4.01,P<0.01),hematoma volume≥30 cm3(OR=13.41,P<0.01)and infratentorial hematoma(OR=6.51,P<0.01).Conclusion:Factors analysis for prediction of short-term clinical outcome could help to stratify SICH patients with regard to short-term clinical outcome.
intracerebral hemorrhage;risk factors;outcome;prognosis;Logistic regression analysis
R741;R743.34
A DOI 10.3870/sjsscj.2015.06.004
中国医科大学附属盛京医院神经内科沈阳110004
2015-05-14
冯娟 fengj@sj-hospital.org
