原位膀胱癌大鼠建模方法比较及超声鉴定方法
2015-12-02张祥许天源夏磊磊王先进秦亮朱照伟钟山邵远沈周俊
张祥 许天源 夏磊磊 王先进 秦亮 朱照伟 钟山 邵远 沈周俊
在我国,膀胱癌的发病率位居男性全身恶性肿瘤的第七位,女性第十位,成为仅次于前列腺癌的第二大泌尿系统肿瘤[1-2]。近年来,虽然手术技术不断提高,灌注药物也不断更新,但是非肌层浸润性膀胱癌术后5年的复发率仍较高,因此构建良好的膀胱癌动物模型及开展后续的相关研究便显得极其重要。目前利用化学诱导剂构建膀胱癌动物模型的方法主要有两种:一种是通过给动物喂饲N-正丁基-N-(4-羟基-丁基)亚硝胺[N-butyl-N-(4-hydroxybutyl)nitrosamine,BBN][3],另一种则是通过将N-甲基亚硝基脲(N-methyl-nitrosourea,MNU)灌注于动物膀胱从而构建膀胱癌的动物模型[4]。虽然上述技术均较为成熟,但在判断建模是否成功时,通常是将动物处死后进行膀胱组织的病理切片检查,因此实验者无法对建模后的动物进一步进行体内实验研究。本课题组曾采用CT扫描的方法来检测大鼠活体的原位膀胱成瘤情况[5]。尽管该方法具有良好的诊断价值,但价格相对昂贵,且CT检查具有放射性。超声检查是临床上膀胱癌诊断、随访常用的影像学检查手段,具有价格相对便宜、操作简单、无放射性等优点,且对膀胱组织无任何不良影响。我们对膀胱癌建模大鼠活体进行超声检查,并在大鼠处死后进行膀胱组织的病理学检查,以评估超声检查对大鼠膀胱癌建模效果的诊断价值。
材料与方法
一、主要试剂
MNU购自美国Sigma公司(2g瓶装混合物,纯度50%)。枸橼酸钠缓冲液的配置:枸橼酸4.2g,氢氧化钠2.1g,加去离子水240ml振摇使之溶解,用5mol/L浓盐酸调节pH值至6.0,再加去离子水至250ml,摇匀即可。将缓冲液50ml注入MNU瓶中,配置成浓度为20mg/ml的MNU溶液。对溶液进行3ml分装,置于-20℃冰箱保存。BBN购自日本东京Kasei公司,加0.005%Tween80作为乳化剂,再加入蒸馏水配置成浓度为0.05%的溶液。
二、实验动物及分组
选用SPF级SD雌性大鼠60只[12周龄左右,体重(200±10)g],由上海交通大学医学院附属瑞金医院实验医学研究中心提供并饲养[SCXK(沪)2011-0113]。实验大鼠采用打耳孔法标记。随机分为BBN组和MNU组。
三、实验方法
BBN组:随机分为诱癌组和对照组。诱癌组20只,每日给予BBN溶液喂养,将BBN溶液灌入饮水瓶中,每日饮水投入,连续6周,后更换为2%的枸橼酸钠溶液连续喂养22周。对照组10只,只给予清水喂养,共28周。MNU组:随机分为诱癌组和对照组。诱癌组20只,给予 MNU溶液(20mg/ml)膀胱灌注,每两周1次,每次0.1ml/只,共4次;8周诱导结束后继续常规饲养6周。对照组10只,给予PBS膀胱灌注,方法同诱癌组。灌注前需将大鼠用2%戊巴比妥钠(50mg/kg)腹腔麻醉。整个实验过程中对于大鼠严格按照3R原则给予人道关怀[3-4]。
四、超声扫描
超声扫描采用德国Visual Sonics公司生产的VEVO770小动物超声影像系统(超声探头型号703,分辨率50μm,频率52.5MHz)。对于 MNU组大鼠,于实验第14周末进行检测。检测前以2%戊巴比妥钠(50mg/kg)腹腔注射麻醉大鼠后仰卧位固定。将大鼠下腹部毛发剃除干净,0.1%新洁尔灭溶液消毒外阴部,用长约6cm自制导尿管从尿道外口插入膀胱,抽出尿液后灌注1.0~1.5ml生理盐水使膀胱充盈。以超声探头紧贴下腹部扫描,记录结果。BBN组于实验第28周末采用相同方法进行超声检查。
五、膀胱组织病理学检查
诱癌周期结束后,经超声扫描各组大鼠,然后采用过量麻醉法处死。观察大鼠的膀胱、肾脏及输尿管形态变化。取新鲜膀胱组织,经固定、包埋、切片、HE染色后,置于显微镜下观察细胞形态结构变化和肿瘤类别。
六、统计学方法
比较两组的存活率和存活成瘤率,实验数据采用χ2检验,以P<0.05为差异有统计学意义。
结 果
一、一般情况
BBN组中的诱癌组大鼠9只死亡,死亡大鼠于饲养第2周后出现活动减少,死亡时大鼠较开始时出现明显的萎缩现象,毛发暗淡,考虑死于全身代谢中毒;存活11只,其中5只可见明显的血尿症状。BBN组中的对照组大鼠无死亡,无异常症状。MNU组大鼠一般于麻醉后2h开始苏醒,4h正常活动。MNU组中的诱癌组大鼠死亡2只(1只死于感染,尸体解剖后发现肾脓肿;1只死于麻醉后窒息),存活18只,存活的18只中有17只出现血尿症状。MNU组中的对照组大鼠死亡1只,考虑死于麻醉过量。
二、超声扫描结果
BBN组中诱癌组超声检查发现存活的11只大鼠中有8只大鼠的膀胱出现新生物,在矢状位和冠状位均可见较小的新生物,且浸润程度较浅(图1A、1B),其中有5只呈乳头状突起伴黏膜固有层浸润,其余3只为浅肌层浸润。对照组超声检查无异常发现(图1C)。MNU组中诱癌组超声检查发现17只大鼠膀胱出现新生物,在矢状位和冠状位均可见较大的肿瘤新生物,且浸润较深(图2A、2B),其中可观察到3只大鼠为乳头状突起伴黏膜固有层浸润,6只大鼠浸润到浅肌层,其余均浸润至深肌层。对照组无异常发现(图2C)。
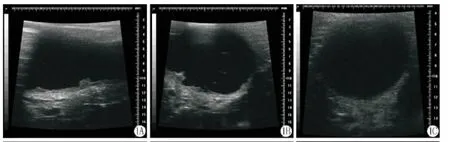
图1 A:矢状位可见膀胱壁表面新生物(BBN诱癌组);B:冠状位可见浸润程度较浅的新生物(BBN诱癌组);C:膀胱壁黏膜正常,无异常发现(BBN组中的对照组)
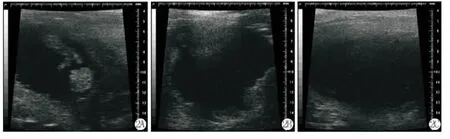
图2 A:矢状位可见膀胱壁表面巨大的肿瘤新生物(MNU诱癌组);B:冠状位可见弥漫生长的肿瘤新生物(MNU诱癌组);C:膀胱壁黏膜正常,无异常发现(MNU组中的对照组)
三、膀胱标本病理肉眼及组织切片结果
BBN诱癌组存活11只,处死后有8只膀胱内可见肿瘤新生物,肿瘤体积较小,多数呈乳头状(图3A),与超声观察结果一致。病理检查可见肿瘤新生物浸润程度较浅(图3B),浸润程度与超声检查结果一致,且肿瘤异型性较明显(图3C)。MNU诱癌组存活18只,处死后有17只膀胱内可见明显的肿块,多数呈弥漫状生长(图3D),与超声检查结果一致。病理检查可见肿瘤浸润程度较深(图3E),部分已经深达深肌层,肿瘤浸润程度与超声检查结果一致,肿瘤异型性较BBN组更加明显(图3F)。
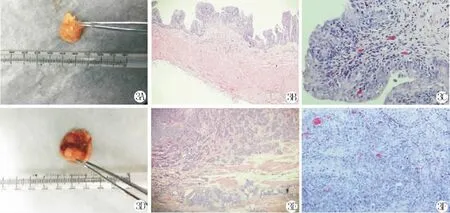
图3 A:BBN造模后的米粒样肿物;B:浸润程度较浅(BBN诱癌组,HE染色,×400);C:肿瘤异型性较明显(BBN诱癌组,HE染色,×200);D:MNU造模后可见巨大肿块(MNU诱癌组);E:浸润程度明显,已达深肌层(MNU诱癌组,HE染色,×400);F:肿瘤异型性更加明显(MNU诱癌组,HE染色,×200)
四、统计结果
BBN组中的诱癌组喂养28周后存活11只,成瘤8只,存活率为55%,存活成瘤率为72.7%。MNU组中的诱癌组喂养14周后存活18只,成瘤17只,存活率为90%,存活成瘤率为94.4%。BBN组中诱癌组与对照组存活成瘤率比较差异有统计学意义(P<0.05)。MNU组中诱癌组与对照组存活成瘤率比较差异有统计学意义。BBN诱癌组与MNU诱癌组存活成瘤率比较差异有统计学意义(P<0.05)。超声检查出的大鼠成瘤率以及肿瘤浸润程度与各组病理检查结果一致,阳性率为100%。
讨 论
膀胱癌在泌尿系统肿瘤的发生率一直高居前列,虽然目前各种手术技术已经相当成熟,但是膀胱癌的术后复发率仍较高。一般膀胱癌术后会采用预防性的化疗,但这依然不能够明显降低总体的术后肿瘤复发率。因此构建良好的肿瘤动物模型,对研究膀胱癌的继续治疗具有至关重要的作用。膀胱癌的病因复杂多变,但是膀胱中持续的致癌物的存在是主要原因之一,同时也是膀胱癌治疗后复发的原因之一。自1937年Hueper首次论证2-奈胺可以诱导膀胱癌以来,许多化学物质都被证明可以诱导膀胱癌的动物模型[6],目前主要使用的两种化学物质分别是BBN和MNU。MNU为亚硝基类化合物,其主要是通过使细胞内某些结构产生烷化作用,特别是核酸的鸟嘌呤分子发生烷化而产生诱癌作用,为直接诱癌物[7]。BBN为间接致癌物,它通过在体内产生N-丁基-N-(3-羧丙基)亚硝基胺后经尿路排泄,从而造成上皮细胞的DNA损伤产生致癌作用,这种致癌效果主要局限在动物的膀胱内[8]。这两种物质的致癌作用都是通过刺激尿路上皮而产生致癌作用,所诱发的肿瘤类型均与人类相似。因此通过研究BBN和MNU的肿瘤动物模型以进一步研究膀胱癌的病因、治疗、治疗后高复发率的原因以及预防有着极其重要的作用。但是由于BBN和MNU致癌作用的途径不同,两者在构建动物模型上也各有其优缺点。
BBN造模方法简单易行,只需每日给予饮水饲养,无需对大鼠做任何侵入性的操作。因此更接近自然情况下的诱癌机制。此方法适用性广,雌、雄鼠以及裸鼠均可以采用此方法诱癌。但是由于每只大鼠对环境的适应度不同以及每只大鼠的代谢能力、摄水量亦不同,使得进入大鼠体内的药物量难以准确计算,因此成瘤率较低(本实验BBN诱癌组存活成瘤率为72.7%)。BBN需经代谢后产生N-丁基-N-(3-羧丙基)亚硝基胺从而产生致癌作用,对全身伤害性较大,尤其是对肝、肾的伤害最大,因此大鼠死亡率高。此外BBN造模时间较长,大大增加了大鼠意外死亡的发生率(本实验BBN诱癌组存活率为55%,较对照组及MNU诱癌组明显下降)。
MNU造模方法可以准确控制药物的给药剂量,且可以控制药物只局限在动物的膀胱内,而不会对大鼠除泌尿系统以外的器官产生损伤,因此大鼠存活率要明显高于BBN诱癌组(本实验MNU诱癌组存活率为90%,而BBN诱癌组存活率为55%)。因膀胱灌注后对尿道采取短时间的夹闭,药物可以在膀胱内保持一个较高的浓度,因此成瘤率较BBN组明显高且时间较短(本实验MNU诱癌组存活成瘤率为94.4%,高于BBN诱癌组)。但是MNU造模法为侵入性操作,对膀胱所产生的刺激性较大且有一定的损伤性,大鼠感染率较高。由于需要导尿,使用范围较为局限,对雄性大鼠和小鼠不适用。从超声和病理结果也可以看出MNU组肿瘤浸润程度较深,在显微镜下可发现肿瘤异型性更加明显,造模效果要优于BBN组。
大鼠造模成功后,将大鼠处死并进行病理学检查发现肿瘤组织为确定造模成功的金标准。但是研究者对大鼠进行造模的目的往往是为了进一步做一些体内实验,如向膀胱内注射化疗药物,观察抗肿瘤效果。因此这就要求我们采用非处死且准确率较高的方法来检验成瘤效果。本课题组曾采用CT扫描来鉴定大鼠的原位癌造模效果,但是CT的放射性强,对肿瘤的生物学行为可能存在一定的影响。在本实验中我们采用高频超声的方法来检测肿瘤的生长情况,经对比发现,超声可检测出膀胱内有新生物的大鼠,与病理检测结果相一致。在检测过程中我们通过不断改变探头的位置,观察膀胱壁上肿瘤的情况,可判断出肿瘤生长的具体位置以及肿瘤基底部的情况。在本实验中,超声检查可以准确判断出肿瘤浸润至膀胱壁的深度(BBN诱癌组和MNU诱癌组超声所检查出的肿瘤浸润程度与最终病理检查结果完全一致)。因此可以通过超声对大鼠膀胱癌动物模型建立的成功与否以及肿瘤的生长情况进行检测,为实验的进一步研究提供了一种简单易行且价格低廉的操作方法。
综上所述MNU造模成功率较BBN高,且时间短,降低了大鼠的意外死亡率。超声可用于大鼠原位膀胱癌造模后的活体检测,为后续研究创造了可能性。
[1] 郝捷,陈万青.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:97.
[2] 韩苏军,张思维,陈万青,等.中国前列腺癌发病现状和流行趋势分析[J].临床肿瘤学杂志,2013,18(4):330-334.
[3] Hicks RM,Wakefield JS.Rapid induction of bladder cancer in rats with N-methyl-N-nitrosourea.I.Histology[J].Chem Biol Interact,1972,5(2):139-152.
[4] Yaman O,Ozdiler E,Sozen S,et al.Transmurally absorbed intravesical chemotherapy with dimethylsulfoxide in an animal model[J].Int J Urol,1999,6(2):87-92.
[5] 潘春武,胡明明,唐小莹,等.大鼠原位膀胱癌模型的建立及CT鉴定方法[J].现代泌尿生殖肿瘤杂志,2011,3(1):29-33.
[6] Grubbs CJ,Lubet RA,Koki AT,et al.Celecoxib inhibits N-butyl-N-(4-hydroxybutyl)-nitrosamine-induced urinary bladder cancers in male B6D2F1mice and female Fischer-344rats[J].Cancer Res,2000,60(20):5599-5602.
[7] 李云,许传亮,李志华,等.两种构建大鼠膀胱癌模型方法的比较研究[J].临床泌尿外科杂志,2008,23(10):783-784.
[8] Chen T,Na Y,Wanibuchi H,et al.Loss of heterozygosity in(LewisxF344)F1rat urinary bladder tumors induced with N-butyl-N-(4-hydroxybutyl)nitrosamine followed by dimethylarsinic acid or sodium L-ascorbate[J].Jpn J Cancer Res,1999,90(8):818-823.
