改良R.E.N.A.L.评分在后腹腔镜肾部分切除术中的应用
2015-12-02欧阳松倪钊王新敏钱彪王文晓王江平王勤章丁国富
欧阳松 倪钊 王新敏 钱彪 王文晓 王江平 王勤章 丁国富
随着影像学技术的发展及体检的普及,无症状早期(T1期)肾癌诊断率逐年升高,针对肾癌的治疗,大量文献证实保留肾单位手术(nephron sparing surgery,NSS)的疗效同根治性肾切除术[1]。随着后腹腔镜技术在泌尿外科的广泛应用,目前后腹腔镜肾部分切除术(retroperitoneal laparoscopic partial nephrectomy,RLPN)已成为治疗T1期肾肿瘤的首选术式。众所周知,RLPN手术难度与肿瘤解剖学特点等多种因素关系密切,目前尚无统一的评估与比较标准。Kutikov等[2]于2009年首先提出了用于术前评估的R.E.N.A.L.评分系统,其在一定程度上可对手术难度进行客观评价,但在临床中的应用仍有一定缺陷。笔者结合多年手术经验,总结出了一套改良 R.E.N.A.L.评分系统用于评估RLPN的手术难度。本文回顾性分析了近7年来我们收治的79例RLPN患者的临床资料,分析改良评分系统预测RLPN手术难度的应用价值。
对象与方法
一、一般资料
收集2007年1月至2014年6月79例行RLPN患者的临床资料,其中男51例,女28例,左侧42例,右侧37例,平均年龄(54.3±12.0)岁,平均BMI值(25.8±3.8)kg/m2,平均肿瘤直径(3.7±1.5)cm,肿瘤边缘离集合系统平均最近距离(5.7±2.3)mm。79例中无症状者67例,患侧不同程度腰痛9例,肉眼血尿者3例,所有患者术前均行增强CT或MR检查,79例患者的手术均由同一主刀医师完成。
二、研究方法
收集研究对象病理及影像学资料,围手术期数据包括热缺血时间、术中失血量、手术时间、术后并发症、术后住院时间及围手术期血清肌酐水平等。通过CT或 MR进行R.E.N.A.L.评分(表1)和改良R.E.N.A.L.评分(表2)。通过分析改良R.E.N.A.L.评分系统与围手术期结局的关系,比较两组评分系统对手术难度评估的灵敏度、特异度和约登指数等。
三、手术方法
参见文献[3]。
四、统计学方法
采用Epidata 3.1建立数据库,用SPSS 22.0进行分析,其中计量资料用±s,计数资料用百分率表示。计量资料采用单因素方差分析,多个样本均数两两比较采用SNK检验,以P<0.05为差异有统计学意义。

表1 R.E.N.A.L.评分系统

表2 改良R.E.N.A.L.评分系统
结 果
79例RLPN均顺利完成,无中转根治或开放手术,其中2例患者术后伤口出现漏尿,1例转外院治疗,1例留置导尿管及双J管加强引流2个月后症状消失,余无其他严重并发症。两组评分结果见表3,79例患者,未改良评分系统中低分组42例,中分组28例,高分组9例;改良评分系统中各组例数分别为31、32和16例;实际分组分别为38、28和23例。统计发现改良评分系统对手术难度的评判结果与手术时间、热缺血时间、术中出血量之间存在显著关系(P<0.05)(表4),但与患者的住院时间无明显相关性(P>0.05),而仅2例患者术后出现严重并发症,故暂时无法评估改良评分系统与手术并发症之间的关系。进一步将两套评分系统对手术难度的灵敏度、特异度和约登指数加以比较(表5),结果发现改良R.E.N.A.L.评分系统对手术难度评价临床效果更好。

表3 两种评分方法对手术难度评估的结果(例)
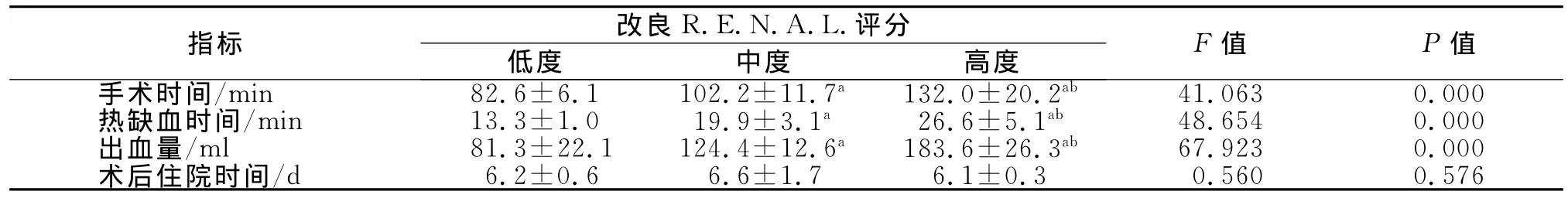
表4 改良R.E.N.A.L.评分系统与围手术期结局的相关分析

表5 两套评分系统评分结果敏感度、特异度、约登指数
讨 论
随着腹腔镜技术在泌尿外科的广泛应用,RLPN已成为T1期特别是T1a期肾肿瘤的主流术式,但手术难度较腹腔镜根治手术及传统开放手术均有所增加,而如何在术前对手术难度做出准确评估,指导术式选择、降低手术风险和优化团队协作及评估腹腔镜医师技术水准是目前亟需解决的问题。早在2009年Ficarra等[4]提出用PAUDA评分系统来进行术前评价肾癌肾部分切除的手术程度,随后,Kutikov等于同年提出了R.E.N.A.L.评分系统用于肾肿瘤的量化评分,另外,Simmons等[5]也于2010年提出C-Index用于描述肾肿瘤定位,但目前国内外对此类研究均较少。
R.E.N.A.L.评分系统将肾肿瘤最大径、外/内生比例、与集合系统距离腹/背侧、与肾脏纵轴位置的关系等五个方面进行量化评分,按分值将手术难度分为低、中、高三个手术难度等级。该评分系统简单易行,术前只需根据相关影像学资料(CT或MR)即可准确得出分数。有研究表明[6-9]R.E.N.A.L.评分系统与手术方式的选择、术中热缺血时间、是否中转根治及围手术期结局相关。但无论是PAUDA、R.E.N.A.L.或C-Index评分系统都不是针对RLPN而制定的。随着RLPN的广泛应用,术前对手术复杂程度的准确评估对医患而言均尤为重要。我科在多年后腹腔镜手术经验的基础之上,根据RLPN路径的解剖、视野、操作特点等对原R.E.N.A.L.评分进行了适当改良,改良体现在以下几个方面。
一、肿瘤最大径(Radius)
2010年EAU指南[10]将保留肾单位手术作为治疗低分期(T1N0M0期)特别是T1aN0M0肾癌的金标准,并强调尽可能在腹腔镜下完成,同时指出只要肿瘤完整切除,切缘厚度并不影响肿瘤局部复发率。一项Meta分析[11]表明对T1b期肾癌行肾部分切除术也是一种有效和可靠的治疗方法,而对T2期行保留肾单位手术尚未达成共识,目前国内只有少数报道[12]。但是如果肿瘤位置及其与肾蒂血管毗邻关系良好,T2期肾癌并非不能选择肾部分切除术,但是其术后的肿瘤控制和远期复发、生存率等仍需大样本数据支持。由于R.E.N.A.L.评分系统并非针对RLPN设置,原肿瘤最大径跨度较大,于后腹腔镜狭小空间及较长的学习曲线而言,相应下调最大径数值可能更符合RLPN的临床手术特点。
二、BMI
BMI高者腹膜外及肾周脂肪较多,术中游离及暴露肾肿瘤及肾动脉的时间明显增加,且术中更易出血而影响视野,从而延长手术时间,增加手术难度,因此将BMI加入R.E.N.A.L.评分系统可更客观评价手术难度。另肥胖与高血压、糖尿病等有着密切关系,高血压及糖尿病患者常有腹部脂肪堆积现象[13-15],但对于后腹腔的影响无明确研究且无具体量化分值标准,因此未纳入改良系统,在今后的应用中我们将做进一步研究。
三、肾动脉支数
正常肾动脉左右各一支,但少数患者可有2支甚至以上动脉,RLPN关键在于完整切除肿瘤、缩短肾脏热缺血时间、完善缝合技术并避免出血,而两支肾动脉必然加大手术难度,因此,我们建议对于肾肿瘤患者常规行肾脏CT动脉造影了解肾动脉走形及分支情况,术中可准确游离出肾动脉并限时阻断。我们的79例患者中有11例患者为双支动脉,早期有2例患者未行肾动脉造影,术中未能及时阻断分支肾动脉导致术中出血量较多从而严重影响术野,同时热缺血时间延长,加大了手术风险并影响术后肾功能恢复,因此加入肾动脉支数更符合临床实际。
四、后腹腔方位(Azimuth)、外生程度(Exotic)及生长部位(Location)
腹膜后空间暴露有限,肾肿瘤在后腹腔镜位置及生长部位将极大影响手术进度,由于肾脏为腹膜后位器官,而原R.E.N.A.L.评分系统对于肿瘤生长部位和类型仅以外生/内生比例设置分值,而对于肾肿瘤位于腹/背侧也只以参数描述,这显然不符合腹膜后解剖环境,对此,我们以Brodel线为界进行改良,以肿瘤位置位于Brodel线内外侧设置分值,同时,取消外生/内生比例,直接以50%外生程度及完全内生型设置分值档,并且使用肾脏上中下极直接作为肿瘤生长部位(Location)评分标准,同时保留肿瘤距离集合系统距离。经此改良的R.E.N.A.L.评分系统不仅评分更加简化,更易接近后腹腔环境,可更客观量化评价RLPN手术难度。
目前国际上对RLPN的手术难度尚无统一的比较方法,本研究统计发现改良评分系统对手术难度的评判结果与手术时间、热缺血时间、术中出血量之间存在显著关系。我们又进一步将两套评分系统对手术难度的灵敏度、特异度和约登指数加以比较,结果发现改良评分系统对手术难度评价临床效果更好,这可能是因为改良后R.E.N.A.L.评分系统更接近于后腹腔镜操作环境,更符合RLPN的特点,对手术复杂程度的评估效能更高,但对于具体的量化指标尚无统一标准,因此我们亦希望能在今后的临床工作中不断积累经验,从而更准确评估临床实际应用。
综上所述,改良R.E.N.A.L.评分更加符合后腹腔镜手术环境,使用更加简化,且可更客观量化评估RLPN风险及手术难度,值得在临床上进一步推广及完善,但仍需要多中心、大样本研究进一步支持。
[1] Russo P,Huang W.The medical and oncological rationale for partial nephrectomy for the treatment of T1renal cortical tumors[J].Urol Clin North Am,2008,35(4):635-643.
[2] Kutikov A,Uzzo RG.The R.E.N.A.L.nephrometry score:a comprehensive standardized system for quantitating renal tumor size,location and depth[J].J Urol,2009,182(3):844-853.
[3] 张旭,李宏召,马鑫,等.后腹腔镜保留肾脏手术治疗肾肿瘤[J].中华泌尿外科杂志,2005,26(3):160-162.
[4] Ficarra V,Novara G,Secco S,et al.Preoperative aspects and dimensions used for an anatomical(PADUA)classification of renal tumours in patients who are candidates for nephron-sparing surgery[J].Eur Urol,2009,56(5):786-793.
[5] Simmons MN,Ching CB,Samplaski MK,et al.Kidney tumor location measurement using the C index method[J].J Urol,2010,183(5):1708-1713.
[6] Canter D,Kutikov A,Manley B,et al.Utility of the R.E.N.A.L.nephrometry scoring system in objectifying treatment decision-making of the enhancing renal mass[J].Urology,2011,78(5):1089-1094.
[7] Long JA,Arnoux V,Fiard G,et al.External validation of the RENAL nephrometry score in renal tumours treated by partial nephrectomy[J].BJU Int,2013,111(2):233-239.
[8] 廖勇,黄建林,安宇,等.R.E.N.A.L.肾脏测量评分系统在保留肾单位手术中的应用[J].现代泌尿外科杂志,2013,18(3):223-227.
[9] 张中元,唐琦,李学松,等.R.E.N.A.L.肾肿瘤评分系统用于保留肾单位手术的临床分析[J].北京大学学报:医学版,2012,44(4):539-543.
[10] Ljungberg B,Cowan NC,Hanbury DC,et al.EAU guidelines on renal cell carcinoma:the 2010update[J].Eur Urol,2010,58(3):398-406.
[11] 郑殿宇,王勤章,丁国富,等.肾部分切除术和肾癌根治术治疗T_(1b)期肾癌疗效比较的 Meta分析[J].现代泌尿外科杂志,2013,18(4):342-346.
[12] 夏丹,孟宏舟,陈戈明,等.腹腔镜肾部分切除术治疗T2期肾癌25例临床分析[M]//2012浙江省医学会男科学、泌尿外科学术年会论文汇编.浙江:2012
[13] 王铭梁,祝安惠,姚丹,等.同龄组1型糖尿病患者与正常人腹部脂肪分布的CT对比研究[J].中国临床医学影像杂志,2014,25(4):279-281.
[14] 魏凌.高血压合并糖尿病患者腹部脂肪的分布[J].继续医学教育,2009,23(6):46-48.
[15] 韩培学.原发性高血压患者内脏脂肪分布的相关性研究[J].临床合理用药杂志,2014,7(29):82-83.
