男性膀胱癌术后复发的多因素分析
2015-12-02郑昱张龙龙叶永利魏迪闫飞袁建林
郑昱 张龙龙 叶永利 魏迪 闫飞 袁建林
膀胱癌是泌尿系统最常见的恶性肿瘤之一,2012年统计数据表明男性膀胱癌发病率在美国排第4位[1],而在我国男性膀胱癌发病率居全身恶性肿瘤的第7位[2]。目前依据不同的病理分期选择适当的手术方式,术后给予辅助治疗是膀胱癌治疗的主要方法,但是术后复发是膀胱癌临床的主要特点之一,预防膀胱癌术后复发也成为困扰临床医生的主要问题之一。国内外关于膀胱癌术后复发危险因素的研究很多,但针对男性膀胱癌患者术后复发的相关危险因素研究国内尚未见报道,为此,我们收集了我院2010年1月至2014年12月收治的男性膀胱癌术后患者的病例资料,回顾性分析并讨论其临床特点对男性膀胱癌术后复发的影响。
对象与方法
一、研究对象
2010年1月至2014年12月期间在西京医院泌尿外科就诊的男性膀胱癌患者共72例,所有患者均在入院前5年内经病理明确诊断为膀胱尿路上皮癌,本次入院第一诊断为膀胱癌术后复发。入组患者最小年龄36岁,最大者81岁,平均年龄(60.81±12.58)岁。排除条件:女性膀胱癌患者;诊断为膀胱转移瘤患者;有其他恶性肿瘤的患者;膀胱非尿路上皮癌。
二、研究方法
1.基线资料统计:包括患者的发病年龄、血型、吸烟史等。
2.首次发病时资料统计:包括膀胱癌组织分级(依据2004WHO分级标准);肿瘤病理分期(依据UICC2009年第七版的TNM分期法);单发或多发病灶;手术方式(经尿道膀胱肿瘤切除术、膀胱部分切除术以及根治性膀胱切除术);术后是否规律使用辅助治疗(膀胱灌注化疗或放疗)。
3.复发时资料统计:包括术后吸烟情况;首次复发时年龄、复发时间;复发时症状(血尿、尿频、尿急、排尿困难、夜尿以及下腹疼痛);复发病灶数;是否原位复发;复发时肿瘤是否进展。
三、统计学方法
采用SPSS 21.0分析软件建立数据库,通过Kruskal-Wallis H法对各变量指标间的中位无肿瘤生存期(disease free survival,DFS)进行非参数检验,阳性者使用Log-rank法进行单因素分析,分析其对DFS的影响,并使用Kaplan-Meier法绘制生存曲线,对具有统计学意义的变量进行COX回归多因素分析,求得各变量P值、OR值及其95%CI,筛选影响膀胱癌术后复发的危险因素。以P<0.05为差异有统计学意义。
结 果
入组72例患者中,平均首次发病年龄(60.81±12.58)岁,平均首次复发年龄(63.19±11.91)岁,最短DFS为1个月,最长DFS为204个月,中位DFS为12个月(95%CI10.347~13.653)。1年内复发患者40例,1年复发率55.6%,2、5年内复发患者分别为53、63例,复发率分别为73.6%、87.5%。
通过Kruskal-Wallis H检验可知,男性膀胱癌术后DFS各组间差异有统计学意义的指标包括首次发病年龄、术前吸烟史、肿瘤病理分级、肿瘤病理分期以及复发时临床症状(表1)。对上述变量使用Log-rank法进行单因素分析,分析其对DFS的影响(表2)。
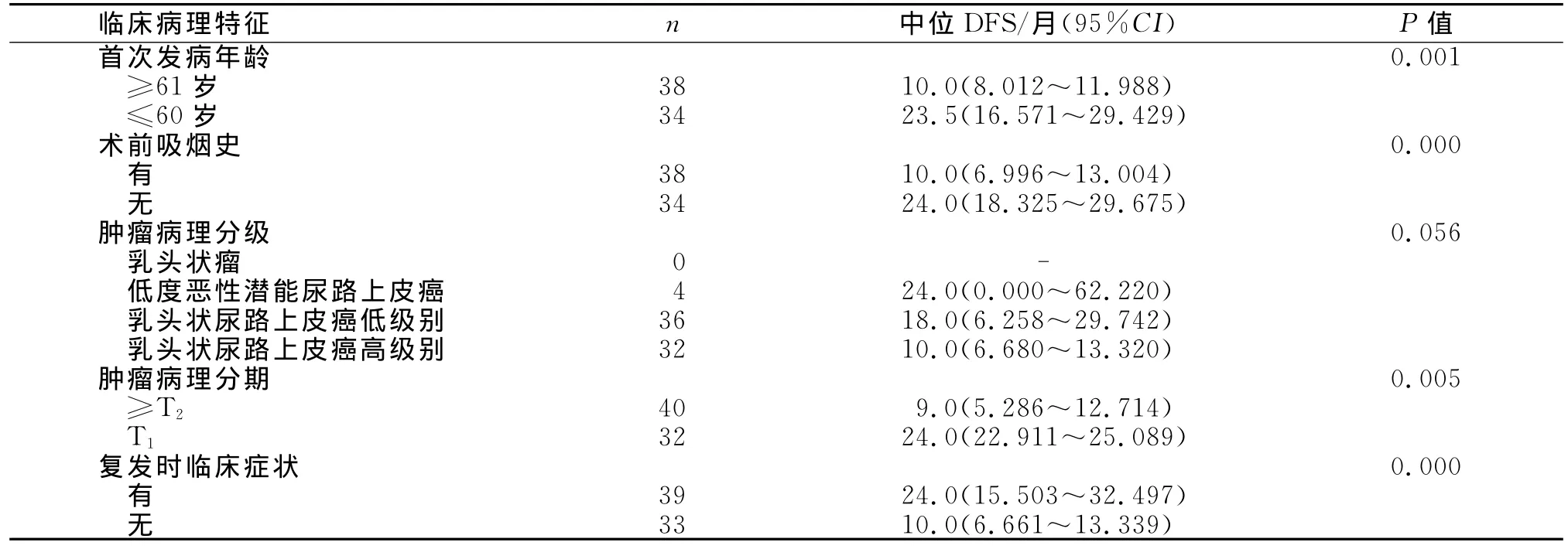
表2 男性膀胱癌术后复发临床病理指标Log-rank单因素分析
肿瘤病理分级分组Log-rank分析结果P=0.056,因此,统计学上尚不能认为肿瘤病理分级与术后DFS相关。对阳性变量使用Kaplan-Meier法绘制生存曲线(图1),各组生存曲线明显分离,差异有统计学意义,可以认为上述因素和男性膀胱癌术后DFS相关。
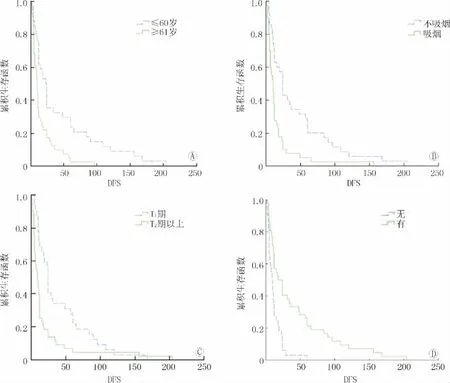
图1 各分组变量DFS生存曲线(Kaplan-Meier法)
将单因素分析得到的与DFS相关的危险因素,以及具有边缘意义的变量-肿瘤病理分级(P=0.056)进行多因素COX回归分析,提示首次发病年龄≥61岁、术前有吸烟史、病理分期≥T2期及复发时无症状为男性膀胱癌术后复发的独立危险因素,而肿瘤病理分级与男性膀胱癌术后复发不相关(P=0.475)。各组间OR值、95%CI及P值见表3。
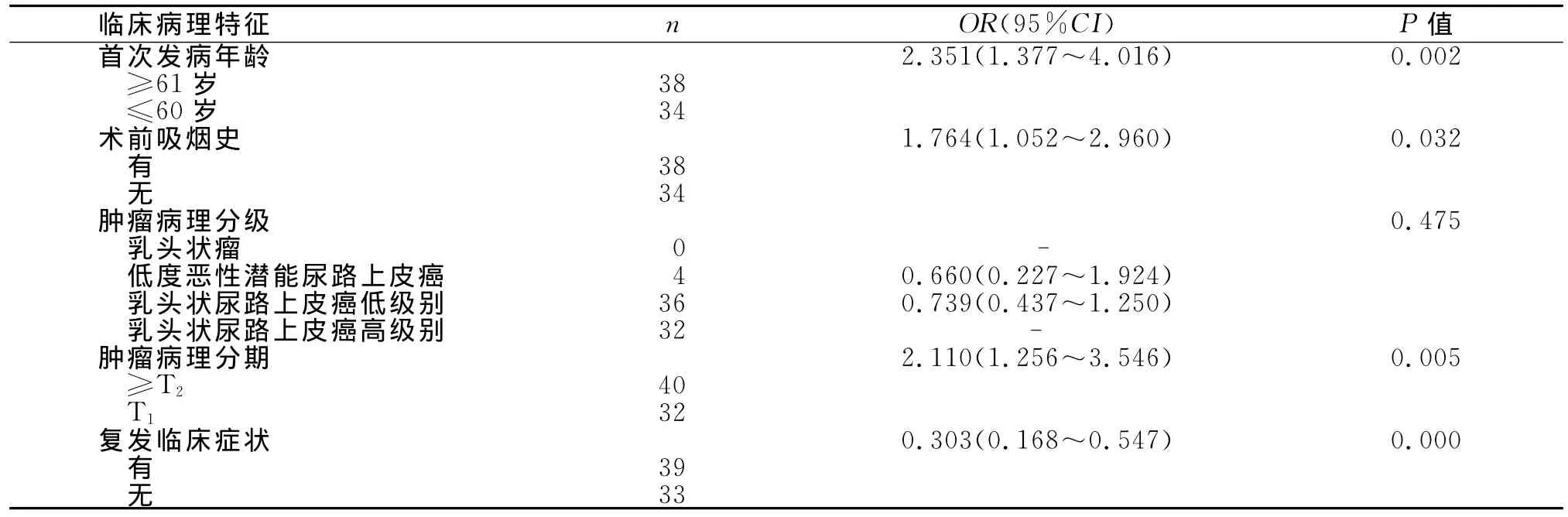
表3 男性膀胱癌术后复发临床病理指标的COX多因素分析
按照多因素COX回归分析的结果,将4种危险因素即发病年龄≥61岁、术前有吸烟史、肿瘤病理分期T2期以上及复发时无症状各定为1分,将所有患者重新评分,0分为低危组,1~2分为中危组,3~4分为高危组,各组间患者中位DFS比较,存在差异(表4)。

表4 危险评分各组间DFS的比较
讨 论
膀胱癌是泌尿系统三大肿瘤之一,2008年全球范围内的流行病学调查显示发达国家男性发病率为女性的4.5倍[3];我国2009年全国范围内的流行病学调查数据表明,男性膀胱癌发病率为女性的2.4倍[2],并且仍有上升的趋势。术后复发是膀胱癌的主要特征之一,目前国内外关于膀胱癌术后复发危险因素预测的基础研究较多,包括对UNC5C、P53、Bcl-2、MDM2、B7-H1、CA9、BCA7等[4-9]的研究,但目前仅有少数可应用于临床。为此我们对临床可能与膀胱癌术后复发相关的15组变量进行非参数假设检验,再通过单因素的分析进一步验证结果,有意义的指标包括首次发病年龄、术前吸烟史、肿瘤病理分期以及复发时临床症状,但肿瘤的复发毕竟是多方面因素共同作用的结果,因此我们又进行了多因素COX回归分析。
数据表明,首次发病年龄≥61岁患者术后发生肿瘤复发的风险为首次发病年龄≤60岁患者的2.4倍。膀胱癌术后复发与年龄相关的机制目前尚不清楚,笔者认为膀胱癌患者发病年龄越大其病理分级及病理分期就可能越高,侵袭性也就越强。此外,男性膀胱癌术后复发与年龄相关也从侧面反映出肿瘤复发不仅和肿瘤本身有关,也和机体自身的免疫抗肿瘤机制相关。
关于吸烟,相关研究[10]已明确表明是膀胱癌发病的首要危险因素,我们的研究表明术前有吸烟史术后复发的风险为无吸烟史患者的1.8倍,而术后是否吸烟似乎对膀胱癌的复发无影响,其可能的原因为一部分患者术前吸烟史较长,即使术后戒烟,先前所存在的积累效应也不能被去除。Rink等[11]认为吸烟是膀胱癌术后复发的危险因素之一,而这种危险的消除需要10年的戒烟时间,而本组所有患者术后1年内复发的为40例(55.6%),中位DFS为12个月(95%CI10.347~13.653),因此术后吸烟所产生的影响较小。
本研究数据表明不同病理分级组间的DFS有差异,而单因素分析中位DFS差异无统计学意义(P=0.056),但对于这种趋于边缘的指标,为了减小偏倚,将其也纳入多因素分析,结果显示肿瘤病理分级与中位DFS无显著相关性(P=0.475),可能由于样本中无乳头状瘤分级患者,低度恶性潜能尿路上皮癌患者也仅有4例,而相对于其他分级,此两种分级肿瘤生长力及侵袭力相对较弱,高分级的膀胱肿瘤则具有较高的浸润风险。有研究认为膀胱癌的分级与患者的预后相关,这些研究的数据多基于非肌 层 浸 润 膀 胱 癌 (non muscle-invasive bladder caner,NMIBC)行经尿道膀胱肿瘤切除术(trasnurethral resection of bladder tumor,TUBRT)的患者,而本研究数据包含肌层浸润膀胱癌行根治性或部分切除术患者,因此,不能认为本研究结果和上述研究[12-14]相矛盾,可以认为是一种补充。关于病理分期预后的研究国内外也较多,Yuan等[15]的Meta分析表明低的病理分期(Tis、Ta、T1)是术后复发的危险因素,但Yuan等认为由于病理分期较高的患者往往术后存活时间较短,但死亡后的患者又被计入未复发组,因此结果偏倚较大。本研究分析则认为病理分期T2以上是术后复发的危险因素,复发风险为T1期患者的2.1倍,这样的结果不仅和高分期肿瘤侵袭力强相关,同时还可能和膀胱癌手术治疗方式相关。治疗膀胱癌手术方式的选择往往要依据病理分期及病理分级,但对于病理分期的侧重较病理分级更大些,其中对NMIBC多使用TUBRT辅以术后即刻灌注及维持灌注化疗,而对于肌层浸润膀胱癌多采取根治性切除(radical cystectomy,RC)加尿道改流术。但RC并发症多,且患者术后生活质量较差,许多患者不愿意接受,使得许多T2期以上的肿瘤也采取了TUBRT治疗。TUBRT的弊端在于无法判断肿瘤组织是否完全切除,因此无疑增加了术后复发的风险。
关于术后复发时有无症状,学者们存在争议,Volkmer等[16]认为复发时有症状和无症状的患者总生存期无明显差异,而Boorjian等[17]的研究认为术后无症状组因为严密的随访较有症状组获得更长的生存时间,认为是膀胱癌术后生存的保护因素。本研究结果恰恰显示复发时无症状是与DFS相关的危险因素,分析原因可能是:①手术后没有症状的患者随访较严密,利于较早发现新的复发病灶,而复发时有症状的患者相对依从性差,等到出现症状时才就医,因此不利于对复发病灶的发现,从而获得相对较长的DFS;②复发时合并症状与肿瘤进展有关,虽然肿瘤细胞侵袭性较强,但复发并进展相对于单纯复发需要较长的时间。因此,我们的结果与Boorjian等的研究并不矛盾,术后严密的随访会给膀胱癌患者带来较好的收益。Mitra等[18]对202 9例膀胱癌患者进行了12年的随访,也认为术后出现症状前密切的随访对提高患者的生存是有益的。
通过运用以上危险因素重新将患者分为低危、中危和高危组,各组间中位DFS有明显差异,因此可以应用此评分系统指导临床男性膀胱癌术后复发的风险评估。首次发病年龄≥61岁、术前有吸烟史、病理分期≥T2期及复发时无症状为男性膀胱癌术后复发的独立危险因素。对于存在上述危险因素的男性膀胱癌患者应加强教育,告知患者的复发风险,嘱患者长期规律随访,为预防复发及复发后的早期治疗取得时机,进一步提高膀胱癌患者的治愈率和治疗效果。本研究为了减少偏倚,在最初纳入样本时对12例女性患者进行了剔除,这也成为我们研究的一个特点,本研究是全国范围内首次对男性膀胱癌患者术后复发危险因素进行评估,但单中心回顾性研究数据有限,相关结论还需多中心、前瞻性的研究加以证实。
[1] Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA:Cancer J Clin,2012,62(1):10-29.
[2] 那彦群,叶章群,孙颖浩,等.中国泌尿外科疾病诊断治疗指南[M].2014版.北京:人民卫生出版社,2013:20-60.
[3] Ferlay J,Shin H,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[4] Yap KL,Kiyotani K,Tamura K,et al.Whole exome sequencing of muscle-invasive bladder cancer identifies recurrent mutations of UNC5Cand prognostic importance of DNA repair gene mutations on survival[J].Clin Cancer Res,2014.20(24):6605-6617.
[5] Gakis G,Schwentner C,Todenhofer T,et al.Current status of molecular markers for prognostication and outcome in invasive bladder cancer[J].BJU Int,2012,110(2):233-237.
[6] Pfister C,Moore L,Allard P,et al.Predictive value of cell cycle markers p53,MDM2,p21,and Ki-67in superficial bladder tumor recurrence[J].Clin Cancer Res,1999,5(12):4079-4084.
[7] Golestani EB,Sanati MH,Houshmand M,et al.Expression and prognostic significance of bcl-2and bax in the progression and clinical outcome of transitional bladder cell carcinoma[J].Cell J,2014,15(4):356-363.
[8] 杨青壮,杨金瑞.B7-H1和CA9在膀胱尿路上皮癌中表达的临床意义[J].现代泌尿生殖肿瘤杂志,2012,4(4):216-218.
[9] 吴雄辉,余祖虎,来永庆,等.膀胱癌高表达基因BCA7与其预后的相关性研究[J].现代泌尿生殖肿瘤杂志,2014,6(1):37-41.
[10] Besaratinia A,Tommasi S.Genotoxicity of tobacco smoke-derived aromatic amines and bladder cancer:current state of knowledge and future research directions[J].FASEB J,2013,27(6):2090-2100.
[11] Rink M,Zabor EC,Furberg H,et al.Impact of Smoking and Smoking Cessation on Outcomes in Bladder Cancer Patients Treated with Radical Cystectomy[J].Euro Urol,2013,64(3):456-464.
[12] 许天源,朱照伟,钟山,等.EORTC风险量表对非肌层浸润性膀胱癌术后即刻灌注化疗预后判断的研究[J].临床泌尿外科杂志,2013,28(7):504-508.
[13] 王兴,崔曙,朱平宇,等.非肌层浸润性膀胱尿路上皮癌预后的多因素Cox回归分析[J].临床泌尿外科杂志,2014,29(10):878-881.
[14] Liu S,Hou J,Zhang H,et al.The evaluation of the risk factors for non-muscle invasive bladder cancer(NMIBC)recurrence after transurethral resection(TURBt)in Chinese population[J].PLoS One,2015,10(4):e0123617.
[15] Yuan H,Chen X,Liu L,et al.Risk factors for intravesical recurrence after radical nephroureterectomy for upper tract urothelial carcinoma:A meta-analysis[J].Urol Oncol,2014,32(7):989-1002.
[16] Volkmer BG,Kuefer R,Bartsch GJ,et al.Oncological followup after radical cystectomy for bladder cancer-is there any benefit?[J].J Urol,2009,181(4):1587-1593.
[17] Boorjian SA,Tollefson MK,Cheville JC,et al.Detection of asymptomatic recurrence during routine oncological followup after radical cystectomy is associated with improved patient survival[J].J Urol,2011,186(5):1796-1802.
[18] Mitra AP,Alemozaffar M,Harris BN,et al.Outcomes after urothelial recurrence in bladder cancer patients undergoing radical cystectomy[J].Urology,2014,84(6):1420-1426.
