UHRF1、Ki-67蛋白在结肠癌中的表达及预后分析
2015-12-02艾晓晴贾喜花王晓博郑淑君
艾晓晴,贾喜花,王晓博,郑淑君,赵 霞
(保定市第一中心医院,河北保定071000)
泛素样含PHD和环指域1(ubiquitin-like with PHD and ring finger domains 1,UHRF1)是最新发现的一种与细胞生长有关的核蛋白基因,参与了细胞增殖、周期调控、凋亡及放射敏感性等重要的生物学过程。最近的研究表明,UHRF1在调控细胞的增殖及细胞周期G1/S的转换中起到重要的作用[1-2],UHRF1蛋白在静止的细胞中表达较低,而在增殖的细胞中表达明显增加[3]。Ki-67蛋白是与细胞分裂增殖有关的一种蛋白,Ki-67在细胞内表达上与UHRF1相似,也在静止期细胞不表达,而在增殖细胞中广泛表达。结肠癌是最常见的消化道恶性肿瘤之一,其发病率呈逐年上升的趋势,本文旨在研究UHRF1和Ki-67在结肠癌组织中的表达情况及其两种蛋白的相关性,并探讨其临床意义及预后价值。
1 材料与方法
1.1 组织标本
收集2011年1月~2012年12月保定市第一中心医院外科手术切除并经病理诊断的原发性结肠癌组织70例,均为腺癌。男38例,女32例,年龄28~83岁,中位年龄60岁,术前均未行放、化疗及生物靶向治疗等,按美国癌症联合会(AJCC)制定的TNM病理分期标准:Ⅰ~Ⅱ期49例,Ⅲ~Ⅳ期21例。高分化29例,中分化31例,低分化10例。取癌旁正常组织标本30例(距肿瘤边缘>5cm的正常组织)。
1.2 试剂
鼠抗人UHRF1单克隆抗体(1∶150稀释,购自美国Abcam公司);兔抗人Ki-67单克隆抗体(1∶100稀释,购自美国Abcam公司);通用免疫组织化学SP试剂盒和DAB显色试剂购自福州迈新生物技术开发有限公司。
1.3 免疫组化的方法
应用免疫组织化学方法,采用EnVision二步法,以PBS替代一抗作为阴性对照。将组织石蜡切片置于65℃烤箱中烤2h,常规脱蜡至水,用蒸馏水洗两次,室温孵育。30%H2O2室温孵育15min,以消除内源性过氧化物酶的活性,蒸馏水冲洗,PBS浸泡5min。高压抗原修复:将切片浸泡在枸橼酸盐缓冲液中,用不锈钢压力锅进行抗原修复,待不锈钢压力锅喷气时,计时2~3min,PBS冲洗,5min×3次。滴加鼠抗人UHRF1单克隆抗体(用PBS液按1∶150)稀释,4℃孵育过夜;PBS冲洗,5min×3次;滴加HRP标记二抗工作液50μl,室温孵育60min;PBS冲洗,5min×3次,DAB显色试剂盒显色,显微镜下观察,用蒸馏水洗涤终止显色反应,苏木素复染,1%酒精盐酸分化,自来水返蓝,蒸馏水洗涤,脱水、透明、封片。Ki-67染色免疫组化方法同上。
1.4 免疫组化结果的判断
评价标准各组染色切片在双盲情况下由两名病理科资深医师观察评价结果。UHRF1阳性结果判定[4]:UHRF1阳性染色细胞构成比为0评为0分,>0~25%为1分,≥25%~50%为2分,≥50%~75%为3分,≥75%为4分。无阳性着色为0分,浅黄色染色为1分,浅黄色和棕黄色之间染色为2分,深黄色染色为3分。以上2项的乘积做为最终评分,0分为阴性(-),1~4分为弱阳性(+),5~8分为中等阳性(++),9~12分为强阳性(+++)。Ki-67阳性结果判定[5]:Ki-67增殖指数(PI)值计算:Ki-67以肿瘤细胞核染色为阳性,在高倍镜(×400)下选取10个视野计算。Ki-67 PI值=(阳性肿瘤细胞数/总瘤细胞数)×100%,<10%为阴性,≥10%为阳性。UHRF1主要定位于细胞质和细胞膜(图1),Ki-67主要定位于细胞核(图2)。

图1 UHRF1在结肠癌中的表达(SP×400)Figure 1 Expression of UHRF1 in colon cancer

图2 Ki-67在结肠癌中的表达(SP×400)Figure 2 Expression of Ki-67 in colon cancer
1.5 随访
参阅患者在本院住院病历整理生存资料,不在本院进行手术后续治疗者,电话询问患者家属并整理患者生存资料。随访开始时间为术后第1天,末次随访或死亡时间以月为计量单位,随访至2015年2月。随访时间1~50个月,无失访。
1.6 统计学方法
采用SPSS19.0进行统计分析,计数资料采用χ2检验和独立两样本t检验,相关性行Spearman等级相关分析,应用Kaplan-Meier方法进行生存曲线的描绘,中位生存时间用非参数检验,以P<0.05为差异有统计学意义。
2 结果
2.1 UHRF1、Ki-67在结肠癌中及其癌旁组织中的表达
UHRF1在结肠癌中的阳性表达率为87.1%(61/70),高于癌旁正常组织 56.7%(17/30),差异有统计学意义(P<0.05)。Ki-67在结肠癌中的阳性表达率为67.1%(47/70),高于癌旁正常组织26.7%(8/30),差异有统计学意义(P <0.05),见表1。
2.2 UHRF1、Ki-67表达与结肠癌患者临床病理特征的关系
UHRF1和Ki-67在结肠癌中的表达均与患者性别、年龄、肿瘤大小、分化程度无关,差异无统计学意义(P>0.05),而与TNM分期、浸润深度及淋巴结转移有一定相关性,TNM分期越晚,浸润深度越深,它们阳性表达率越高,出现淋巴结转移的结肠癌组织中,UHRF1、Ki-67阳性表达率均高于无转移者,差异有统计学意义(P <0.05),见表2。
2.3 UHRF1、Ki-67的表达在结肠癌中的关系
经Spearman相关分析可得,在结肠癌中UHRF1和Ki-67的表达呈正相关(r=0.367,P=0.002),见表 3。
2.4 UHRF1、Ki-67的表达与患者预后的关系
Kaplan-Meier生存曲线分析结果显示,UHRF1阴性 3年生存率为 55.56%,UHRF1阳性和UHRF1、Ki-67 均阳性分别为 24.59% 和 24.44%,UHRF1阳性表达患者和UHRF1、Ki-67均阳性者3年生存率明显较阴性者低(P=0.041,P=0.028),差异有统计学意义,UHRF1、Ki-67均阳性表达患者的3年生存率比单独UHRF1阳性表达者低(P=0.492),但差异无统计学意义,见图3。图中亦可得知,UHRF1阴性患者的中位生存时间为37.33个月,UHRF1阳性者为 24.49 个月,UHRF1、Ki-67 均阳性者为 22.71个月,UHRF1阳性表达患者和UHRF1、Ki-67均阳性者中位生存时间明显较阴性者短(P=0.007,P=0.004),差异有统计学意义,UHRF1、Ki-67均阳性表达患者的中位生存时间比单独UHRF1阳性表达者短(P=0.533),但差异无统计学意义。

表1 UHRF1和Ki-67在结肠癌和癌旁正常组织中的表达Table 1 UHRF1,Ki-67 expressions in colon cancer and normal colon tissue

表2 UHRF1和Ki-67表达与结肠癌患者临床病理特征的关系Table 2 UHRF1,Ki-67 expressions and clinicopathologic features in colon cancer

表3 UHRF1和Ki-67表达在结肠癌的关系Table 3 Correlation of UHRF1,Ki-67 expressions in colon cancer
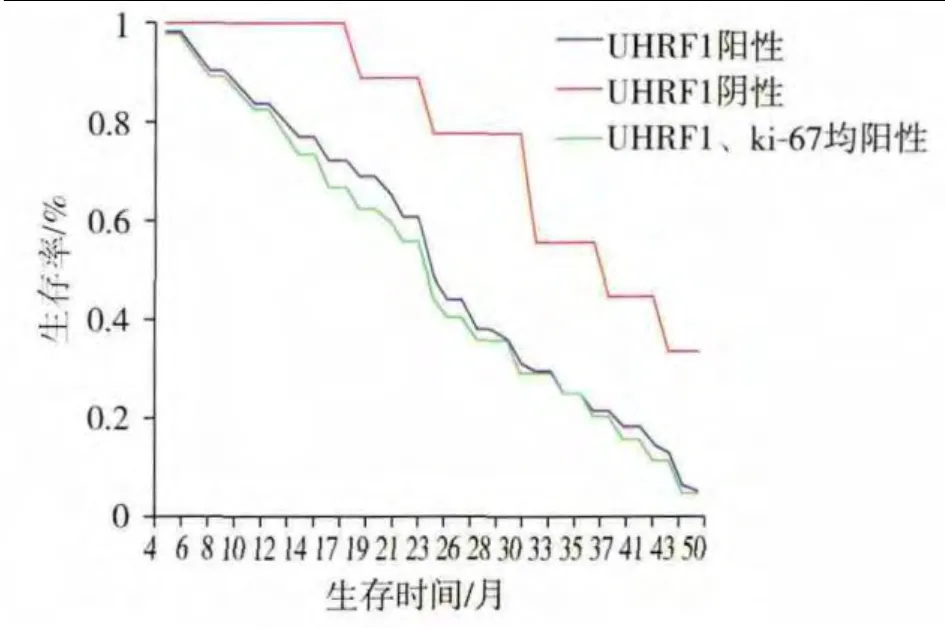
图3 UHRF1和Ki-67表达与生存率的关系Figure 3 Relationship between expression of UHRF1,Ki-67 and survival rate
3 讨论
表观遗传学是近些年来迅速发展的一门新兴遗传学分支学科,它研究在不涉及核苷酸序列改变的情况下,基因产生了可遗传变化的生物学现象。其中组蛋白修饰和DNA甲基化是表观遗传学的两个重要研究内容,它们在基因表达、X染色体失活、细胞调控、胚胎发育以及肿瘤发生等多方面都发挥重要的作用。UHRF1是近些年来表观遗传研究的热点蛋白之一,在DNA甲基化的维持方面起重要作用。人UHRF1蛋白含有793个氨基酸并包括一个类泛素(ubiquitin-like)模式、一个亮氨酸拉链模式(leucine zipper motif)、锌指模式(zinc finger motif)、一个eyelinA/E-CDK2磷酸位点、一个RB结合部位和一个指状构造[6-7]。随着对细胞周期调控的分子机制的深入研究发现,癌症实际上是一类细胞周期调控异常所致的疾病,尤其是细胞周期G1/S调控的异常[8]。最近的研究表明,UHRF1在调控细胞的增殖及细胞周期G1/S的转换中起到重要的作用[1-2]。UHRF1蛋白在静止的细胞中表达较低,而在增殖的细胞中表达明显增加[3]。增殖旺盛的肿瘤组织中UHRF1过表达,其包括的SRA结构域与DNA甲基转移酶 1(DNA methyltransferase 1,DNMT1)结合,使DNA甲基化,可抑制p16INK4、hMLH1、BRCA1和RB1等多种抑癌基因表达[9]。
UHRF1在乳腺癌、膀胱癌以及前列腺癌等肿瘤细胞中异常高表达,与肿瘤的浸润和转移密切相关[10-12]。有研究证实了UHRF1表达水平与肿瘤的分化程度、TNM分期、是否淋巴结转移和是否远处转移密切相关,而与年龄和性别无关[4]。Raksha[13]等研究发现,UHRF1蛋白过表达与肝癌细胞的恶性表型如肿瘤大小、分化程度和微血管侵犯有关,UHRF1表达还与肿瘤的分级和分期有关。本实验通过免疫组化的方法检测显示,UHRF1在结肠癌中的表达均明显高于癌旁正常组织(P<0.05)。TNM分期越晚,浸润深度越深,它们阳性表达率越高,出现淋巴结转移的结肠癌组织中,UHRF1、Ki-67阳性表达率均高于无转移者,表明二者的阳性表达与结肠癌的浸润和转移有着密切相关。
Ki-67抗原为细胞核内分裂增殖相关蛋白,在细胞周期 S、G1、G2、M 期均有表达,G0 期缺如[14],是目前应用最广泛、最可靠的增殖细胞标志物之一[15]。关于Ki-67的研究已相当成熟,大量研究表明,Ki-67在几乎所有肿瘤组织中高表达,且与肿瘤分期、淋巴结转移等密切相关,已作为常规免疫组化因子应用于临床病理,指导肿瘤临床用药及判断预后。本研究中,Ki-67在结肠癌中的表达均明显高于癌旁正常组织(P<0.05)。TNM分期越晚,浸润深度越深,有淋巴结转移,其阳性表达率越高,这些均与既往大量研究结果一致。
本文在研究UHRF1、Ki-67的表达在结肠癌的关系中发现,UHRF1与Ki-67在结肠癌中表达呈正相关,差异有统计学意义(P<0.05),结果提示UHRF1与Ki-67在结肠癌的发生发展过程中存在一定相关性,这可能与肿瘤细胞处于增殖分裂状态相关,因为UHRF1与Ki-67均在静止期细胞不表达,而在增殖细胞中广泛表达。另外,Geng[10]和Cui等[16]研究发现,UHRF1与多种肿瘤预后相关,UHRF1表达水平越高,患者的生存时间越短,其预后越差。本文中,Kaplan-Meier分析结果显示,UHRF1阴性患者3年生存率为55.56%,UHRF1阳性和UHRF1、Ki-67均阳性的患者分别为24.59%和24.44%,UHRF1阴性患者的中位生存时间为37.33 个月,UHRF1 阳性者为 24.49 个月,UHRF1、Ki-67均阳性者为22.71个月。这表明,UHRF1阳性表达患者和UHRF1、Ki-67均阳性者3年生存率和中位生存时间明显较阴性者低。UHRF1、Ki-67均阳性表达患者的3年生存率和中位生存时间有比单独UHRF1阳性表达者稍低的趋势,但差异无统计学意义,可能与样本量小有关,有待于扩大样本来进一步的研究证实。
综上所述,UHRF1、Ki-67蛋白在结肠癌中高表达,并且其表达水平与肿瘤恶性行为和不良预后密切相关,可考虑作为结肠癌临床评价肿瘤生物学行为及判断预后的指标。另外,UHRF1作为一种重要的表观遗传学调控因子,与肿瘤的发生、发展及浸润转移关系密切,以UHRF家族蛋白为靶点的肿瘤靶向性治疗有望在今后得到临床应用。
[1] Avvakumov GV,Walker JR,Xue S,et al.Structural basis for recognition of hemi-methylated DNA by the SRA domain of human UHRF1[J].Nature,2008,455(7214):822-825.
[2] Achour M,Jacq X,Rondé P,et al.The interaction of the SRA domain of ICBP90 with a novel domain of DNMT1 is involved in the regulation of VEGF gene expression[J].Oncogene,2008,27(15):2187-2197.
[3] Hopfner R,Mousli M,Jeltsch JM,et al.ICBP90,a novel human CCAAT binding protein,involved in the regulation of topoisomeraseⅡ alpha expression[J].Cancer Res,2000,60(1):121-128.
[4] 张 伟,周 林,李乃义,等.胃癌组织UHRF1表达与预后相关性分析[J].中华肿瘤防治杂志,2015,22(2):109-112.
[5] 许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
[6] Fujimori A,Matsuda Y,Takemoto Y,et al.Cloning and mapping of Np95 gene which encodes a novel nuclear protein associated with cell proliferation[J].Mamm Genome,1998,9(12):1032-1035.
[7] Hashimoto H,Horton JR,Zhang X,et al.UHRF1,a modular multi-domain protein,regulates replication-coupled crosstalk between DNAmethylation and histone modifications[J].Epigenetics,2009,4(1):8-14.
[8] Shimizu T,Kasamatsu A,Yamamoto A,et al.Annexin A10 in human oral cancer:biomarker for tumoral growth via G1/S transition by targeting MAPKsignaling pathways[J].PLoS One,2012,7(9):e45510.
[9] Wang F,Yang YZ,Shi CZ,et al.UHRF1 promotes cell growth and metastasis through repression of p16ink4a in colorectal cancer[J].Ann Surg Oncol,2012,19(8):2753-2762.
[10] Geng Y,Gao Y,Ju H,et al.Diagnostic and prognostic value ofplasma and tissue ubiquitin-like,containing PHD and RING fingerdomains 1 in breast cancer patients[J].Cancer Sci,2013,104(2):194-199.
[11] Babbio F,Pistore C,Curti L,et al.The SRA protein UHRF1 promotes epigenetic crosstalks and is involved in prostate cancer progression[J].Oncogene,2012,31(46):4878-87.
[12] Yan F,Shao LJ,Hu XY,et al.Knockdown of UHRF1 by lentivirus-mediated shRNA inhibitsovarian cancer cell growth[J].Asian Pac JCancer Prev,2015,16(4):1343-1348.
[13] Mudbhary R,Hoshida Y,Jacob V,et al.UHRF1 overexpression drives DNA hypomethylation and hepatocellular carcinoma[J].Cancer Cell,2014,25(2):196-209.
[14] Urruticoechea A,Smith IE,Dowsett M.Proliferation marker Ki-67 in early breast cancer[J].J Clin Oncol,2005,23(28):7212-7220.
[15]叶洪楠,游 珂,郭艳利,等.P16INK4a及 Ki-67免疫细胞化学检测对ASC-US中高级别病变检出的意义[J].肿瘤预防与治疗,2014,27(1):6-11.
[16] Cui L,Chen J,Zhang Q,et al.Up-regulation of UHRF1 by oncogenic Ras promoted the growth,migration,and metastasis of pancreaticcancer cells[J].Mol Cell Biochem,2015,400(1-2):223-232.
