靶向抑制EGFR核转位对鼻咽癌细胞辐射耐受相关分子DNA-PK活化的作用*
2015-12-02马士淇刘惠芬郎锦义黄建鸣
马士淇,李 璐,刘惠芬,郎锦义,黄建鸣
(四川省肿瘤医院·研究所,成都 610041)
鼻咽癌是我国南方地区的一种常见恶性肿瘤。目前主要治疗方法有放疗、手术、化疗等,其中放疗是首选治疗手段。但患者放疗后5年生存率仅为40%~50%,因而针对于鼻咽癌放射敏感性的研究引起临床的重视。人类表皮生长因子受体(epidermal growth factor receptor,EGFR)是原癌基因 cerbB-1(HER-1)表达产生的一种酪氨酸激酶受体,研究表明在鼻咽癌细胞中EGFR存在大量表达,并和鼻咽癌的发生和发展有着密切关系[1]。传统的受体学说认为,EGFR是细胞膜受体,然而近年来在皮肤癌及肺癌等细胞中发现电离辐射、热休克、H2O2等应激条件能够激活EGFR并通过磷酸化其核定位信号序列(nuclear localization signal,NLS)上Thr654与输入素α和β相互作用而进入细胞核,在核内发挥转录调节和信号转导功能。在这些新的功能中,核EGFR促进应激情况下如电离辐射诱导的DNA双链断裂(double strands breaks,DSBs)的修复尤其重要。在高等真核生物中,非同源末端连接(non-homologous end-joining,NHEJ)在修复放疗介导的DNA损伤中扮演关键角色。NHEJ依赖于DNA依赖性蛋白激酶(DNA-dependent protein kinase,DNA-PK)。研究发现DNA-PK Thr2609的磷酸化对其在NHEJ中发挥作用至关重要,核EGFR可以通过与DNA-PK形成复合物影响其在细胞中的分布并作为一种蛋白激酶磷酸化DNA-PK Thr2609位残基,激活DNA-PK在NHEJ中发挥作用[2]。而这种作用机制在鼻咽癌治疗耐受研究中鲜有报道。基于EGFR与鼻咽癌发生发展的密切关系,本研究考察了辐射对鼻咽癌细胞EGFR核转位的影响,并初步探讨EGFR核转位抑制肽对鼻咽癌细胞辐射耐受相关分子DNA-PK表达的作用及其潜在的分子关联机制。
1 材料与方法
1.1 细胞培养
人鼻咽癌CNE-1细胞株购自上海细胞库,用含10%灭活胎牛血清的RPMI1640培养液,在37℃、5%CO2及饱和湿度的条件下培养,每2~3天传代1次。
1.2 合成抑制肽
设计并合成与EGFR上的核定位序列(EGFRNLS)的序列相似性磷酸化多肽[Ac-RKRT(PO3H2)LRRLK]作为竞争抑制EGFR核转位的干扰药物,同时设计对照多肽(KKALRRQEAVNAL),纯度 >98%,上海楚肽生物科技有限公司。
1.3 辐射处理
取指数生长期的细胞在pT654抑制肽及对照肽(5μM)作用16h后,采用60Co γ射线照射,辐射4Gy后,将细胞置于CO2培养箱中继续培养,在不同时间点收集细胞,提取蛋白。细胞质蛋白和核蛋白的提取采用细胞核和胞质蛋白提取试剂盒(上海生工BSP001)。
1.4 Western blot检测
考马斯亮蓝染液测定蛋白浓度,上样,根据蛋白分子量进行不同浓度SDS聚丙烯酰胺凝胶电泳,将蛋白质转移通过半干转印到固相支持体 PVDF膜上,用5%脱脂奶粉的TBST 37℃封闭1 h,分别孵育一抗:兔抗人GAPDH单克隆抗体(1∶20 000)(Epitmics)、兔抗人 Lamin B1单克隆抗体(1∶20 000)(Epitmics)、鼠抗人EGFR单克隆抗体(1∶5 000)(BD Biosciences),兔抗人pEGFRThr654单克隆抗体(1∶100)(Millipore)、小鼠抗人DNA-PKcs单克隆抗体(1∶2 500)(Epitmics)、小鼠抗人pDNA-PKcsThr2609单克隆抗体(1 ∶1 000)(Abcam),4℃ 过夜;TBST漂洗10min,3次,孵育二抗辣根酶标记山羊抗兔/鼠IgG(H+L)(中杉金桥),37℃孵育l h;TBST漂洗10 min,3次;eECL高灵敏度化学发光检测试剂盒曝光显影(北京康为世纪);曝光后底片上蛋白条带计算吸光度,分析蛋白的相对表达量。
1.5 相关性分析
应用 SPSS 19.0软件对 pEGFRThr654和 pDNAPKThr2609的蛋白表达值进行相关性分析(Spearman),计算线性拟合的相关系数R2值。
1.6 统计学分析
应用SPSS 19.0软件统计学分析,实验数据以均数±标准差表示(±s),两组均数的比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 放射后鼻咽癌细胞质中EGFR相关蛋白的表达
Western blot结果显示CNE-1细胞在4Gy照射后0~40min内,细胞质中EGFR及pEGFRThr654表达呈时间依赖性增加,其中照射后40min时,CNE-1细胞质中pEGFRThr654表达量较0 min时升高,差异有统计学意义(P <0.05,图1B)。
2.2 放射后鼻咽癌细胞核中EGFR及DNA-PK相关蛋白的表达
Western blot结果显示CNE-1细胞在4Gy照射后0~40min内,细胞核中EGFR和pEGFRThr654表达以及DNA损伤修复相关蛋白pDNA-PKThr2609表达均呈时间依赖性增加,各时间点蛋白表达量与相应0min时比较,差异具有统计学意义(P<0.05,图2B)。在各组核蛋白样本中,未检测到胞质蛋白内参GAPDH表达,证实核蛋白提取过程中无胞质蛋白污染(结果未显示)。
2.3 核转位抑制肽对CNE-1细胞核中EGFR及DNA-PK相关蛋白的表达的影响
Western blot结果显示CNE-1细胞经过EGFR核转位抑制肽预处理后,核内EGFR及pEGFRThr654表达量在照射后10 min时呈现少量增加,然后随时间延长逐渐降低,其中照射后20 min和40 min时,细胞核中EGFR和pEGFRThr654表达量较0 min时降低,差异具有统计学意义(P<0.05,图3B);而经过相同浓度及时间预处理的对照肽组,细胞核中EGFR及pEGFRThr654蛋白表达量随放射后时间延长而逐渐升高。各组pDNA-PKThr2609表达呈现出与pEGFRThr654表达相同的趋势(图3B)。
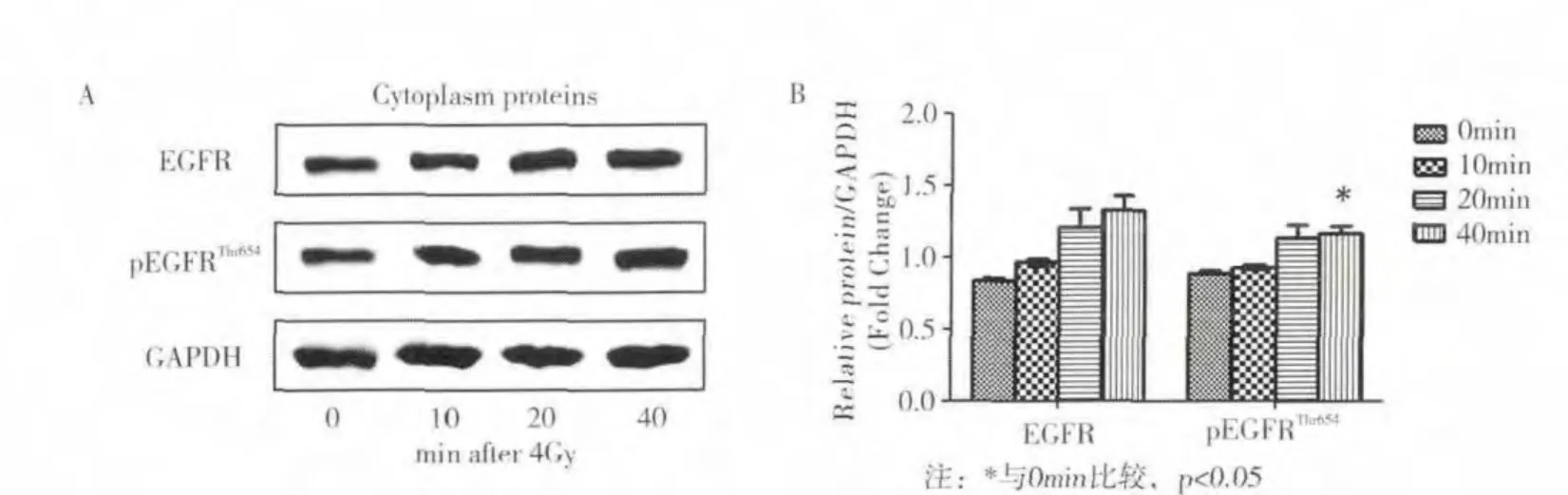
图1 放射后不同时间点CNE-1细胞质中EGFR相关蛋白表达情况
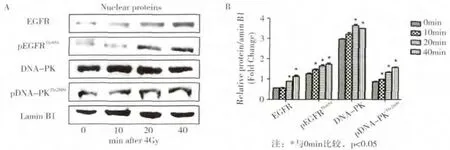
图2 放射后不同时间点CNE-1细胞质中EGFR及DNA-PK相关蛋白表达情况
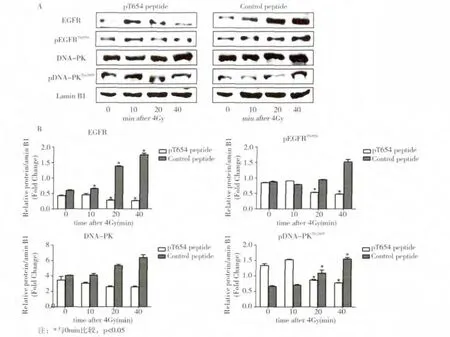
图3 多肽处理放射后不同时间CNE-1细胞核中EGFR及DNA-PK相关蛋白表达情况
2.4 pEGFRThr654和 pDNA-PKThr2609的蛋白表达值相关性分析
CNE-1细胞核中pEGFRThr654表达量随放射后时间延长逐渐增加,DNA损伤修复相关蛋白pDNAPKThr2609表达量随放射后时间延长逐渐增加,且与pEGFRThr654表达量呈正相关(R2=0.935,图 4A);CNE-1细胞经过EGFR核转位抑制肽预处理后,核内pEGFRThr654表达量随放射后时间延长而逐渐降低,同时核内pDNA-PKThr2609的表达也相应降低(R2=0.962,图4B)。

图4 pEGFRThr654和pDNA-PKThr2609的蛋白表达值相关性分析结果
3 讨论
EGFR在许多人类恶性肿瘤中存在过表达或突变,参与肿瘤发生和恶性转变过程。研究报道EGFR在鼻咽癌组织中高表达,是评估鼻咽癌进展和判断预后的重要指标[3]。传统的受体学说认为,EGFR为细胞膜受体,作为第一信使,不能进入细胞核,但近年来的研究对该观点发出挑战,目前已在许多肿瘤组织(如乳腺癌、卵巢癌、宫颈癌、头颈鳞状细胞癌、非小细胞肺癌等)细胞核内发现高水平的EGFR 表达[4-8]。
研究报道鼻咽癌细胞中EB病毒编码的潜伏膜蛋白1可以通过配体非依赖型方式调控EGFR核转位,在细胞核中EGFR与STAT3相互作用,调节一系列与肿瘤侵袭性生物学行为相关的癌基因的表达,促进癌细胞增殖[9]。由此可知,核EGFR参与鼻咽癌的发生与发展。鼻咽癌目前以放射治疗作为主要治疗策略,研究发现放疗可介导EGFR胞内近膜端核定位信号序列(NLS)上Thr654的磷酸化,通过核质转运途径进入细胞核,该位点在EGFR家族成员中具有高度保守性,将其删除能够增加放化疗敏感性[2]。Dittmann 等[10]以肺癌细胞为模型发现放射诱导EGFR进入细胞核,与DNA双链断裂非同源末端连接修复(NHEJ)途径的关键蛋白DNA依赖蛋白激酶(DNA-PK)相互作用并作为一种蛋白激酶磷酸化DNA-PK Thr2609位残基[11],使细胞具有促进DNA损伤修复的功能,在放疗抵抗中发挥作用。而DNA损伤修复应答途径的激活同样是鼻咽癌辐射抵抗的原因之一[12]。基于目前关于EGFR在鼻咽癌细胞受辐射后在细胞质与细胞核中的活化分布细节,以及EGFR转运入核后与肿瘤辐射耐受相关分子的表达情况尚未有报道。本研究检测了辐射后EGFR在鼻咽癌细胞中的分布变化以及其与细胞辐射抵抗间的关系。
本研究选取鼻咽癌细胞中EB病毒阴性的CNE-1细胞作为研究对象,通过检测辐射后不同时间点细胞质与细胞核相关蛋白的表达情况,发现鼻咽癌CNE-1细胞中EGFR呈高表达状态,辐射处理后早期即可在细胞质及细胞核中检测到EGFR及pEGFRThr654的表达,且 EGFR及 pEGFRThr654的表达均随处理时间延长而呈增加趋势,类似的现象已在肺癌及乳腺癌等相关文献中报道过[13-14],因而我们初步推测EGFR核转位可能是EGFR过表达的肿瘤细胞经辐射后的普遍应激反应,为早期事件,在细胞核中通过激活不同靶点而为肿瘤细胞辐射耐受提供可能。同时,我们发现在细胞在无辐射处理情况下,细胞质及细胞核中存在基础水平pEGFRThr654的表达,我们分析在细胞正常培养条件下,培养基中含有多种激素类因子,其中包括EGF,激活EGFR配体依赖途径,导致细胞在无辐射条件下存在pEGFRThr654,具体原因需进一步研究。此外,本研究考察了CNE-1细胞内核EGFR与DNA损伤修复相关蛋白DNAPK之间的联系,结果证实了随pEGFRThr654表达量增加,核内EGFR发生聚集,pDNA-PKThr2609的表达随即增加,二者呈现正相关性,揭示核EGFR激活DNA损失修复相关蛋白DNA-PK是其介导鼻咽癌细胞辐射抵抗的机制之一。因此,阻断EGFR核转位将是降低由DNA-PK磷酸化介导的鼻咽癌放疗抵抗的重要抑制靶点。
研究表明,核EGFR的促进细胞生成和促进放疗诱导的肿瘤细胞DNA损伤后修复功能,是造成肿瘤细胞放疗抵抗的重要原因之一。因而针对核内EGFR的分子靶向治疗具有重要的实际意义,如阻断EGFR核运输、或阻断核内EGFR下游信号转导通路将成为有效的新的治疗策略。西妥昔单抗(Cetuximab,C225),是人鼠嵌合单克隆抗体,被认为是抑制EGFR受体激活和信号转导以及诱导受体内吞和下调的药物,有研究认为C225可以抑制EGFR核转位,进而降低细胞核内DNA-PK的活性,增强肿瘤细胞的放疗敏感度[15],但在多种核EGFR高表达的肿瘤细胞株中发现C225可激发EGFR核转位并可能引起耐药[15-18],导致 C225在EGFR核转位中观点矛盾的原因可能与不同因素诱导EGFR磷酸化位点不同有关。相对于蛋白质类大分子药物,肽类药物在人体中的作用已引起科学界的高度重视。小分子的肿瘤抑制肽具有结构易于改造,人工化学合成的生产成本较低,可以多种方式给药,不易引起免疫反应等特点。根据研究发现EGFR的核定位序列(NLS)中Thr654磷酸化在放疗介导的EGFR通过核质蛋白途径入核中具有关键作用,选择Thr654磷酸化的短肽(RKRT(PO3H2)LRRLK)可作为与EGFR上的NLS竞争核质转运受体蛋白结合位点的抑制分子,有效阻断EGFR核转位[2]。本研究分别观察抑制肽及对照肽对辐射诱导鼻咽癌CNE-1细胞内EGFR核转位的影响,结果发现在辐射早期经过抑制肽处理的细胞核中EGFR及pEGFRThr654蛋白表达呈现少量增加趋势,随后逐渐降低。我们推测抑制肽在预处理细胞16h中,与细胞质中基础水平的pEGFRThr654竞争与输入素α结合,在放射初期,随着细胞质中EGFR Thr654磷酸化水平增加,抑制肽与输入素α的结合平衡受到影响,发生少量核转位,或者EGFR也可通过非NLS与输入素结合途径发生核转位,具体原因需进一步研究。通过观察总体趋势,我们认为抑制肽能够有效抑制EGFR核转位及其入核后的DNA修复相关活动。因此,通过阻断pEGFRThr654介导的入核通路,可以实现靶向抑制EGFR核转位,降低DNA-PK参与的DNA损伤修复作用,增加肿瘤细胞放射敏感性。
综上,我们初步得出结论认为:辐射能够诱导鼻咽癌CNE-1细胞内EGFR核转运,并且EGFR核转运可能由T654位残基磷酸化介导并和DNA损伤修复等辐射耐受作用相关。通过靶向阻断EGFR的核转位可以消除EGFR-DNA-PK复合物的相互作用,抑制DNA损伤修复,减少细胞的存活。鉴于EGFR在多种肿瘤中高表达,这种机制可能具有肿瘤组织或细胞特异性,是一种非常有前景的治疗靶点,开发靶向EGFR或其下游信号的阻断剂联合放化疗一体化治疗有重要的临床意义和应用前景。
[1] Kim ES,Khuri FR,Herbst RS.Epidermal growth factor receptor biology(IMC-C225)[J].Curr Opin Oncol,2001,13(6):506-513.
[2] Dittmann K,Mayer C,Fehrenbacher B,et al.Nuclear EGFR shuttling induced by ionizing radiation is regulated by phosphorylation at residue Thr654[J].FEBS Lett,2010,584(18):3878-3884.
[3] Pan J,Kong L,Lin S,et al.The clinical significance of coexpression of cyclooxygenases-2,vascular endothelial growth factors,and epidermal growth factor receptor in nasopharyngeal carcinoma[J].Laryngoscope,2008,118(11):1970-1975.
[4] Traynor AM,Weigel TL,Oettel KR,et al.Nuclear EGFR protein expression predicts poor survival in early stage non-small cell lung cancer[J].Lung Cancer,2013,81(1):138-141.
[5] Xia W,Wei Y,Du Y,et al.Nuclear expression of epidermal growth factor receptor is a novel prognostic value in patients with ovarian cancer[J].Mol Carcinog,2009,48(7):610-617.
[6] Muthusami S,Prabakaran DS,Yu JR,et al.FTS is responsible for radiation-induced nuclear phosphorylation of EGFR and repair of DNA damage in cervical cancer cells[J].J Cancer Res Clin Oncol,2015,141(2):203-210.
[7] Lo HW,Xia W,Wei Y,et al.Novel prognostic value of nuclear epidermal growth factor receptor in breast cancer[J].Cancer Res,2005,65(1):338-348.
[8] Psyrri A,Yu Z,Weinberger PM,et al.Quantitative determination of nuclear and cytoplasmic epidermal growth factor receptor expression in oropharyngeal squamous cell cancer by using automated quantitative analysis[J].Clin Cancer Res,2005,11(16):5856-5862.
[9] Xu Y,Shi Y,Yuan Q,et al.Epstein-Barr Virus encoded LMP1 regulates cyclin D1 promoter activity by nuclear EGFR and STAT3 in CNE1 cells[J].J Exp Clin Cancer Res,2013,32(1):90.
[10] Dittmann K,Mayer C,Rodemann HP.Inhibition of radiation-induced EGFR nuclear import by C225(Cetuximab)suppresses DNA-PK activity[J].Radiother Oncol,2005,76(2):157-161.
[11] Liccardi G,Hartley JA,Hochhauser D.EGFR nuclear translocation modulates DNA repair following cisplatin and ionizing radiation treatment[J].Cancer Res,2011,71(3):1103-1114.
[12] Hennequin C,Quero L,Favaudon V.DNA repair and tumour radiosensitivity:focus on ATM gene[J].Bull Cancer,2011,98(3):239-246.
[13] Dittmann K,Mayer C,Fehrenbacher B,et al.Radiation-induced epidermal growth factor receptor nuclear import is linked to activation of DNA-dependent protein kinase[J].J Biol Chem,2005,280(35):31182-31189.
[14] Lin SY,Makino K,Xia W,et al.Nuclear localization of EGF receptor and its potential new role as a transcription factor[J].Nat Cell Biol,2001,3(9):802-808.
[15] Huang WC,Chen YJ,Li LY,et al.Nuclear translocation of epidermal growth factor receptor by Akt-dependent phosphorylation enhances breast cancer-resistant protein expression in gefitinib-resistant cells[J].J Biol Chem,2011,286(23):20558-20568.
[16] Li C,Iida M,Dunn EF,et al.Nuclear EGFR contributes to acquired resistance to cetuximab[J].Oncogene,2009,28(43):3801-3813.
[17] Wheeler DL,Huang S,Kruser TJ,et al.Mechanisms of acquired resistance to cetuximab:role of HER(ErbB)family members[J].Oncogene,2008,27(28):3944-3956.
[18] Brand TM,Iida M,Luthar N,et al.Nuclear EGFR as a molecular target in cancer[J].Radiother Oncol,2013,108(3):370-377.
