黄芩素抑制乳腺癌肺转移作用机制的体内研究*
2015-12-02闫婉君马兴聪高晓燕薛兴欢张淑群
闫婉君,马兴聪,高晓燕,薛兴欢,张淑群
(西安交通大学第二附属医院肿瘤病院肿瘤科,西安 710004)
乳腺癌(breast cancer)是女性最常见的恶性肿瘤之一,近年来有发病年轻及发病率上升的趋势,严重威胁着女性的身心健康,转移是晚期患者的最终阶段和导致乳腺癌患者死亡的主要原因。由于传统术后放化疗普遍存在严重的不良反应,因此从天然物质中寻找毒副作用小、安全有效的抗乳腺癌药物成为近些年的研究热点。黄芩素是一种广泛使用的中草药,具有广泛的药理作用,如抗菌,抗氧化,体内外抗肿瘤,抗血栓形成,保护肝脏、心脑血管等。近年来研究表明黄芩素具有广谱的抗肿瘤作用。近几年研究核基质结合蛋白(special AT rich sequence binding protein1,SATB1)在大多数实体肿瘤组织中的含量都有增加,尤其在浸润性乳腺癌细胞中高表达。上皮间质转化 (Epithelial-Mesenchymal Transition,EMT)是上皮细胞获得间质细胞的特征,大量研究表明,EMT的发生过程和肿瘤细胞的转移特征有着密切的联系。Wnt/β-catenin信号通路也参与乳腺癌的远处转移。先前的实验已验证黄芩素抑制SATB1蛋白的表达,阻止EMT的形成,影响Wnt/β-catenin信号通路。本研究旨在探讨黄芩素(Baicalein)对人乳腺癌MDA-MB-231细胞肺转移的影响及相关的作用机制是否与SATB1蛋白,EMT的发生Wnt/β-catenin信号通路有关?这将为黄芩素抗肿瘤的研究增添新的基础理论依据,为寻找安全有效的抗癌药物提供新的思路。
1 材料与方法
1.1 药品与试剂
黄芩素购于美国Sigma公司,溶于DMSO(美国Sigma公司)并避光保存于-20℃;羟甲基纤维素钠购于美国 Sigma公司;RPMI-1640购于美国 Hyclone;胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司;胰蛋白酶购自Amresco公司;双抗购于西安依科生物公司。SATB1单抗、E-cadherin单抗、Snail单抗购于美国Abacom公司;Wnt1多克隆抗体、β-catenin单抗、Vimentin单抗购于美国Cell Signaling Technology(CST)公司。山羊抗兔、抗鼠购于康为公司。SP试剂盒、DAB显色剂购于北京中杉金桥公司。PVDF膜购于美国Millipore公司。
1.2 细胞系和实验动物
人乳腺癌细胞系MD-MB-231购于American Type Culture Collection公司(ATCC,美国)。BALB/c雌性小鼠24只,购于西安交通大学动物实验中心,4~8周龄,体重为16~20g;裸鼠饲养在SPF级环境下,恒温22~25℃,恒湿55%~56%,应用水、饲料及实验用品均经灭菌、消毒处理,实验室操作严格遵守无菌操作原则。
1.3 药品配制
Baicalein用二甲基亚砜(DMSO)稀释成100mmol/L,0.22μm 微孔滤膜过滤,分装,-20℃保存,使用前解冻。羟甲基纤维素钠用蒸馏水稀释成0.5%的溶液,4℃保存。灌胃前将溶解的黄芩素悬浮于羟甲基纤维素钠溶液里。
1.4 细胞培养
MDA-MB-231细胞在 RPMI1640培养基(含10%小牛血清及100U/L青霉素和100μg/L链霉素),37℃,5%CO2饱和湿度培养箱中培养,每3天更换培养液,0.25%胰蛋白酶消化传代。取对数生长的细胞用于后续试验。
1.5 建立裸鼠模型与动物分组及给药
取处于对数生长体外培养的MDA-MB-231高转移乳腺癌细胞,细胞浓度调整至2×106/ml,无菌条件下,每只裸鼠经尾静脉注射2×105个细胞[1]。每隔一周观察裸鼠的体重和健康状况。将裸鼠随机分为4组:1.空白对照组;2.黄芩素实验组;3.黄芩素低剂量预防组;4.高剂量预防组,每组6只。按体重计算裸鼠给药剂量,对照组、低剂量预防组和高剂量预防组于注射细胞次日开始给药。实验组于注射细胞一个月后给药。实验组100mg·(kg·d)-1,低剂量预防组50mg·(kg·d)-1,高剂量预防组100mg·(kg·d)-1。确定灌胃给药,1次/d,对照组给予等体积生理盐水灌饲,连续15天[2](表1)。接种细胞8周后,将各组裸鼠脱颈处死,取肺组织,分别称其质量。将肺组织固定于4%的多聚甲醛,48h后在解剖显微镜下观察肺组织表面灰白色结节即转移灶和其数目(经验丰富的乳腺病理医师独立观察标本)。

表1 动物分组及药物干预
1.6 H-E 染色
石蜡包埋的肺组织蜡块,切成5μm厚。经二甲苯脱蜡和各级酒精水化后,苏木素液染色,盐酸乙醇水化流水冲洗,1%伊红酒精溶液染色,蒸馏水稍洗,再经过脱水和透明后。中性树胶封片,进行图像采集和分析。
1.7 免疫组化法
载玻片经二甲苯脱蜡和各级酒精水化后,柠檬酸抗原修复液进行抗原修复,然后每张载玻片上组织滴加H2O2,37℃孵育20 min;滴加试剂 A,37℃孵育15 min;然后滴加抗体SATB1(1∶100),Wnt1(1∶200),β-catenin(1 ∶100),E-cadherin(1 ∶100),Vimentin(1 ∶50)和 Snail(1 ∶80),4℃过夜;滴加辣根过氧化物酶标记的二抗,37℃孵育30 min;滴加试剂B,37℃孵育15 min;滴加试剂 C,37℃孵育15 min;滴加DAB,室温显色2 min,自来水冲洗3~5 min,苏木素复染3 min,自来水冲洗10 min,酒精脱水二甲苯透明,中性树胶封片,使用显微镜和图像采集系统软件分析。主要检测各组裸鼠肺组织中SATB1,Wnt1,β-catenin,E-cadherin,Vimentin,Snail蛋白表达。判断指标为:用磷酸盐缓冲液(PBS)代替一抗作为阴性对照。
结果判断:由经验丰富的乳腺病理医师独立观察切片。SATB1,Snail蛋白的阳性表达显示胞浆或胞核染为淡黄色至黄棕色为阳性细胞。Wnt1,β-catenin,E-cadherin,Vimentin阳性表达在细胞膜和细胞浆中,呈棕黄色颗粒.主要定位于细胞膜和细胞浆染为淡黄色至棕色为阳性细胞。表达水平按照半定量法分为3级:(-),无表达,染色强度与背景无明显差别;(+),阳性细胞率<50%,染色强度介于两者之间;(++),阳性细胞率>50%,染色强多数细胞呈黄色至棕黄色[3-8]。
1.8 Western blot
按照RIPA裂解液组提取组织蛋白,测定蛋白浓度,加入4×蛋白上样缓冲液混匀,沸水煮5min,快速降至室温后上样,进行SDS-PAGE电泳。浓缩胶浓度 5%,电压 80V,分离胶浓度 10%,电压120V。溴酚蓝刚跑至凝胶最低端即可终止电泳,转膜,PVDF膜激活后使用5%的脱脂奶粉或者5%BSA的TBST溶液中室温封闭2h后,TBST洗膜一次15 min,孵育一抗 SATB1(1 ∶1000),Wnt1(1 ∶1000),β-catenin(1 ∶1000),E-cadherin(1 ∶1000),Vimentin(1 ∶1000),Snail(1 ∶1000),β-actin(1 ∶1000)4℃过夜,TBST洗膜3次,每次15 min,孵育二抗(1 ∶5000),室温1h,TBST 洗膜3 次,每次15 min。ECL发光液A∶B=1∶1混合,化学发光凝胶成像系统(Syngene英国)曝光。实验重复三次。用Image-Pro Plus 6.0软件凝胶图象处理系统分析目的条带光密度值,其比值表示蛋白的相对表达量。
1.9 统计学方法
应用SSPS18.0软件进行统计分析。两组计量资料的比较采用t检验,多组计量资料的比较采用单因素方差分析。检验水准α=0.05。
2 结果
2.1 肺组织的大体标本和H-E染色
经尾静脉注射肿瘤细胞后,小鼠体质稳定,状态良好。4%多聚甲醛固定48h后肺组织的大体标本,于体视显微镜下观察,发现对照组的肺组织有极少量的转移灶(短黑色箭头)(见图1),实验组和预防组未发现肉眼可见的转移灶;H-E染色结果(见图2),对照组可见微小转移灶,在实验组和预防组未见明显的微小转移灶。

图1 小鼠肺大体标本(A-C):对照组-A有极少量的转移灶(短白色箭头),实验组-B和预防组-C未发现肉眼可见的转移灶
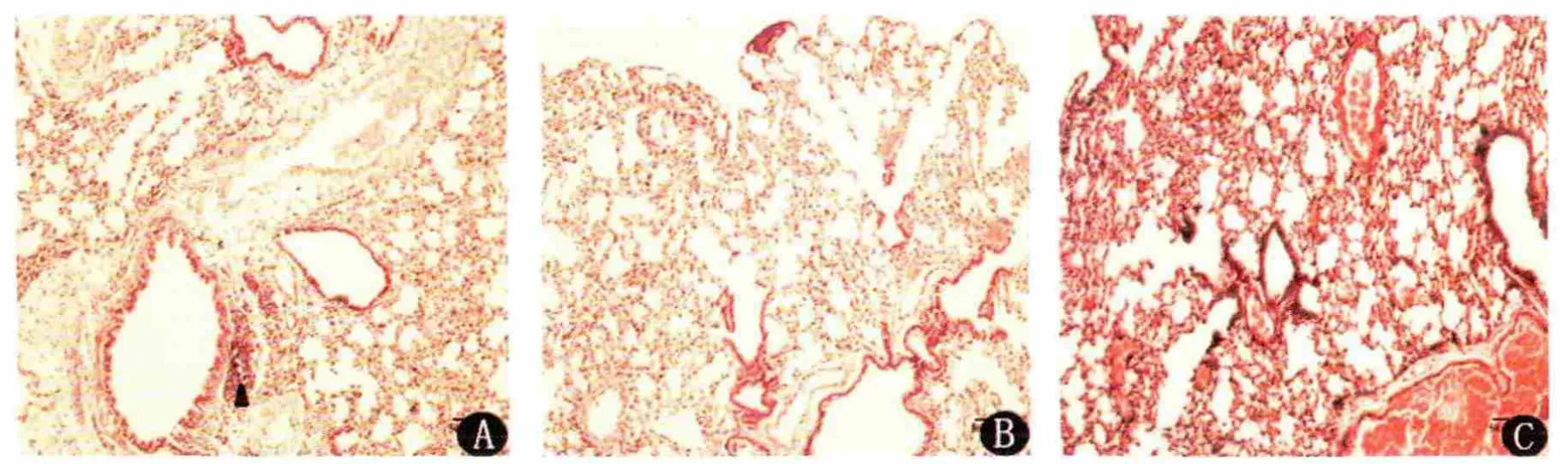
图2 小鼠肺标本切片H-E染色对照组-A的H-E染色可见少量小转移灶(黑色箭头)(×400),实验组-B和预防组-C未发现肉眼可见的转移灶
2.2 免疫组化结果
SATB1,Wnt1,β-catenin,Vimentin,Snail在对照组的肺组织中显著表达(P<0.05),在实验组和预防组表达降低;E-cadherin在对照组肺组织中表达降低,而在实验组和预防组表达升高(图3)。各抗体的表达抑制率在对照组,实验组,低剂量和高剂量预防组的阳性细胞表达率(阳性细胞数/细胞总数)具体结果见表2。各组经统计学检验(P<0.05),差异具有统计学意义。防组高剂量(-);E-cadherin(D1-4)在实验组和对照组肺组织中的表达(×400):在对照组表达(-),实验组表达(+),预防组低剂量(+)预防组高剂量(++)。(横向四行各代表1-对照组,2-实验组,3-低剂量预防组,4-高剂量预防组;纵行六列各代表ASATB1,B-Wnt1,C-β-catenin,D-E-cadherin,E-Vimentin,F-Snail)
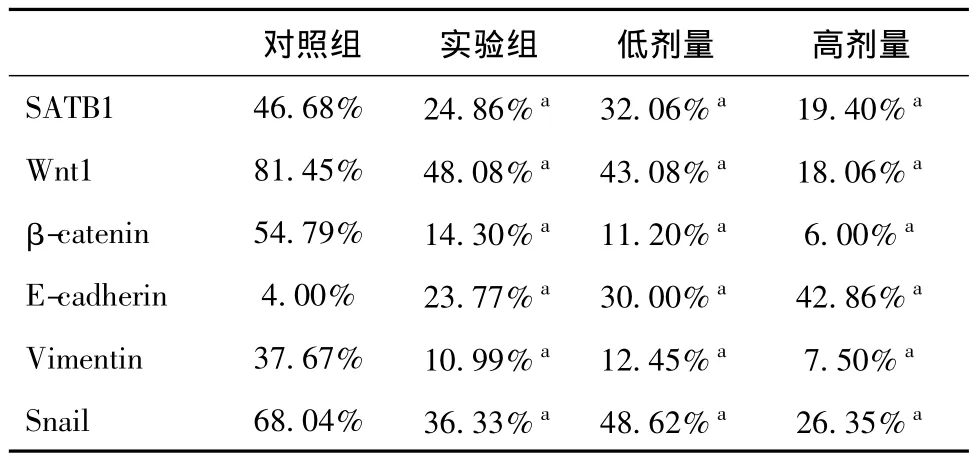
表2 各组蛋白的表达抑制率

图3 免疫组化染色检测SATB1(A1-4),Wnt1(B1-4),β-catenin(C1-4),Vimentin(E1-4),Snail(F1-4)在对照组、实验组和预防组(低剂量和高剂量组)肺组织中的表达(×400):在对照组表达(++/+),实验组表达(-/+-),预防组低剂量(+),预
2.3 Western blot结果
结果分析(图4)肺组织 SATB1,Wnt1,β-catenin,E-cadherin,Vimentin,Snail蛋白的表达水平,胶片扫描仪采集图片。Image-Pro Plus 6.0测量蛋白条带灰度值,并分别以SATB1,Wnt1,β-catenin,E-cadherin,Vimentin,Snail的目的条带与内参 βactin条带灰度值得比值作为蛋白的相对表达量(表3)。结果显示实验组与对照组;预防组低剂量和预防组高剂量 SATB1,Wnt1,β-catenin,E-cadherin,Vimentin,Snail各蛋白表达水平与对照组比较均有显著性差异,其中实验组和预防组中SATB1,Wnt1,β-catenin,E-cadherin,Vimentin,Snail蛋白表达水平与对照组相比降低,差异有统计学意义(P<0.05);E-cadherin蛋白表达水平与对照组相比升高,差异有统计学意义(P<0.05)。
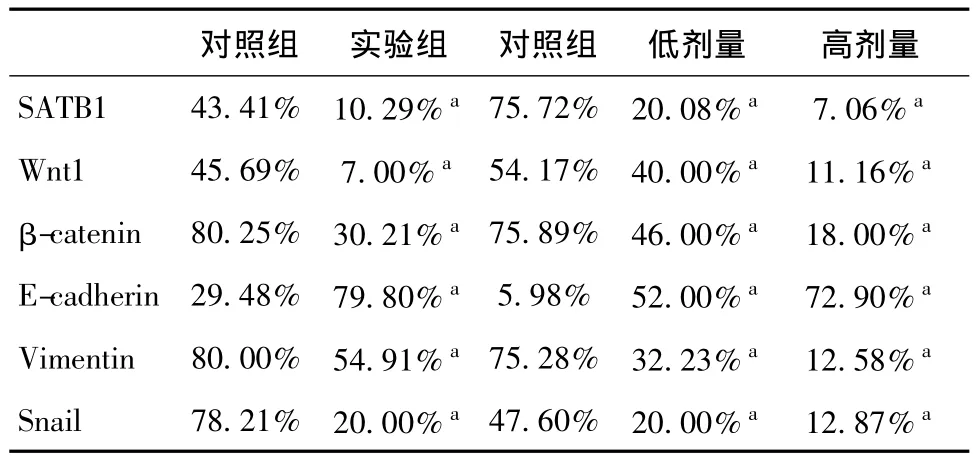
表3 各组蛋白的相对表达量
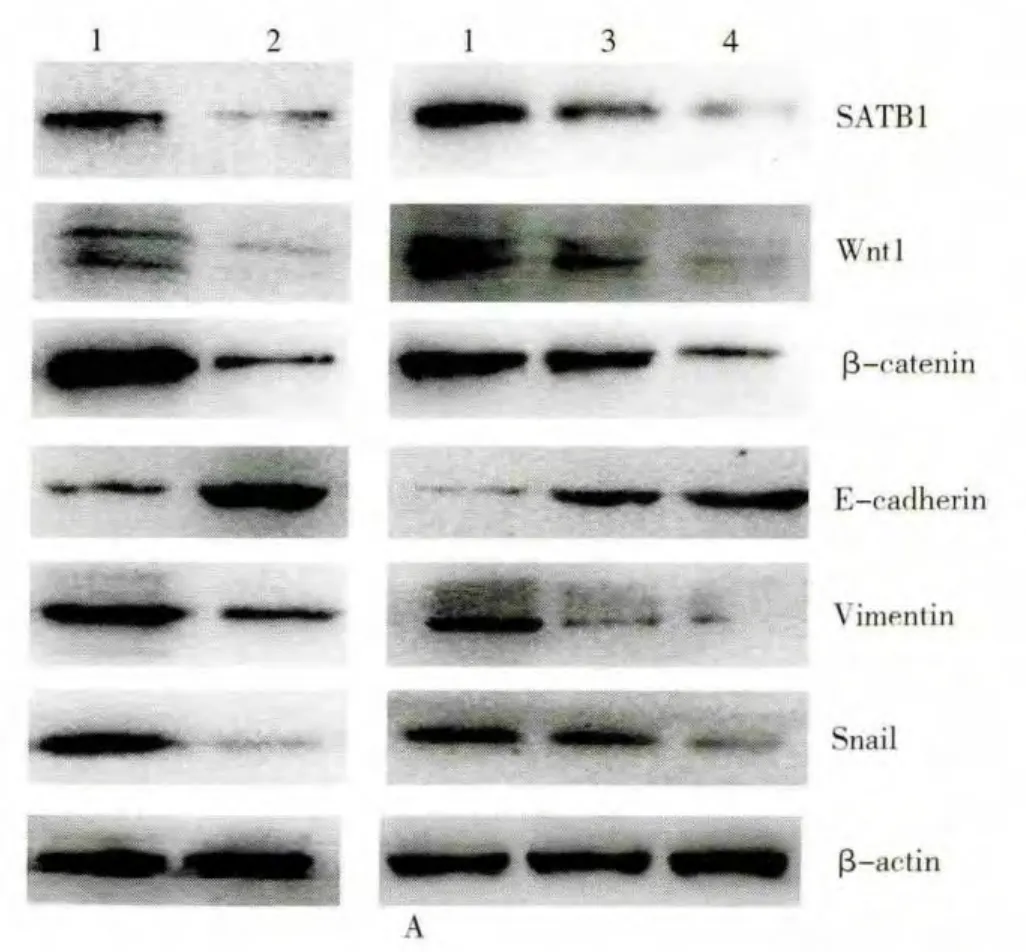
注:1:对照组;2:实验组;3:预防组低剂量组;4:预防组高剂量组
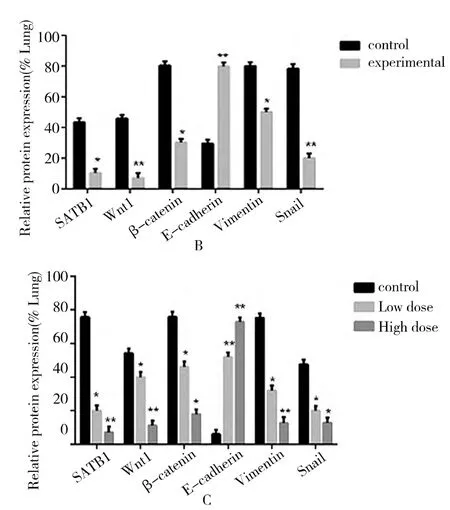
图4 Western blot检测对照组与实验组;对照组,预防组低剂量和预防组高剂量肺组织中 SATB1,Wnt1,β-catenin,E-cadherin,Vimentin,Snail蛋白分析结果(A)。Western blot法检测黄芩素下调肺组织SATB1,Wnt1,β-catenin,Vimentin,Snail和上调 E-cadherin蛋白的的表达;(B,C)Western blot结果进行半定量分析 *P<0.05,**P<0.01,采用单因素方差分析,组间两两依次比较所得。
3 讨论
乳腺癌是女性最常见的恶性肿瘤之一[9-10],而转移是乳腺癌进展的最后阶段,同时也是乳腺癌患者高死亡率的主要原因[11-12],导致超过90%癌症患者死亡[13]。正常的乳腺上皮细胞通过一系列连续的变化包括细胞基因和遗传表观的改变与微环境的相互作用而发生恶变、侵袭、转移[14-18]。目前对于转移的相关机制尚未完全清楚。寻找有效的毒副作用小的抗肿瘤侵袭转移药物,对提高乳腺癌疗效、改善预后、提高生存质量,具有重要的理论意义和临床应用价值。中药黄芩素是一种广泛使用的中草药,研究发现黄芩素在体内外有广泛的抗肿瘤的作用[15-23],因此本研究主要在于发现黄芩素抑制乳腺癌细胞肺转移的的影响机制。
国外大量的研究已经表明,SATB1作为“基因组组织者”调控大量转移相关基因并且在浸润性乳腺癌高表达和促进肺骨等远处转移[24-26],与Han等[1]研究结果一致。Wnt/β-catenin信号通路也参与乳腺癌的远处转移[27]。研究发现SATB1调控转移相关基因如 c-myc[28]和 bcl-2[29]同时也被 Wnt/β-catenin 信号通路调控[30],表明 Wnt/β-catenin 信号通路和SATB1中间有功能上的重叠。此外,在乳腺癌中SATB1调节β-catenin和Tcf-4,SATB1和βcatenin相互作用并且β-catenin结合到SATB1的靶位点[31]。同时也与 EMT 的发生密切相关[32-33]。越来越多的证据表明,EMT是许多肿瘤侵袭和转移早期的一个重要的过程[34-35]。因此,我们可以假设黄芩素使通过下调 SATB1的表达,阻止 Wnt/βcatenin的信号通路,从而阻止EMT的发生,进而阻止乳腺癌的转移的发生。Gao等[36]研究发现黄芩素可显著降低人乳腺癌MDA-MB-231细胞中SATB1蛋白的表达,且呈浓度依赖性,因此黄芩素可通过抑制SATB1蛋白的表达而发挥抗乳腺癌细胞的侵袭转移作用。Chung等[37]的研究发现黄芩素在乳腺癌细胞中抑制EMT形成的发生。并且Yoshida等[38]研究也发现上皮的标志物如:E-cadherin和catenin的减少或者丢失可能与乳腺癌的远处器官和淋巴结的转移相关。Matsuda等[39]研究发现Wnt信号通路影响乳腺癌细胞MDA-MB-231的多个生物学性质。Smith等[40]研究发现在浸润性乳腺癌细胞 (MDA-MB-231)中ERK2通过Snail的同种型激活导致EMT的发生与细胞的迁移增加和黏附减少相关。Vimentin被称为EMT的标志物,高表达反应了晚期乳腺癌的高浸润性和耐药性[41-42]。E-cadherin作为上皮的重要标志物,ElMoneim等[43]研究发现浸润性导管癌病人的病情的进展和预后的重要的特点即E-cadherin的减少。E-cadherin减少可能的机制为与染色质重组,甲基化及改建相关[44-45]。在浸润性导管癌和各类乳腺癌细胞中,转录水平中CDH1启动子的甲基化和5 CpG区的重叠被验证与E-cadherin表达的丢失相关[46]。因其缺乏动物实验的数据的验证,只能在体外发挥其作用,因此本实验通过黄芩素体内实验的验证,通过建立乳腺癌动物模型,实验免疫组化结果为 SATB1,Wnt1,β-catenin,Vimentin,Snail蛋白的表达在对照组表达(++/+),实验组表达(-/+-),预防组低剂量(+)和预防组高剂量(+/+-);E-cadherin在对照组表达(-),实验组表达(+),预防组低剂量(+)预防组高剂量(++)。Western blot结果为黄芩素下调 SATB1,Wnt1,β-catenin,Vimentin,Snail蛋白的表达和上调E-cadherin蛋白的表达,各组蛋白表达水平差异均有统计学意义(P<0.05)。本实验研究发现黄芩素下调乳腺癌转移相关蛋白如SATB1,Wnt1,β-catenin,Vimentin,Snail和上调 E-cadherin的表达的影响。因此结论为黄芩素抑制乳腺癌的转移可能通过抑制 SATB1的表达,阻止Wnt/β-catenin信号通路,从而抑制 EMT的发生。进一步的验证还需在其他乳腺癌转移相关信号通路和基因的水平验证SATB1、Wnt/β-catenin信号通路和EMT三者相互关系与作用在乳腺癌远处转移的研究。本研究设计的不足之处是未设立阳性对照,希望后续实验设计研究中考虑并进一步的验证本实验的结果。乳腺癌晚期转移的器官为肺、肝、脑、骨转移和转移的信号通路多种多样,本文仅研究了乳腺癌肺转移模型和一种信号通路,还需进一步的研究其他转移的模型和信号通路,为黄芩素抑制乳腺癌转移增添的理论基础。
目前的相关研究表明,中药黄芩素的研究仅停留在基础研究阶段,尚未开展与临床相关的研究。本研究为黄芩素抗肿瘤转移的研究和开展临床试验增添了新的基础理论依据,为寻找安全有效的抗癌药物提供了新的思路。
[1] Han HY,Russo J,Kohwi Y,et al.SATB1 reprogrammes gene expression to promote breast tumour growth and metastasis[J].Nature,2008,452(13):187-194.
[2] Che QM,Yang L,Chen Y,et al.Comparison of pharmacokinetics between different doses of baicalein in rats[J].Chin New Drugs J,2007,16(8):604-606.
[3] Han HY,Russo J,Kohwi Y,et al.SATB1 reprogrammes gene expression to promote breast mour growth and metastasis[J].Nature,2008,452(7184):187-193.
[4] Gonzalez MA,Pinder SE,Wencyk PM,et al.An immunohistochemical examination of the expression of E-cadherin,α and β/γcatenins and α2and β1integrins in invasive breast cancer[J].J Pathol,1999,187(5):523-529.
[5] Maruyama K,Oehiai A,Akimoto S,et al.Cytoplasmic beta-catenin accumulation as a predictor of hematogenous metastasis in human colorectal cancer[J].Oncology,2000,59(4):302-309.
[6] Rosivatz E,Becket I,Specbt K,et al.Differential expression of the epithelial-mesenchyal transition regulators snail,SIPI,and twist in gastric cancer[J].Am J Pathol,2002,161(5):1881-1891.
[7] Baumgart E,Cohen MS,Silva Neto B,et al.Identification and prognostic significance of an epithelial-mesenchymal transition expression profile in human bladder tumors[J].Clin Cancer Res,2007,13(6):1685-1694.
[8] Chen G,Shukerir N,Potti A,et al.Up-regulation of Wnt-1 and beta-catenin production in patients with advanced metastasis prostate carcinoma:potential pathogenetic and prognostic implications[J].Cancer,2004,101(6):1345-1356.
[9] Beik O,Hall P,Ekbom A,et al.Breast cancer incidence and case fatality among 4.7 million women in relation to social and ethnic background;a population-based cohort study[J].Breast Cancer Res,2012,14(1):R5.
[10] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012 [J].CA Cancer J Clin,2015,65(2):87-108.
[11] Polya K.Breast cancer:origins and evolution[J].J Clin Invest,2007,117(11):3155-3163.
[12] Steeg PS.Metastasis suppressors alter the signal transduction of cancer cells[J].Nat Rev Cancer,2003,3(1):55-63.
[13] Christofori G.New signals from the invasive front[J].Nature,2006,441(7092):444-450.
[14] Zhang HB,Lu P,Guo QY,et al.Baicalein induces apoptosis in esophageal squamous cell carcinoma cells through modulation of the PI3K/Akt pathway [J].Oncol Lett,2013,5(2):722-728.
[15] Miocinovic R,McCabe NP,Keck RW,et al.In vivo and in vitro effect of baicalein on human prostate cancer cells[J].Int J Oncol,2005,26(1):241-251.
[16] Yamaguchi H,Tateno M,Yamasaki K,et al.Solution structure and DNA-binding mode of the matrix attachment region-binding domain of the Transcription factor SATB1 that regulates the T-cell maturation[J].J Biol Chem,2006,281(8):5319-5327.
[17] Patani N,Jiang W,Mansel R,et al.The mRNA expression of SATB1 and SATB2 in human breast cancer[J].Cancer cell Int,2009,9(1):18-24.
[18] Minn AJ,Gupta GP,Siegel PM,et al.Genes that mediate breast cancer metastasis to lung[J].Nature,2005,436(7050):518-524.
[19] Lea MA,Ibeh C,Deutsch JK,et al.Inhibition of growth and induction of alkaline phosphatase in colon cancer cells by flavonols and flavonol glycosides[J].Anticancer Res,2010,30(9):3629-3635.
[20] Niknami M,Vignarajan S,Yao S,et al.Decrease in expression or activity of cytosolic phospholipase A2alpha increases cyclooxygenase-1 action:A cross-talk between key enzymes in arachidonic acid pathway in prostate cancer cells[J].Biochim Biophys Acta,2010,1801(7):731-737.
[21] Chen KL,Zhang S,Ji YY,et al.Baicalein inhibits the invasion and metastatic capabilities of hepatocellular carcinoma cells via down-regulation of the ERK pathway[J].PLoS One,2013,8(9):e72927.
[22] Wu B,Li J,Huang DM,et al.Baicalein mediates inhibition of migration and invasiveness of skin carcinoma through Ezrin in A431 cells[J].BMC Cancer,2011,11(2):527-532.
[23] Wei X,Guo W,Wu S,et al.Oxidative stress in NSC-741909-induced apoptosis of cancer cells[J].J Transl Med,2010,8(2):37-42.
[24] Prat A,Parker J,Karginova O,et al.Phenotypic and molecular characterization of the claudin-low intrinsic subtype of breast cancer[J].Breast Cancer Res,2010,12(5):R68.
[25] Kang Y,Siegel PM,Shu W,et al.A multigenic program mediating breast cancer metastasis to bone [J].Cancer Cell,2003,3(6):537-549.
[26] Minn AJ,Gupta GP,Siegel PM,et al.Genes that mediate breast cancer metastasis to lung[J].Nature,2005,436(7050):518-524.
[27] Yang JF,Chen SL,Liu ZH,et al.Correlation among expression of E-cadherin,β-catenin,and cyclin D1 in breast cancers[J].Chin Cancer J,2004,23(7):799-802.
[28] Cai S,Han HJ,Kohwi-Shigematsu T,et al.Tissue-specific nuclear architecture and gene expression regulated by SATB1[J].Nat Genet,2003,34(1):42-51.
[29] Ma C,Zhang J,Durrin LK,et al.The BCL2 major breakpoint region(mbr)regulates gene expression[J].Oncogene,2007,26(18):2649-2657.
[30] Li Q,Dashwood WM,Zhong X,et al.Bcl-2 overexpression in PhIP-induced colon tumors:cloning of the rat Bcl-2 promoter and characterization of a pathway involving beta-catenin,c-Myc and E2F1[J].Oncogene,2007,26(42):6194-6202.
[31] Notani D,Gottimukkala KP,Jayani RS,et al.Global regulator SATB1 recruits b-Catenin and regulates TH2 differentiation in Wnt-dependent manner [J]. PLoSBiol,2010,8(1):e1000296.
[32] Muller T,Bain G,Wang X,et al.Regulation of epithelial cell migration and tumor formation by β-catenin signaling [J].Exp Cell Res,2002,280(1):119-133.
[33] Onder TT,Gupt a PB,Mani SA,et al.Loss of E-cadherin promotes metastasis via multiple down stream transcriptional pathways[J].Cancer Res,2008,68(10):3645-3654.
[34] Cardiff RD.Epithelial to mesenchymal transition tumors:fallacious or snail’s pace?[J].Clin Cancer Res,2005,11(24 Pt1):8534-8537.
[35] Thomposon EW,Newgreen DF,Tarin D,et al.Carcinoma invasion and metastasis:a role for epithelial-mesenchymal transition?[J].Cancer Res,2005,65(14):5991-5995.
[36] Gao XY,Xue XH,Zhang SQ,et al.Effect of baicalein on the expression of SATB1 in human breast cells[J].Exp Ther Med,2015,9(5):1665-1669.
[37] Chung H,Choi HS,Seo EK,et al.Baicalin and baicalein inhibit transforminggrowth factor-b1-mediated epithelial-mesenchymal transition in human breast epithelial cells[J].Biochem Biophys Res Commun,2015,458(3):707-713.
[38] Yoshida R,Kimura N,Harada Y,et al.The loss of E-cadherin,a-and β-catenin expression is associated with metastasis and poor prognosis in invasive breast cancer[J].Int Oncol,2001,18(3):513-520.
[39] Matsuda Y,Schlange T,Oakeley EJ,et al.WNT signaling enhances breast cancer cell motility and blockade of the WNT pathway by sFRP1 suppresses MDA-MB-231 xenograft growth [J].Breast Cancer Res,2009,11(3):R32.
[40] Smith BN,Burton LJ,Henderson V,et al.Snail Promotes epithelial mesenchymal transition in breast cancer cells in part via activation of nuclear ERK2[J].PLoS ONE,2014,9(8):e104987.doi:10.1371/journal.pone.0104987.
[41] Sommers CL,Heckford SE,Skerker JM,et al.Loss of epithelial markers and acquisition of vimentin expression in adriamycin-and vinblastine-resistant human breast cancer cell lines[J].Cancer Res,1992,52(19):5190-5197.
[42] Sommers CL,Byers SW,Thompson EW,et al.Differentiation state and invasiveness of human breast cancer cell lines[J].Breast Cancer Res Treat,1994,31(2-3):325-335.
[43] ElMoneim HMA,Zaghloul NM.Expression of e-cadherin,n-cadherin and snail and their correlation with clinicopathological variants:an immunohistochemical study of 132 invasive ductal breast carcinomas in Egypt[J].Clinics,2011,66(10):1765-1771.
[44] Yoshiura K,Kanai Y,Ochiai A,et al.Silencing of the E-cadherin invasion-suppressor gene by CpG methylation in human carcinomas[J].Proc Natl Acad Sci USA,1995,92(16):7416-7419.
[45] Hennig G,Lowrick O,Birchmeier W,et al.Mechanisms identified in the transcriptional control of epithelial gene expression[J].J Biol Chem 1996,271(1):595-602.
[46] Graff JR,Herman JG,Lapidus RG,et al.E-cadherin expression is silenced by DNA hypermethylation in human breast and prostate carcinomas[J].Cancer Res 1995,55(22):5195-5199.
