姜黄素对人黑素瘤细胞株A375和C8161细胞AKT/mTOR信号通路的影响
2015-12-01韩晓东周优优郑斯文李贞宋智琦
韩晓东 周优优 郑斯文 李贞 宋智琦
姜黄素对人黑素瘤细胞株A375和C8161细胞AKT/mTOR信号通路的影响
韩晓东 周优优 郑斯文 李贞 宋智琦
目的 探讨姜黄素对恶性黑素瘤体外抗癌作用的分子机制。方法 体外培养的人黑素瘤细胞株A375和C8161分为实验组和对照组。实验组经不同浓度姜黄素处理一定时间,对照组采用二甲基亚砜处理。采用噻唑蓝法检测姜黄素对A375和C8161细胞增殖的影响,体外侵袭实验检测姜黄素对A375和C8161细胞侵袭的影响,流式细胞仪检测姜黄素对A375和C8161细胞周期的影响,Western印迹检测姜黄素对A375和C8161细胞AKT/mTOR信号通路相关蛋白表达的影响。结果 噻唑蓝法显示,姜黄素分别在5~15 mg/L和5~10 mg/L浓度时,对A375和C8161细胞抑制作用呈量效关系;在0~48 h呈时效关系,与对照组相比差异有统计学意义(P<0.001)。其24 h的IC50分别为10 mg/L和5 mg/L。体外侵袭试验显示,10 mg/L和5 mg/L姜黄素分别作用于A375和C8161细胞72 h,可明显抑制细胞侵袭(P<0.001)。流式细胞仪检测显示,10 mg/L和5 mg/L姜黄素分别作用于A375和C8161细胞24 h,细胞周期阻滞于G2/M期;A375细胞G2/M期比例为35.00%±3.54%,与对照组120.80%±7.46%相比,差异有统计学意义(P<0.001);C8161细胞G2/M期比例为19.33%±4.04%,与对照组85.00%±9.53%相比,差异有统计学意义(P<0.001)。Western印迹检测显示,分别经10 mg/L和5 mg/L姜黄素作用于后,A375和C8161细胞AKT/mTOR信号通路相关蛋白表达水平下降。结论 姜黄素抑制人黑素瘤细胞株A375和C8161增殖及侵袭机制可能与其诱导细胞周期阻滞及抑制AKT/mTOR信号通路活化有关。
黑色素瘤,实验性;姜黄素;细胞增殖;细胞周期;信号传导
恶性黑素瘤(简称恶黑)是一种皮肤恶性肿瘤,以黑素细胞异常增殖并突破基底膜为特征。大部分转移性恶黑对多种化疗药物抵抗[1-2],患者长期生存率较低[3-4],因此,治疗恶黑是亟待攻克的难题。姜黄素是从草本植物姜黄的根茎中提取出来的一种酚类色素,是姜黄的主要有效成分,具有抗炎、抗氧化及抗肿瘤等作用[5]。研究发现,姜黄素能够抑制恶黑A375 细胞增殖并诱导细胞凋亡[6]。我们前期[7]研究发现,谷氨酸受体拮抗剂MK-801及CPCCOEt可诱导人恶黑WM451细胞树突发育,使细胞骨架蛋白重组,导致其树突变细长,呈树枝状,接近正常黑素细胞,并可抑制WM451细胞的增殖、侵袭及迁移[7-8]。本研究旨在探讨姜黄素对恶黑细胞增殖、侵袭、周期的作用及其相关机制。
材料与方法
一、材料
细胞系:人恶黑A375和C8161细胞株购自中国医学科学院基础医学研究所北京协和医学院细胞资源中心。姜黄素(编号A0086,CAS登录号458-37-7,纯度≥98%)购自成都曼斯特生物科技有限公司。二甲基亚砜(DMSO,美国Sigma公司)溶解至浓度为100 g/L于4℃储存备用。高糖DMEM培养基(美国Gibco公司),胎牛血清(FBS,浙江天杭生物科技有限公司),不含乙二胺四乙酸(EDTA)的胰蛋白酶(美国 Hyclone公司),噻唑蓝(MTT)、TritonX-100(美国Sigma公司),基质胶Matrigel(美国BD公司),荧光染料PI(碘化丙锭)、核糖核酸酶RNase(日本 TaKaRa公司)。抗 AKT、p-AKT(Ser473)、p-mTOR (Ser2448)、p-P70S6K(Thr389)兔抗(美国Cell Signaling Technology公司);抗β肌动蛋白鼠抗(美国Sigma公司)。
二、方法
1.细胞培养[9]:A375 与 C8161 细胞均用含 10%胎牛血清的DMEM,常规37℃、5%CO2培养箱中培养,取对数生长期细胞进行实验。姜黄素20mg标准品+200μl二甲基亚砜(DMSO),配置成100mg/L原液。
2.MTT法检测姜黄素对细胞增殖的影响:方法参照文献[9],分实验组和对照组,每组设3个复孔。实验组加入姜黄素原液(100 g/L),终浓度分别为5、10、15、20、25、30、35 mg/L,对照组加等量 DMSO,分别于24、48、72、96 h加入 MTT并于培养箱孵育 4 h,然后加入200 μl DMSO,充分振荡后用酶标仪检测490 nm波长下的各孔吸光度值(A)。细胞增殖抑制率(%)=(1-实验组A值/对照组A值)×100%。
3.体外Matrigel侵袭实验:参照文献[9]。用24孔Transwell小室按说明书方法,每组3个复孔。实验组A375和C8161细胞分别加入含10 mg/L和5 mg/L姜黄素的培养液,姜黄素原液加入量分别为0.01 μl和 0.005 μl,对照组加等量 DMSO,下室按 500 μl/孔加入趋化液(DMEM+10%FBS)。置培养箱中孵育72 h。倒置显微镜下观察穿膜细胞数,光镜(×200)下随机选取5个视野(上、下、左、右、中间)照相、计数。
4.流式细胞仪检测细胞周期:将A375与C8161细胞以合适密度接种于6 cm培养皿,经10、5 mg/L姜黄素(含姜黄素原液量分别为0.4 μl和0.2 μl)作用24 h,对照组加等量DMSO。用不含EDTA的胰酶消化收集处理后的A375细胞,PBS洗涤,用75%预冷乙醇固定细胞4 h,分别用500 μl配好的染色液含480 μl PBS、5μl PI(5 g/L)、5 μl RNase(10g/L)、10μlTritonX100(10%)重悬,置 37℃30min后流式细胞仪检测分析周期变化。
5.Western印迹分析:分别用10、5 mg/L姜黄素(含姜黄素原液量分别为 0.4 μl和 0.2 μl) 处理A375与C8161细胞,对照组加等量DMSO,24 h后收集细胞。加入蛋白裂解液于冰上裂解30 min,离心后收集上清液提取细胞总蛋白,考马斯亮蓝法测定蛋白浓度。方法参照文献[9]。
结 果
一、MTT检测不同浓度姜黄素对A375和C8161细胞增殖的抑制作用
姜黄素能够抑制A375和C8161细胞增殖(表1,2)。姜黄素分别在5~15 mg/L和5~10 mg/L浓度范围内对A375和C8161细胞活性抑制作用成量效关系,在0~48 h内呈时效关系,24 h的IC50分别为10 mg/L和5 mg/L,与对照组相比差异有统计学意义(P<0.001)。
二、体外侵袭实验和流式细胞仪检测姜黄素对A375和C8161细胞侵袭及细胞周期的影响
如表3所示,经终浓度为10 mg/L(IC50)姜黄素培养液处理A375细胞72 h,实验组细胞侵袭数量(35.00±3.54)低于对照组(120.80±7.46),差异有统计学意义(t=23.23,P< 0.001);5 mg/L(IC50)姜黄素培养液处理C8161细胞72 h,实验组细胞侵袭数量(19.33±4.04)低于对照组(85.00±9.53),差异有统计学意义(t=10.98,P<0.001),说明一定浓度的姜黄素能抑制A375细胞(图1)和C8161细胞(图2)侵袭。用姜黄素浓度≥15 mg/L处理A375细胞,浓度≥10 mg/L处理C8161细胞,72 h后观察两组细胞侵袭情况,均未发现侵袭细胞。
表1 不同浓度姜黄素在不同时间对A375细胞增殖抑制率(%,±s)
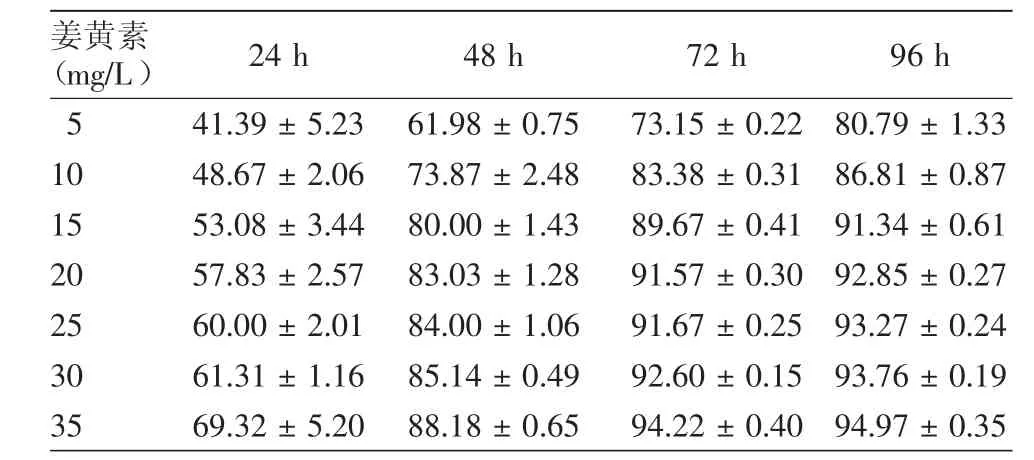
表1 不同浓度姜黄素在不同时间对A375细胞增殖抑制率(%,±s)
注:n=3。二甲基亚砜对照组的抑制率设为“0”;各浓度组与对照组比较,均P<0.001
姜黄素(mg/L) 24 h 48 h 72 h 96 h 5 41.39±5.23 61.98±0.75 73.15±0.22 80.79±1.33 10 48.67±2.06 73.87±2.48 83.38±0.31 86.81±0.87 15 53.08±3.44 80.00±1.43 89.67±0.41 91.34±0.61 20 57.83±2.57 83.03±1.28 91.57±0.30 92.85±0.27 25 60.00±2.01 84.00±1.06 91.67±0.25 93.27±0.24 30 61.31±1.16 85.14±0.49 92.60±0.15 93.76±0.19 35 69.32±5.20 88.18±0.65 94.22±0.40 94.97±0.35
表2 不同浓度姜黄素在不同时间对C8161细胞增殖抑制率(%,±s)
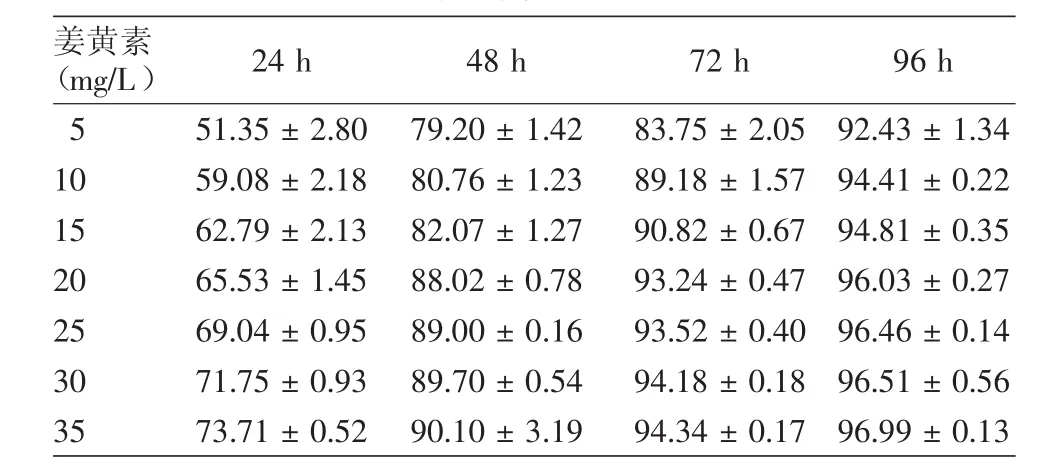
表2 不同浓度姜黄素在不同时间对C8161细胞增殖抑制率(%,±s)
注:n=3。二甲基亚砜对照组的抑制率设为“0”;各浓度组与对照组比较,均P<0.001
姜黄素(mg/L) 24 h 48 h 72 h 96 h 5 51.35±2.80 79.20±1.42 83.75±2.05 92.43±1.34 10 59.08±2.18 80.76±1.23 89.18±1.57 94.41±0.22 15 62.79±2.13 82.07±1.27 90.82±0.67 94.81±0.35 20 65.53±1.45 88.02±0.78 93.24±0.47 96.03±0.27 25 69.04±0.95 89.00±0.16 93.52±0.40 96.46±0.14 30 71.75±0.93 89.70±0.54 94.18±0.18 96.51±0.56 35 73.71±0.52 90.10±3.19 94.34±0.17 96.99±0.13
表3所示,10 mg/L(IC50)姜黄素处理24 h后诱导A375细胞G2/M期阻滞比例为(48.07±7.09)%,与对照组(21.30±0.75)%相比差异有统计学意义(t=6.50,P< 0.01);5 mg/L(IC50)姜黄素处理 24 h后诱导C8161细胞G2/M期阻滞比例为(33.80±1.25)%,与对照组(25.23±2.31)%相比差异有统计学意义(t=5.65,P<0.01);姜黄素组两个细胞株各自对应的G0/G1细胞比例小于DMSO对照组,说明一定浓度姜黄素处理24 h后,可引起A375细胞(图3)和C8161细胞(图4)G2/M期的阻滞。
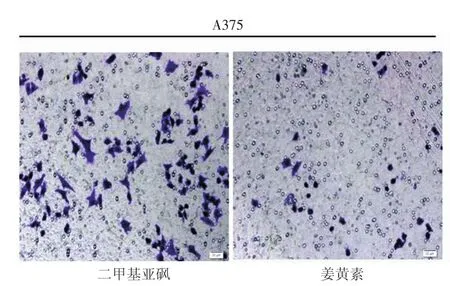
图1 10 mg/L(IC50)姜黄素抑制A375细胞侵袭(结晶紫染色×200)
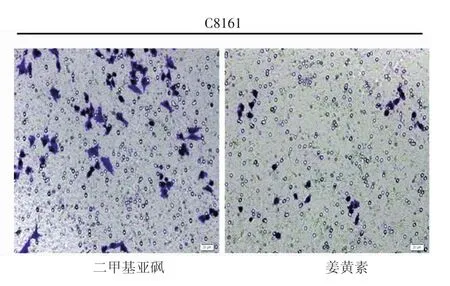
图2 5 mg/L(IC50)姜黄素抑制C8161细胞侵袭(结晶紫染色×200)
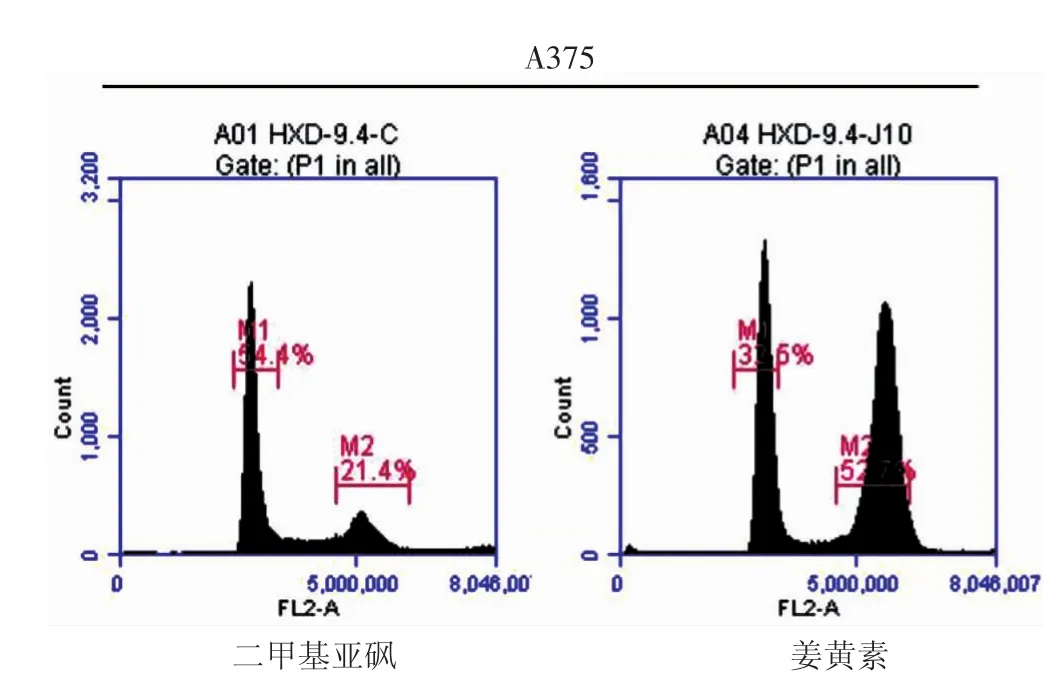
图3 10 mg/L(IC50)姜黄素诱导A375细胞G2/M期阻滞
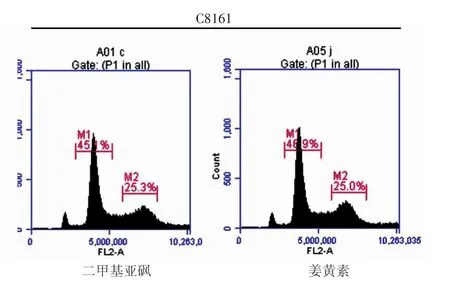
图4 5 mg/L(IC50)姜黄素诱导C8161细胞G2/M期阻滞
三、Western印迹检测姜黄素对A375和C8161细胞AKT/mTOR信号通路活化的抑制作用
采用A375和C8161细胞的IC50(分别为10mg/L和5 mg/L)的姜黄素处理24 h,Western印迹检测结果示 A375和 C8161细胞 p-AKT、p-mTOR、pp70S6K蛋白表达水平均下降,总AKT表达不变(图5),β肌动蛋白为内参照。
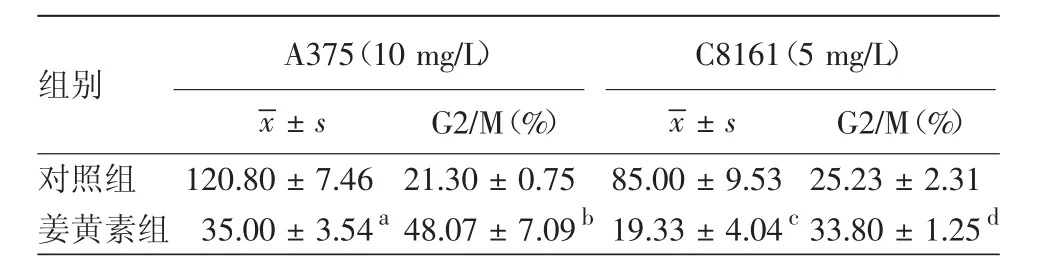
表3 姜黄素对A375和C8161细胞侵袭的抑制及对周期的阻滞作用
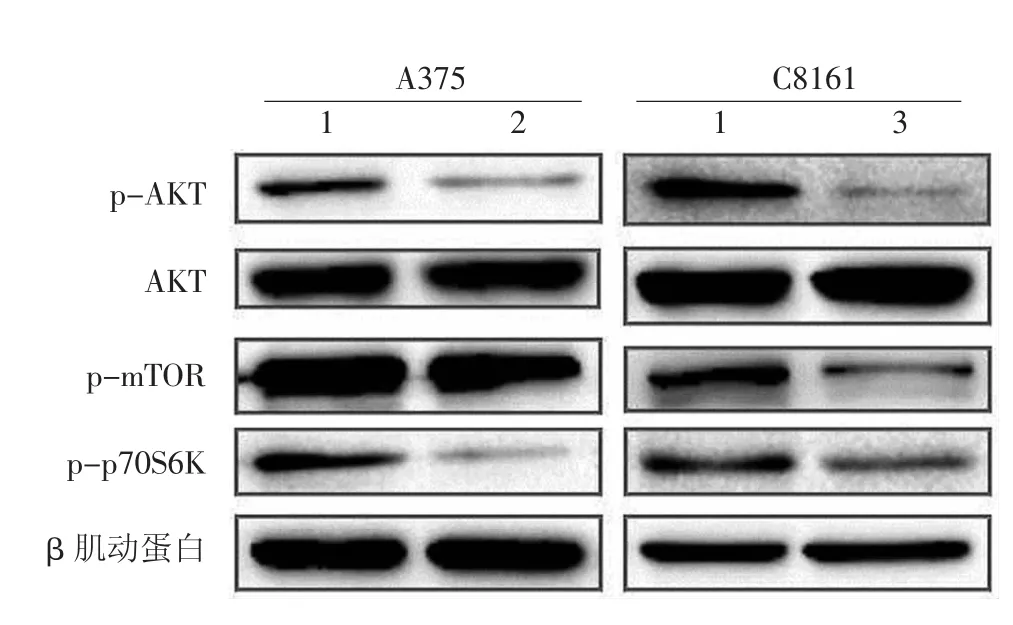
图5 Western印迹检测姜黄素对A375和C8161细胞AKT/mTOR信号通路相关蛋白表达的影响 1:二甲基亚砜;2:10 mg/L(IC50)姜黄素;3:5 mg/L(IC50)姜黄素。β 肌动蛋白为内参照
讨 论
恶黑对常规化疗不敏感,易产生耐药且药物毒副作用大,导致其疗效不佳。越来越多天然或植物来源且毒副作用小的药物,如,姜黄素,被用作化疗辅助药物[10]。细胞运动能力与PI3K/AKT信号通路活化有关。异常活化的PI3K/AKT信号通路能激活其下游分子mTOR[11],mTOR随后活化其下游分子p70S6K,p70S6K的活化能促进肌动蛋白细丝重构,进而促进细胞运动[12]。我们通过Transwell侵袭实验研究显示,姜黄素可显著抑制恶黑细胞侵袭。此外,我们用Western印迹检测发现姜黄素能显著下调AKT、mTOR、p70S6K蛋白的磷酸化水平,而对AKT总蛋白水平无影响。由此,我们推测姜黄素可能是通过抑制PI3K/AKT信号通路活化从而抑制细胞肌动蛋白细丝重构并进而抑制恶黑细胞侵袭。
细胞的增殖、凋亡均是细胞周期依赖性的,细胞周期的失控是肿瘤发病中极其重要的环节。细胞周期素(cyclin)及周期素依赖性激酶(cyclindependent kinases,CDK)是细胞周期的重要调节因子。有研究显示,姜黄素可通过上调p53、p21、p27和 CHK2),诱导恶黑细胞凋亡和 G2/M 期阻滞[13]。另有研究发现,姜黄素类似物D6能够下调细胞周期蛋白 cyclin B1、cyclin F、cdc25B 和 CDK4 的表达,导致恶黑细胞G2/M期阻滞,进而抑制恶黑细胞增殖[14]。本研究通过流式细胞仪检测发现,姜黄素能够诱导恶黑A375及C8161细胞周期明显阻滞于G2/M期,遗憾的是未对其机制进行深入探讨。
PI3K/AKT/mTOR信号通路在包括恶黑在内的多种肿瘤中呈活化状态,且与肿瘤发生有关。有研究发现,姜黄素类似物D6可抑制黑素瘤细胞增殖和诱导细胞凋亡,其机制是抑制PI3K/AKT信号通路的活化[14]。为了阐明姜黄素是否可通过影响PI3K/AKT/mTOR信号通路来影响恶黑,我们采用Western印迹检测发现,姜黄素能显著下调AKT、mTOR、P70S6K蛋白的磷酸化水平,而对AKT总蛋白无影响。我们推测,对PI3K/AKT/mTOR信号通路活化的抑制可能是姜黄素抑制恶黑进展的机制之一。
[1]Soengas MS,Lowe SW.Apoptosis and melanoma chemoresistance[J].Oncogene,2003,22(20):3138-3151.
[2]Molife R,Hancock BW.Adjuvant therapy of malignant melanoma[J].Crit Rev Oncol Hematol,2002,44(1):81-102.
[3]Balch CM,Soong SJ,Gershenwald JE,et al.Prognostic factors analysis of 17,600 melanoma patients:validation of the American Joint Committee on Cancer melanoma staging system [J].J Clin Oncol,2001,19(16):3622-3634.
[4]Balch CM,Buzaid AC,Soong SJ,et al.Final version of the American Joint Committee on Cancer staging system for cutaneous melanoma[J].J Clin Oncol,2001,19(16):3635-3648.
[5]Fang J,Lu J,Holmgren A.Thioredoxin reductase is irreversibly modified by curcumin:a novel molecular mechanism for its anticancer activity[J].J Biol Chem,2005,280(26):25284-25290.
[6]邱实,谭升顺.姜黄素对人黑素瘤A375细胞增殖及凋亡的影响[J].中国皮肤性病学杂志,2009,23(11):706-707.
[7]Song Z,He CD,Liu J,et al.Blocking glutamate-mediated signalling inhibits human melanoma growth and migration[J].Exp Dermatol,2012,21(12):926-931.
[8]李丽丽,单路娟,张媛,等.谷氨酸信号通路调控恶性黑素瘤侵袭与增殖的实验研究[J].中华皮肤科杂志,2011,44(3):186-190.
[9]韩晓东,孟松树,程为,等.芹菜素抑制人恶性黑素瘤细胞增殖及侵袭的研究[J].中华皮肤科杂志,2015,48(2):120-124.
[10]Duarte VM,Han E,Veena MS,et al.Curcumin enhances the effect of cisplatin in suppression of head and neck squamous cell carcinoma via inhibition of IKKβ protein of the NFκB pathway[J].Mol Cancer Ther,2010,9(10):2665-2675.
[11]Sekulic A,Hudson CC,Homme JL,et al.A direct linkage between the phosphoinositide 3-kinase-AKT signaling pathway and the mammalian targetofrapamycin in mitogen-stimulated and transformed cells[J].Cancer Res,2000,60(13):3504-3513.
[12]Berven LA,Willard FS,Crouch MF.Role of the p70(S6K)pathway in regulating the actin cytoskeleton and cell migration[J].Exp Cell Res,2004,296(2):183-195.
[13]D′Angiolella V,Donato V,Vijayakumar S,et al.SCF(Cyclin F)controls centrosome homeostasis and mitotic fidelity through CP110 degradation[J].Nature,2010,466(7302):138-142.
[14]Rozzo C,Fanciulli M,Fraumene C,et al.Molecular changes induced by the curcumin analogue D6 in human melanoma cells[J].Mol Cancer,2013,12:37.
2014-07-02)
(本文编辑:吴晓初)
Effects of curcumin on the AKT/mTOR signaling pathway in human melanoma cell lines A375 and C8161
Han Xiaodong,Zhou Youyou,Zheng Siwen,Li Zhen,Song Zhiqi.Department of Dermatology,First Affiliated Hospital of Dalian Medical University,Dalian 116011,China
Song Zhiqi,Email:szqdalian@163.com
ObjectiveTo explore molecular mechanisms underlying thein vitrocounteracting effect of curcumin on malignant melanoma.MethodsCultured A375 and C8161 human melanoma cells were cultivatedin vitro,and randomly divided into several test groups and a control group to be treated with different concentrations of curcumin and dimethylsulfoxiderespectivelyfordifferentdurations.Then,methylthiazolyltetrazolium(MTT)assay,Transwellassay,flow cytometryandWesternblotwere performedto evaluate the effectofcurcuminonthe proliferation,invasionandcellcycle of,as well as expressions of AKT/mTOR signaling pathway-related proteins in A375 and C8161 cells respectively.Statistical analysiswascarriedoutbyusingttest.ResultsMTTassayshowedthatthetreatmentwithcurcuminof5-35mg/Lfor24-96 hours significantly inhibited the proliferation of both A375 and C8161 cells compared with that with dimethyl sulfoxide(allP<0.001),andthe inhibitoryeffectwasina dose-dependentmannerwithinthe range of5-15mg/LforA375cellsand within the range of 5-10 mg/L for C8161 cells,and in a time-dependent manner from 0 to 48 hours for both cells.After treatmentfor24hours,the50%inhibitoryconcentration(IC50)ofcurcuminagainstA375cellsandC8161cellswas10mg/L and 5 mg/L respectively.Transwell assay demonstrated that the invasion of A375 and C8161 cells was significantly suppressed by 72-hour treatment with curcumin at 10 mg/L and 5 mg/L respectively (bothP<0.001).Flow cytometry showed that the cell cycle of A375 and C8161 cells was arrested at G2/M phase after 24-hour treatment with curcumin at 10 mg/Land5mg/Lrespectively,withsignificantdifferences in the proportion of A375 cells and C8161 cells in G2/M phase between the test group and control group (A375 cells:35.00% ±3.54%vs.120.80% ±7.46%,P<0.001;C8161 cells:19.33% ±4.04%vs.85.00% ±9.53%,P<0.001).Western blot revealed that the expressions of AKT/mTOR signaling pathway-related proteins were decreased in A375 and C8161 cells after 24-hour treatment with 10 mg/L and 5 mg/L curcumin respectively.ConclusionCurcumin can inhibit the proliferation and invasion of A375 and C8161 cells,likely byblockingcellcycleandinhibitingactivationoftheAKT/mTORsignalingpathway.
Melanoma,experimental;Curcumin;Cell proliferation;Cell cycle;Signal transduction
10.3760/cma.j.issn.0412-4030.2015.06.004
国家自然科学基金(81472865、81171491);辽宁省自然科学基金(201102056、2014023005)
116011大连医科大学附属第一医院皮肤科
宋智琦,Email:szqdalian@163.com
