猫初级视皮层BDNF表达年龄相关性差异研究
2015-12-01童传旺季慕寅许月明
童传旺,季慕寅,许月明,曹 侃
(芜湖职业技术学院 生物工程学院,安徽 芜湖 241000)
视觉功能是高等哺乳类动物获取外界信息的重要途径(约占信息总量的70%以上)。伴随年龄增长过程,视觉功能亦会出现非病理性的衰退现象[1]。关于视觉衰老的神经机制探讨研究,也成为脑机制研究热点。脑源性神经营养因子(Brain-derived neurotrophic factor,BDNF)及其受体介导的对于脑功能活动方面的影响机制研究获得了较为广泛的认识。研究发现,BDNF及其受体是参与神经系统的神经元发育、存活、损伤修复、突触可塑性等机理的重要调节因素[2]。初级视皮层作为处理视觉信息的高级中枢,衰老对其脑源性神经营养因子相关的年龄表达差异情况尚未有报道。
本研究以视觉系统研究的传统模型动物猫初级视皮层为研究对象,采用免疫组织化学方法,比较青年组与老年组猫初级视皮层体中BDNF的表达情况,观察与定量比较实验数据结果,以期揭示视皮层水平上的视觉功能衰退影响因素及可能机制。
1 材料和方法
1.1 实验动物及材料试剂
本研究选取猫作为实验动物,动物个体体重2~3.5kg,为排除眼疾对实验结果产生影响,实验动物须经严格的眼部筛查。选取1~3龄猫4只组成青年组,10~13龄猫4只组成老年组。按40mg/kg体重注射盐酸氯胺酮至动物深度麻醉后,立即开胸经心脏灌注0.9%生理盐水,观察到肝脏发白,续灌注含10%福尔马林与2.5%戊二醛混合的0.1mol/L磷酸缓冲液(200mL/kg体重,PBS pH7.2~7.4)预固定组织。开颅取出脑干至上述预固定液中固定2h。依照猫脑立体定位图谱冠状切取初级视皮层组织,将组织块移入30%蔗糖溶液(含2.5%戊二醛、10%福尔马林)中静置至组织块沉底。冰冻切片机作50μm厚连续冠切片,每隔3片取2片为一组,分别用于BDNF免疫组织化学标记及阴性对照,每只猫取10组。
1.2 免疫组织化学染色
按常规免疫组织染色步骤,依次将冰冻切片以3%H2O2孵育处理后蒸馏水冲洗;再以含0.3%TritonX-100 PBS溶液孵育处理后,再滴加5%胎牛血清蛋白继续孵育处理;倾去血清后,滴加一抗(兔抗鼠BDNF抗体,稀释度1∶100),4℃孵育处理;再滴加二抗(羊抗兔IgG工作液),室温孵育处理后;最后滴加三抗SABC试剂,室温孵育处理;冲洗后DAB显色,梯度酒精脱水后二甲苯透明处理,最后以中性树胶封片。阴性对照片处理时,除滴加一抗时以PBS液替代,其余步骤同步操作。
实验所用BDNF抗体及免疫组织化学试剂盒、DAB均购于武汉博士德公司。
1.3 形态学观察及数据采集分析
分别随机选取切片青、老年组BDNF免疫反应切片各20张,置于Olympus BX-51型显微镜下观察,Image-Pro Express 6.0图像分析软件采集图像,定量统计分析相关形态学参数,统计初级视皮层中各层BDNF免疫阳性细胞密度及免疫阳性反应的强弱指标(免疫反应吸光度值)。数据统计人员在未知分组情况下进行细胞计数和吸光度测量。
将BDNF免疫染色切片先置于低倍镜(×40)下获取有效图像,再调至高倍镜(×100)下观察分层结构,最后至高倍镜(×400)下分别于各层中选取10个视野(50μm×50μm)计数BDNF免疫阳性细胞数目,取均值换算为细胞密度(cells/mm2)。计数为一个BDNF免疫阳性细胞的标准是胞体含明显的免疫阳性物质且具有细胞核。每张免疫反应切片,随机选取的20个视野采集图像后借助Image-Pro Express 6.0图像分析软件测量平均吸光度值,测量值作为免疫阳性反应强弱的指标。采集数据由SPSS 13.0统计软件行ANOVA统计学分析,差异具统计学意义以P<0.01为标准。实验数据以平均值±标准差(mean±SD)表示。
2 结果与分析
2.1 免疫染色切片观察结果
青年组及老年组猫初级视皮层各层(自初级视皮层表面向内可分为六层:分别为分子层I、外颗粒层II、外锥体层III、内颗粒层IV、内锥体层V和多形层VI)中均可见棕黄或黄褐色的BDNF阳性细胞胞体及纤维分布(图1)。
2.2 组内数据统计分析结果
组内数据统计结果显示,无论青年猫与老年猫初级视皮层中,BDNF免疫阳性细胞密度呈现层次差异性:第Ⅱ-Ⅲ、Ⅴ、Ⅵ层阳性细胞细胞密度无显著差异(P>0.05,表1),但第Ⅱ-Ⅲ、Ⅴ、Ⅵ层阳性细胞细胞密度较I层、Ⅳ层大(P<0.01,表1);其中第Ⅳ层密度较第Ⅰ层大密度更大,即第I层最小(P<0.01,表1)。青年猫、老年猫组内个体间无显著差异(P>0.05,表1)。
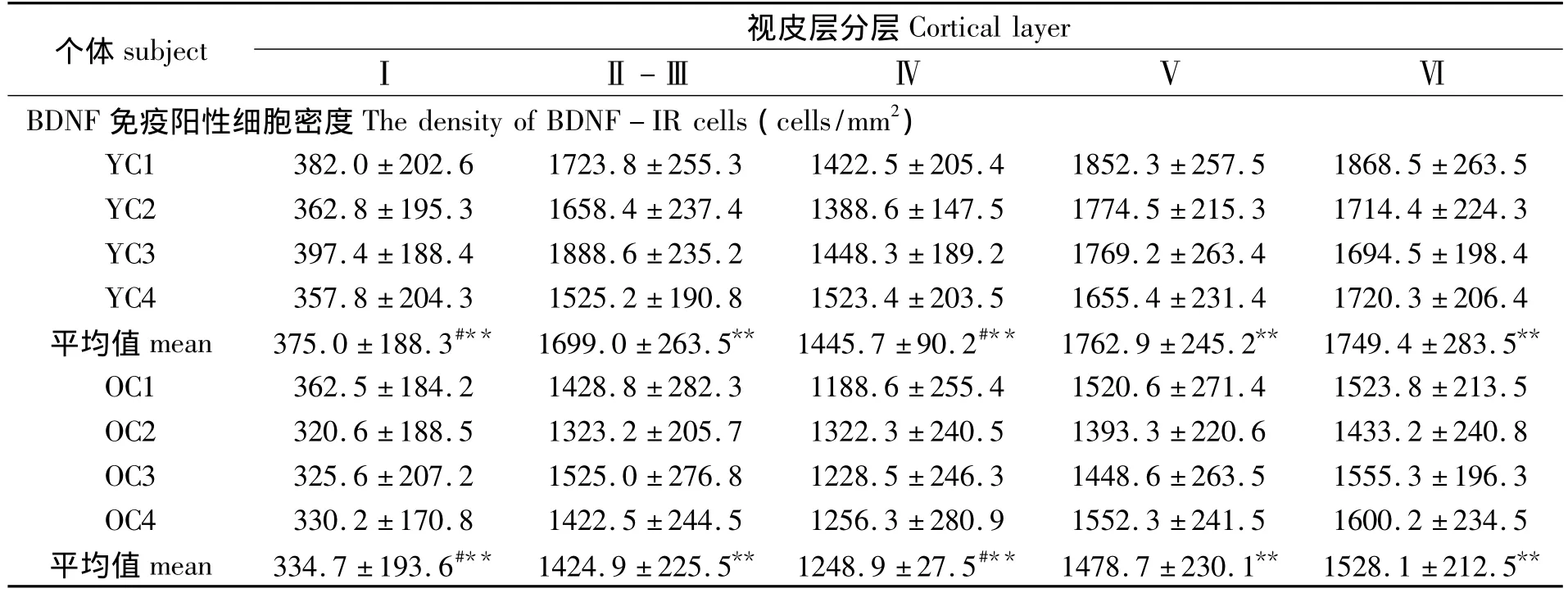
表1 青年组及老年组猫初级视皮层中BDNF免疫阳性细胞密度比较(mean±SD)Table 1 A comparison on density of BDNF-IR cells in the primary visual cortex of young and old cats(mean±SD)
2.3 组间数据统计分析结果
组间数据统计分析结果显示,老年猫初级视皮层各层较青年猫相对应分层中的BDNF阳性细胞密度呈现一致的显著下降(P<0.01,表1),各层平均下降幅度分别为I层10.7%、Ⅱ-Ⅲ层16.1%、IV层13.6%、V层16.1%、VI层12.7%;老年猫较青年猫的BDNF免疫反应的平均吸光度值也出现显著下降(P<0.01,图 2),下降幅度为 22.2%。
3 讨论
视觉系统为高等哺乳动物获取外界信息的主要神经功能系统,视网膜-外膝体-视皮层三级结构形成了直接传递和处理视觉信息的通道。视皮层作为视觉处理的高级中枢,其在衰老过程中会出现如视锐度(Visual acuity)、对比敏感度(Contrast sensitivity)以及对视觉刺激选择性下降等反应性功能衰退现象[3]。神经系统功能衰退的形态学变化主要表现为神经元数量的显著减少(如神经元丢失,胶质细胞凋亡等)与神经突触联系功能的削弱[4-5];神经功能衰老机制的研究更多地集中于探讨、解释神经活动的基本结构和功能单位——突触的联系、有效性及可塑性(Synaptic plasticity)机制,较多的研究揭示[6-8],伴随年龄的增长,多因素综合作用致使突触可塑性下降。BDNF及其受体介导的信号功能对于突触可塑性的重要作用己被广泛关注与探讨[9-10]。BDNF是神经生长因子家族中的重要成员,且是脑中分布最多的神经营养因子。其可以选择性地与其特异性受体结合发挥重要作用参于调节神经系统的各项活动[2]。免疫组织研究发现,BDNF及其受体均可由脑内神经元及非神经元(如胶质细胞)分泌,并广泛分布于成年脑组织[11-12]。
本实验中免疫标记结果较为系统地反映了猫初级视皮层中神经元及胶质细胞BDNF的增龄性表达差异情况。BDNF在猫初级视皮层各层中均有表达,且老年组较青年组表达呈现一致性下降。此结果与在老龄大鼠及阿尔茨海默症(Alzheimer’s disease,AD)患者海马等处发现的BDNF增龄性表达下调结果相一致[13-14]。研究表明,BDNF对于GABA能神经元的存活和功能表达具有重要营养支持作用[15-18]。此前我们有实验结果表明,老年组相较于青年组猫初级视皮层各层神经元总数未见显著性变化,同时,猫初级视皮层GABA阳性神经元出现增龄性数量下降现象[19]。综合上述结果,我们推测视皮层水平上视觉功能的衰退可能并非是神经元数量的减少,而更倾向于神经营养因子介导的特殊神经元突触可塑性的下降所致。且初级视皮层水平上的GABA能神经元的抑制性调节不足可能是BDNF及其受体信号介导突触联系功能减弱的结果。其可能的影响机制倾向于老年个体因BDNF及其受体分泌不足,抑制性突触联系的形态和功能稳定性下降,导致最终的视觉信息传递加工过程中的丢失而表现为视觉功能的衰退。
4 结论
猫初级视皮层中BDNF表达水平存在增龄性下降,提示脑源性神经营养因子活动减弱引起的突触可塑性的改变可能是引起视觉功能衰退的重要原因之一。
[1]Hua T M.Functional degradation of visual cortical cells in old cats[J].Neurobiology of Aging,2006,27(1):155 -162.
[2]马楼艳.脑源性神经营养因子与脑功能[J].国际老年医学杂志,2010,31(3):110-113.
[3]梅斌.年龄相关的视觉功能衰退研究进展[J].眼科研究,2006,24(1):107-110.
[4]Devaney.Neuron loss in the aging visual cortex of man[J].J Gerontol,1980,35(6):836 -841.
[5]Wickelgren.I.For the coflex,neuron loss may be less than thought[J].Science,1996,273(5271):48 -50.
[6]Davies H A,Kelly A,Dhanrajan T M,et al.Synaptophysin immunogold labeling of synapses decreases in dentate gyrus of the hippocampus of aged rats[J].Brain Res,2003,986:191 -195.
[7]Arendt T.Neurodegeneration and plasticity[J].Int J Dev Neurosci,2004,22:507 -514.
[8]Selkoe D J.Alzheimer’s diseaseis a synaptic failure[J].Science,2002,298:789 -791.
[9]Coffey E T,Akerman K E,Courtney M J.Brain deived neurotrophic factor induces a rapid upregulation of synaptophysin and tau poteins via the neurotophin receptor TrkB in rat cerebellar granule cells[J].Neurosci Lett,2007,227:177 -180.
[10]Vaynman S,Ying Z,Gomez-Pinilla F,et al.Hippocampal BDNF mediates the efficacy of exercise on synaptic plasticity and cognition[J].European Journal of Neuroscience,2004,20:2580-2590.
[11]Tyler W J,Pozzo-Miller L D.BDNF enhances quantal neurotransmitter release and increases the number of docked vesicles at the active zones of hippocampal excitatory synapses[J].J Neurosci,2001,21(12):4249 -4258.
[12]Drake C T,Milner,T A,Patterson S L.Ultrastructural localization of full-length trkB immunoreactivity in rat hippocampus suggests multiple roles in modulating activity-dependent synaptic plasticity[J].J Neurosci,1999,19(18):8009-8026.
[13]Corll S D,Nancy Y,Ronald M,et al.Expression of BDNF and trkB as a function of age and cognitive performance[J].Brain Res,1998,812(l-2):200 -218.
[14]Salehi A,Verhaagen J,Swaab D F,et al.Co-localization of high affinity neuortrophin receptors in nucleus basal is of meynert neurons and irdifferential reduction in Alzheimer’s disease[J].Neurosci,1996,75(2):375 -387.
[15]Vaz S H.Brain-derived neurotrophic factor(BDNF)enhances GABA transport by modulating the trafficking of GABA transporter-1(GAT-1)from the plasma membrane of rat cortical astrocytes[J].J Biol Chem,2011,286(47):40464-40476.
[16]Lund I V.BDNF selectively regulates GABAA receptor transcription by activation of the JAK/STAT pathway[J].Sci Signal,2008,1(41):9.
[17]Bulleit B R F,Hsieh T.MEK inhibitors block BDNF-dependent and -independent expression of GABA(A)receptor subunit mRNAs in cultured mouse cerebellar granule neurons[J].Brain Res Dev Brain Res,2000,119(1):1 -10.
[18]Waterhouse E G.BDNF promotes differentiation and maturation of adult-born neurons through GABAergic transmission[J].J Neurosci,2012,32(41):14318 -30.
[19]Diao Jiangang.Age - related Changes of Glu/GABA Expression in the Primary Visual Cortex of Cat[J].Zoological Research,2009,30(1):38-44.
