不饱和半夹芯式16e化合物Cp*Ir(S2C2B10H10)与邻、间位取代苯基叠氮的反应性
2015-11-30钟伟燕红
钟伟 燕红
不饱和半夹芯式16e化合物Cp*Ir(S2C2B10H10)与邻、间位取代苯基叠氮的反应性
钟伟*,1,2燕红*,2
(1嘉兴学院生物与化学工程学院,嘉兴314001)
(2南京大学配位化学国家重点实验室,南京210093)
考虑取代基的位置和电子效应对反应体系的影响,本文系统地研究了16e化合物Cp*Ir(S2C2B10H10)(1)与邻、间位取代苯基叠氮的反应。研究结果表明:与邻、间位取代苯基叠氮反应均生成苯环邻位碳发生C-H活化形成C-S键的金属配合物。这些配合物通过核磁(1H、11B、13C)、红外、质谱、元素分析和单晶结构解析进行了全面地表征。在光照反应结果的基础上,提出了形成这类产物的自由基机理。
半夹芯式配合物;取代苯基叠氮;反应性;机理
0 引言
在金属有机化学领域,叠氮化合物与有机金属化合物的反应吸引了化学工作者的极大关注,并因此制备分离得到了许多结构新颖、成键模式奇特的化合物[1-2],大大丰富了金属有机化学的基础理论知识,也为设计合成具备光、电、磁、催化等各种性质的材料和药物提供了丰富多样的筛选底物。作为一类重要的叠氮化合物,苯基类叠氮因其在生物分子的光亲和标记[3-4]、聚合物化学[5-6]以及影印石版术[7]方面有着重要的应用而受到广泛的关注。其中,苯基类叠氮作为有机骨架被广泛地应用于制备金属-亚胺基类化合物和金属叠氮化合物[1,8-9]。尽管苯基类叠氮与过渡金属配合物的反应及其形成产物的进一步功能化已有许多报道[1,8-12],但涉及C-H活化以构建新的C-C键或C-X键(X=N,O,S等杂原子)的结果却很少。Stephan教授课题组报道了苯基类叠氮可以氧化Ni(Ⅱ)金属前驱物,并通过分子内偶联形成新的C-X键(X=C,N)[13]。另一个例子就是我们之前报道的不饱和半夹芯式16e化合物Cp*Ir(S2C2B10H10) (1)与2,6-二甲基苯基叠氮的反应性,通过光或热诱导的C-H活化或吸电子基团的迁移,构建形成新的C-C键或C-S键的金属配合物[14]。
最近,我们在研究化合物1与间硝基苯基叠氮(L1)的反应中分离得到多个历经C-H键活化形成CC键和C-S键的产物2a,3a和4~6[15](Scheme 1)。考虑苯基类叠氮取代基的位置和电子效应可能对反应体系产生一定的影响,本文中我们将系统地研究16e化合物1与邻、间位取代苯基叠氮的反应,探索研究这类反应的规律。
1 实验部分
各种取代苯胺、亚硝酸钠、叠氮化钠、四氟硼酸(50wt%水溶液)以及其他所用到的试剂均为分析纯;化合物1按照与文献[16]类似的方法合成。
1.2 测试仪器
Bruker AM-500型核磁共振仪(500 MHz,TMS,CDCl3);Vector-22 Bruker型红外光谱仪(KBr压片);Elementar vario ELⅢ元素分析仪;X-6显微熔点测定仪;XPA-7型(G8)光化学反应仪;Finingan MAT TSQ7000质谱仪;晶体结构测定采用Bruker SMART Apex CCDⅡ单晶衍射仪。

Scheme 1 Reactivity of 16e complex 1 with L1
1.3 配体及配合物的合成
1.3.1 邻、间位取代苯基叠氮的合成(Scheme 2)[17]
称取邻位或间位取代苯胺(10 mmol)溶于25 mL四氟硼酸的水溶液(40%)中,冰浴下向其中加入15 mL的NaNO2(1.035 g,15 mmol)水溶液,0℃下搅拌反应0.5 h。然后向反应液逐滴加入10 mL的NaN3(975 mg,15 mmol)水溶液(注意:控制逐滴缓慢加入,当起泡厉害时可以向反应液中加入适量乙醚消泡),0℃至室温搅拌反应3 h。停止反应后,向反应液中加入适量的醋酸钠调节pH值为5~7之间,经萃取、干燥、层析柱分离后得苯基类叠氮化合物(收率为78%~97%,Scheme 3)。IR(KBr,ν/cm-1):2 108~2 115(N3)。
4)词汇权重。查询语句中每个词的权重。在检索时,并不是所有的查询关键词的重要性是一致的。一般,名词比动词重要,专业词汇比常用词汇重要。词汇权重可以在查询中设定。

Scheme 2 Synthesis of o-and m-substituted phenyl azides

Scheme 3 Prepared o-and m-substituted phenyl azides
1.3.2 配合物的合成
一般实验步骤(Scheme 4和Scheme 5):
方法一:氩气保护条件下,化合物1(106.8 mg,0.2 mmol)和相应的取代苯基叠氮(1.0 mmol)在甲苯中于80℃加热或回流5~48 h。减压抽除溶剂后,初产物溶入少量的二氯甲烷,然后通过柱层析分离得到纯的产物。
方法二:化合物1(53.4 mg,0.1 mmol)和相应的取代苯基叠氮(0.5 mmol)的甲苯溶液在氩气保护下用500 W的高压汞灯光照1~3 h。减压抽除溶剂后,初产物溶于少量的二氯甲烷,然后通过柱层析分离得到纯的产物,产率比加热条件时低。
2b(44.8 mg,34.0%):黄褐色固体。1HNMR(CDCl3): δ6.78(t,J=8.0 Hz,1H,ArH),6.47(d,J=7.5 Hz,1H, ArH),6.17(d,J=7.5 Hz,1H,ArH),3.92(s,1H,NH),1.76 (s,15H,CH3,Cp*)。11B{1H}NMR(CDCl3):δ-1.8(2B),-3.2(3B),-4.4(2B),-7.1(2B),-7.9(1B)。13C NMR (CDCl3):δ8.55(CH3,Cp*),90.81(carborane),92.58(C,Cp*),108.40(carborane),111.52(C,Ph),112.01(CH,Ph),115.41(CH,Ph),133.91(CH,Ph),137.24(C,Ph),166.66(C,Ph)。ESI-MS(m/z):660.25(100%)[M+H]+。元素分析(%,按C18H29B10IrNClS2计算,括号内为计算值):C 32.91(32.79),H 4.68(4.43),N 1.98(2.12)。IR (KBr,ν/cm-1):2 582.6(B-H)。
2c(41.7 mg,32.6%):黄褐色固体。1HNMR(CDCl3): δ6.78(t,J=7.5 Hz,1H,ArH),6.43(d,J=7.0 Hz,1H,ArH),6.00(d,J=7.0 Hz,1H,ArH),3.68(s,1H,NH),2.46 (s,3H,CH3),1.76(s,15H,CH3,Cp*)。11B{1H}NMR (CDCl3):δ-1.9(2B),-3.2(3B),-4.4(2B),-7.3(2B),-9.5 (1B)。13C NMR(CDCl3):δ8.48(CH3,Cp*),20.08(CH3),91.31(carborane),92.13(C,Cp*),93.14(carborane),108.97 (C,Ph),113.08(CH,Ph),114.34(CH,Ph),133.11(CH,Ph),140.98(C,Ph),165.21(C,Ph)。ESI-MS(m/z):639.42 (22%)[M]+,640.42(26%)[M+H]+,654.33(100%)[M+ CH3]+。元素分析(%,按C19H32B10IrNS2计算,括号内为计算值):C 35.79(35.72),H 5.28(5.05),N 2.12(2.19)。IR(KBr,ν/cm-1):2 565.4(B-H)。

Scheme 4 Reactions of complex 1 with m-substituted phenyl azides

Scheme 5 Reactions of complex 1 with o-substituted phenyl azides
2d(44.3 mg,33.8%):黄褐色固体。1HNMR(CDCl3): δ6.86(t,J=8.0 Hz,1H,ArH),6.20(d,J=8.0 Hz,1H,ArH),5.62(d,J=8.0 Hz,1H,ArH),3.82(s,3H,OCH3),3.75(s,1H,NH),1.75(s,15H,CH3,Cp*)。11B{1H}NMR (CDCl3):δ-1.9(2B),-3.2(3B),-5.0(2B),-7.1(2B),-9.1 (1B)。13C NMR(CDCl3):δ8.52(CH3,Cp*),55.06(OCH3),90.72(carborane),92.26(C,Cp*),92.69(CH,Ph),101.11 (C,Ph),108.62(carborane),109.61(CH,Ph),134.49(CH,Ph),160.25(C,Ph),167.38(C,Ph)。ESI-MS(m/z):656.32 (100%)[M+H]+。元素分析(%,按C19H32B10IrNOS2计算,括号内为计算值):C 35.03(34.84),H 5.05(4.92),N 2.19(2.14)。IR(KBr,ν/cm-1):2 576.9(B-H)。
3b(69.4 mg,52.6%)。黄褐色固体。1H NMR (CDCl3):δ7.10(d,J=8.0 Hz,1H,ArH),6.56(s,1H,ArH),6.18(d,J=8.0 Hz,1H,ArH),3.73(s,1H,NH),1.77(s,15H,CH3,Cp*)。11B{1H}NMR(CDCl3):δ-1.6(2B),-2.9 (3B),-5.0(2B),-6.9(2B),-9.4(1B)。13C NMR(CDCl3):δ 8.57(CH3,Cp*),89.51(carborane),92.68(C,Cp*),106.99 (carborane),110.32(C,Ph),111.90(CH,Ph),115.33(CH,Ph),134.26(CH,Ph),139.55(C,Ph),165.46(C,Ph)。ESI-MS(m/z):660.33(95%)[M+H]+。元素分析(%,按C18H29B10IrNClS2计算,括号内为计算值):C 32.65 (32.79),H 4.52(4.43),N 2.07(2.12)。IR(KBr,ν/cm-1):2 583.6(B-H)。
3c(64.1 mg,50.2%)。黄褐色固体。1H NMR (CDCl3):δ7.06(d,J=8.0 Hz,1H,ArH),6.41(s,1H,ArH),6.04(d,J=8.0 Hz,1H,ArH),3.56(s,1H,NH),2.22 (s,3H,CH3),1.77(s,15H,CH3,Cp*)。11B{1H}NMR (CDCl3):δ-1.9(2B),-3.3(3B),-5.1(2B),-7.1(2B),-9.4 (1B)。13C NMR(CDCl3):δ8.47(CH3,Cp*),21.11(CH3),89.69(carborane),92.31(C,Cp*),107.84(carborane),108.62(C,Ph),113.56(CH,Ph),116.39(CH,Ph),133.23 (CH,Ph),143.38(C,Ph),165.46(C,Ph)。ESI-MS(m/z):639.42(25%)[M]+,654.33(100%)[M+CH3]+。元素分析(%,按C19H32B10IrNS2计算,括号内为计算值):C 35.83(35.72),H 5.01(5.05),N 2.08(2.19)。IR(KBr,ν/ cm-1):2 569.3(B-H)。
3d(66.5 mg,50.8%)。黄褐色固体。1H NMR (CDCl3):δ7.07(d,J=7.0 Hz,1H,ArH),6.02(s,1H,ArH),5.89(d,J=7.0 Hz,1H,ArH),3.72(s,3H,OCH3),3.68(s,1H,NH),1.76(s,15H,CH3,Cp*)。11B{1H}NMR(CDCl3):δ-2.0(2B),-3.1(3B),-5.1(2B),-7.1(2B),-9.0(1B)。13C NMR(CDCl3):δ8.52(CH3,Cp*),54.94(OCH3),89.66 (carborane),92.26(C,Cp*),97.86(CH,Ph),101.60(CH,Ph),104.11(C,Ph),107.63(carborane),134.03(CH,Ph),164.23(C,Ph),166.79(C,Ph)。ESI-MS(m/z):656.50 (100%)[M+H]+。元素分析(%,按C19H32B10IrNOS2计算,括号内为计算值):C 34.97(34.84),H 4.99(4.92),N 2.02(2.14)。IR(KBr,ν/cm-1):2 578.5(B-H)。
7a(76.1 mg,56.8%)。紫色固体。1H NMR(CDCl3):δ8.09(d,J=8.0 Hz,1H,ArH),7.96(s,1H,NH),7.51(d,J=8.0 Hz,1H,ArH),6.29(t,J=8.0 Hz,1H,ArH),1.83 (s,15H,CH3,Cp*)。11B{1H}NMR(CDCl3):δ-1.5(2B),-2.7(3B),-4.7(2B),-6.9(2B),-9.5(1B)。13C NMR (CDCl3):δ8.68(CH3,Cp*),89.48(carborane),93.62(C,Cp*),103.64(carborane),110.94(CH,Ph),123.14(C, Ph),132.44(CH,Ph),133.64(C,Ph),142.60(CH,Ph),158.45(C,Ph)。ESI-MS(m/z):670.25(76%)[M]+。元素分析(%,按C18H29B10IrN2O2S2计算,括号内为计算值):C 32.14(32.27),H 4.59(4.36),N 4.03(4.18)。IR(KBr,ν/ cm-1):2 573.6(B-H)。
7b(65.4 mg,51.2%)。黄褐色固体。1H NMR (CDCl3):δ7.12(d,J=8.0 Hz,1H,ArH),6.81(d,J=8.0 Hz,1H,ArH),6.18(t,J=7.5 Hz,1H,ArH),3.76(s,1H,NH),2.16(s,3H,CH3),1.78(s,15H,CH3,Cp*)。11B{1H} NMR(CDCl3):δ-1.7(2B),-3.0(3B),-5.1(2B),-7.0 (2B),-9.4(1B)。13C NMR(CDCl3):δ8.54(CH3,Cp*),89.65(carborane),92.41(C,Cp*),107.64(carborane),110.83(C,Ph),111.59(CH,Ph),123.42(C,Ph),131.90 (CH,Ph),132.75(CH,Ph),164.11(C,Ph)。ESI-MS(m/ z):638.33(100%)[M]+。元素分析(%,按C19H32B10IrNS2计算,括号内为计算值):C 35.91(35.72),H 5.13 (5.05),N 2.06(2.19)。IR(KBr,ν/cm-1):2 570.2(B-H)。
1.4 晶体结构测定
本文涉及的单晶均采用二氯甲烷正己烷混合溶剂在常温或低温缓慢挥发的方法获得。在Bruker SMART APEX CCD衍射仪上收集强度数据。采用石墨单色器单色化了的Mo Kα射线(λ=0.071 073 nm),采用ω-2θ扫描方式,其衍射数据用SAINT程序进行还原处理,用SADABS程序进行数据校正[18]。晶体初始结构模型,用SHELXS-97结构解析程序,选用直接法解出或Patterson法解出[19]。对全部非氢原子坐标及其各向异性热参数进行了全矩阵最小二乘法修正。所有计算用SHELXL-97程序完成[20]。
CCDC:1046784,2b;1046785,2c;1046786,2d;1046787,3b;1046788,3c;1046789,3d;1046790,7a;1046791,7b。
2 结果与讨论
2.1 邻、间位取代苯基叠氮与化合物1的反应性
类似化合物1与L1的反应[15],由于间位取代苯基叠氮L2~L4存在2个邻位空位可以发生环金属化,与化合物1在加热的甲苯中反应也得到两类分别在2个邻位碳发生环金属化的产物2b~2d和3b~3d(Scheme 4)。与L1不同的是,L2~L4与化合物1的反应比较简单,仅仅分离得到2b~2d和3b~3d两类产物,并且分离总产率均在80%以上,表现出很高的转化率。该反应在产物分布上没有表现明显的选择性,从产物分离得到的产量来看,产物m2∶m3≈2∶3。而邻位取代的苯基叠氮L5和L6因其只有1个邻位空位,与化合物1反应只能分离得到一类环金属化形成S-C键的产物7a和7b(Scheme 5)。
值得注意的是,不管取代基在邻位还是在间位,含吸电子基团的苯基叠氮比含给电子基团的苯基叠氮表现出更好的反应活性,具体体现在需要更低的反应温度和更短的反应时间上。例如含硝基的L1和L5与化合物1在80℃反应5 h即可完全转化,而含甲基的L3和L6则需在甲苯溶液中回流24 h以上。可能的原因为含强吸电子基团的苯基叠氮在加热条件下容易失去一分子的N2,从而使得后续的转化反应变得更容易进行。
2.2 配合物的表征
我们对所有产物进行了核磁(1H,11B,13C)、红外、质谱及元素分析等测试方法的完全表征,并且用X-射线单晶衍射测试确认其结构。

图1 化合物2b~2d的分子结构图(30%的椭球率)Fig.1 Molecular structures of complexes 2b~2d(30%displacement ellipsoids)

图2 化合物3b~3d的分子结构图(30%的椭球率)Fig.2 Molecular structures of complexes 3b~3d(30%displacement ellipsoids)
化合物2b~2d、3b~3d、7a和7b的单晶分子结构图如图1~3所示,其晶体结构数据及重要的键长和键角数据分别列于表1、2和表3、4。所有的产物都通过叠氮配体中苯环邻位氢的C-H活化构建一个Ir-N-C-C-S金属五元环,并通过共享一个Ir-S键与原料1固有的Ir-S-C-C-S金属五元环相连接。这些化合物的C13-N1键长为0.130~0.137 nm,与文献报道的氨基-卡宾环金属化产物的C-N键长接近[21],具有C=N双键的特征。与之相一致的是,Ir1-N1-C13的键角为119°~124°,表明N1原子为sp2杂化。Ir-S的键长为0.230~0.237 nm,稍微长于1中的Ir-S的键长0.226 nm[22]。而Ir1-N1键长0.204~0.208 nm则与常见的Ir-N键长接近。这些化合物的核磁谱图较为简单,比较特征的氢谱为-NH表现出来的矮宽信号峰,除了7a因为存在分子内氢键而出现在7.96,其他化合物都出现在3.5~4.3范围内。苯环上的3个氢分别在化合物7a,7b和2b~2d表现为2组双峰和1组三重峰,而在3b~3d表现为1组单峰和2组双峰。

图3 化合物7a和7b的分子结构图(30%的椭球率)Fig.3 Molecular structures of complexes 7a and 7b(30%displacement ellipsoids)

表1 化合物2b~2d的晶体结构数据Table 1 Crystallographic data for complexes 2b~2d

表2 化合物3b~3d、7a和7b的晶体结构数据Table 2 Crystallographic data for complexes 3b~3d,7a and 7b
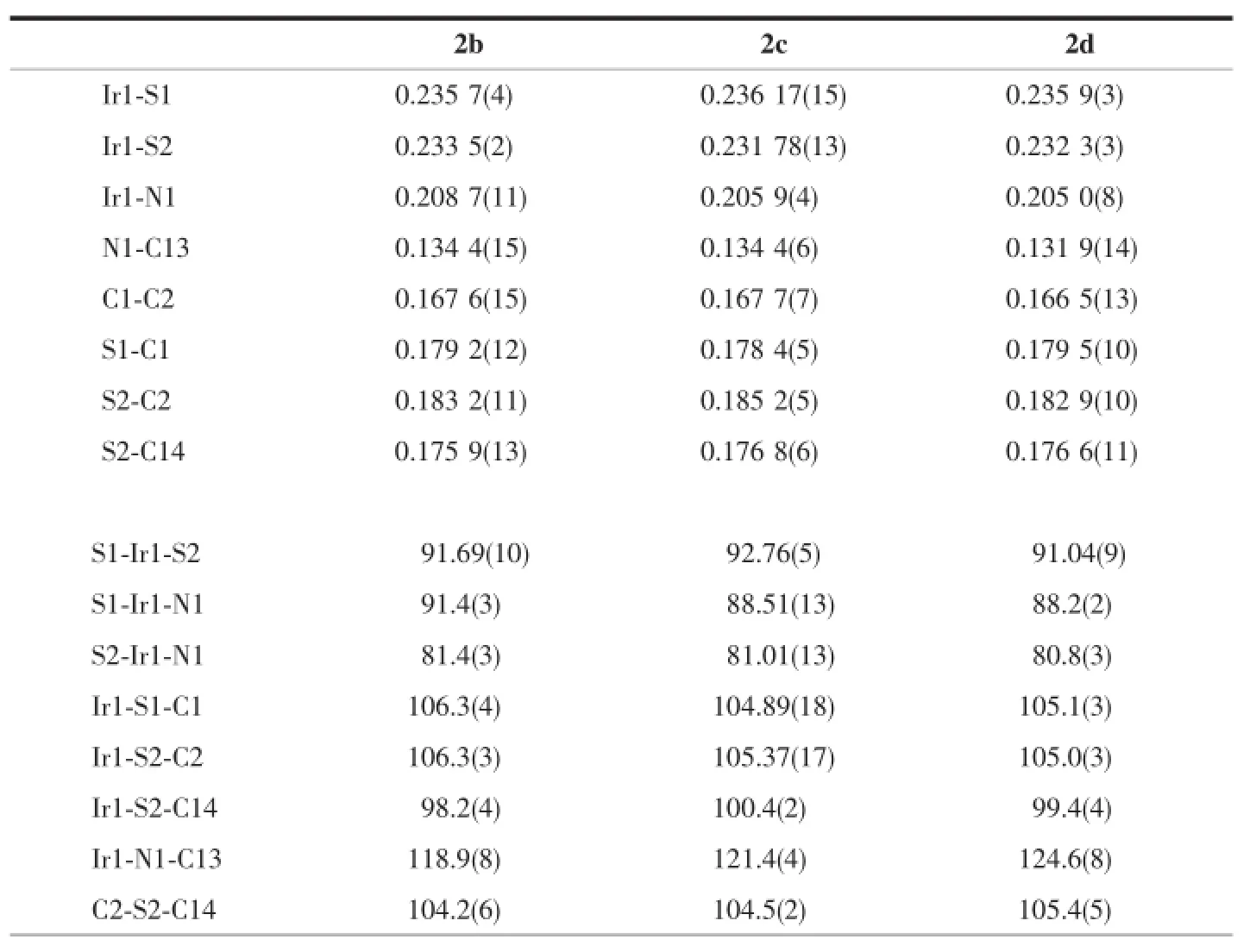
表3 化合物2b~2d的主要键长(nm)和键角(°)Table 3 Selected bond lengths(nm)and angles(°)for complexes 2b~2d

续表3

表4 化合物3b~3d、7a和7b的主要键长(nm)和键角(°)Table 4 Selected bond lengths(nm)and angles(°)for complexes 3b~3d,7a and 7b
2.3 配合物可能的形成机理
通常而言,过渡金属化合物与有机叠氮的反应一般经历2种途径来完成转化[1,23]:一种为通过偶极加成的离子反应与底物结合;另一种在一定条件下脱掉N2形成活泼的氮宾中间体,然后再进一步与底物反应完成转化,在某些情况下,该过程很容易形成自由基,最终产物经历自由基机理而形成。为确认本研究所得产物的形成经历了哪种过程,我们做了以下辅助实验进行验证。由于光照经常被用于自由基类型反应的研究,于是我们也考察了光照条件下的反应情况。实验结果表明该反应体系也能形成在加热情况下产生的产物,只是产率低了许多,并产生一些难于表征鉴定的分解产物。另外,我们之前类似体系的研究通过电子顺磁共振及质谱捕获的方法证明了反应过程中的确形成了自由基[14-15]。因此,结合实验事实,我们提出了Scheme 6所示的产物2b~2d、3b~3d、7a和7b的可能形成机理。首先,取代苯基叠氮与16e化合物1作用形成金属-亚胺基化合物I,这在多数过渡金属化合物与有机叠氮的反应体系中被认为是第一步产物。金属-亚胺基化合物I通过共振可以转化为双自由基中间体II。在此基础上,根据取代基位置的不同,经过吸氢反应和自由基转移过程[24-25],可以形成其他的双自由基中间体IIIA~IIIC,然后这些双自由基中间体发生分子内自由基偶合反应,即可生成产物22b~2d、3b~3d、7a和7b。

Scheme 6 Proposed mechanisms for the formation of complexes 2b~2d,3b~3d,7a and 7b
3 结论
本文系统地研究了半夹芯式16e化合物1与邻、间位取代苯基叠氮的反应性。研究结果表明:①与间取代苯基叠氮反应,苯环的2个邻位碳都能发生C-H活化形成C-S键的产物2b~2d和3b~3d,产物的形成不具选择性;②与邻取代苯基叠氮反应生成单一的苯环邻位碳,发生C-H活化形成C-S键的产物7a和7b;③含有吸电子基团的苯基叠氮比给电子基团的苯基叠氮表现出更强的反应活性;④结合光照反应以及前期类似体系[15]电子顺磁共振和质谱捕获实验的证据,我们提出了化合物2b~2d、3b~3d、7a和7b经过C-H活化形成C-S键的自由基机理。该研究发展了一类分子内金属参与或诱导的C-H活化而形成C-S键的方法,为一些难于通过常规方法构建的化合物提供了一种新的合成思路。
[1]Cenini S,Gallo E,Caselli A,et al.Coord.Chem.Rev.,2006, 250(11/12):1234-1253
[2]Cenini S,La Monica G.Inorg.Chim.Acta,1976,18:279-293
[3]Cai S X,Glenn D J,Gee K R,et al.Bioconjugate Chem., 1993,4(6):545-548
[4]Plate M S.Photochem.Photobiol.,1997,65(2):193-194
[5]Cai S X,Glenn D J,Keana J F W.J.Org.Chem.,1992,57(4): 1299-1304
[6]Nahar P,Wali N M,Gandhi R P.Anal.Biochem.,2001,294 (2):148-153
[7]Clecak N J,Cox R J,Moreau W M.Polym.Eng.Sci.,1974, 14(7):491-493
[8]Eikey R A,Abu-Omar M M.Coord.Chem.Rev.,2003,243 (1/2):83-124
[9]Wigley D E.Prog.Inorg.Chem.,2007,42:239-482
[10]Burrell A K,Steedman A J.Organometallics,1997,16(6): 1203-1208
[11]Eikey R A,Khan S I,Abu-Omar M M.Angew.Chem.,Int. Ed.,2002,41(19):3591-3595
[12]Mindiola D J,Hillhouse G L.Chem.Commun.,2002(17): 1840-1841
[13]Bai G,Stephan D W.Angew.Chem.,Int.Ed.,2007,46(11): 1856-1859
[14]Zhong W,Xie M S,Jiang Q B,et al.Chem.Commun.,2012, 48(15):2152-2154
[15]Zhong W,Jiang Q B,Zhang Q,et al.Dalton Trans.,2014,43(13):4962-4968
[16]Bae J Y,Park Y I,Ko J J,et al.Inorg.Chim.Acta,1999, 289(1/2):141-148
[17]Hebel D,Furlano D C,Phillips R S,et al.Bioorg.Med. Chem.Lett.,1992,2(1):41-44
[18]SMART Version 5.0,SAINT Version 6,SHELXTL Version 6.1 and SADABS Version 2.03.Bruker AXS Inc.,Madison, Wisconsin,USA,2000.
[19]Sheldrick G M.SHELXS-97,Program for Crystal Structure Solution,University of Göttingen,Germany,1997.
[20]Sheldrick G M.SHELXL-97,Program for Crystal Structure Refinement,University of Göttingen,Germany,1997.
[21]Kumaran E,Sridevi V S,Leong W K.Organometallics,2010, 29(23):6417-6421
[22]Bae J Y,Park Y I,Ko J,et al.Inorg.Chim.Acta,1999,289 (1/2):141-148
[23]Nomura M,Yagisawa T,Takayama C,et al.J.Organomet. Chem.,2000,611(1/2):376-385
[24]Hou Z M,Fujita A,Koizumi T,et al.Organometallics,1999, 18(10):1979-1985
[25]Sun K,Sachwani R,Richert K J,et al.Org.Lett.,2009,11 (16):3598-3601
Reactivity of Unsaturated 16e Half-Sandwich Complex Cp*Ir(S2C2B10H10) with ortho-and meta-Substituted Phenyl Azides
ZHONG Wei*,1,2YAN Hong*,2
(1College of Biological,Chemical Sciences and Engineering,Jiaxing University,Jiaxing,Zhejiang 314001,China)
(2State Key Laboratory of Coordination Chemistry,Nanjing University,Nanjing 210093,China)
To test the influence of the position and electronic effect of the substituted group on the reaction system,detailed studies on the reactivity of unsaturated 16e half-sandwich complex Cp*Ir(S2C2B10H10)(1)with ortho-and meta-substituted phenyl azides were performed.Reaction of 1 with ortho-and meta-substituted phenyl azides led to the formation of metal complexes in which C-H activation at ortho-position of aryl ring happened to construct a new C-S bond.These complexes were fully characterized by NMR(1H,11B,13C),FTIR,MS,elemental analysis and single crystal X-ray diffraction.Basing on the results of the same reaction system with irradiation, the radical mechanism for the formation of these complexes was proposed.CCDC:1046784,2b;1046785,2c; 1046786,2d;1046787,3b;1046788,3c;1046789,3d;1046790,7a;1046791,7b.
half-sandwich complex;substituted phenyl azide;reactivity;mechanism
O614.82+5
A
1001-4861(2015)07-1305-10
10.11862/CJIC.2015.205
2015-02-02。收修改稿日期:2015-06-02。
国家自然科学基金(No.21301071)资助项目。
*通讯联系人。E-mail:weizhong@mail.zjxu.edu.cn,hyan1965@nju.edu.cn
