盐酸异丙肾上腺素诱发大鼠心肌缺血性纤维化后肝脏损伤的拉曼光谱分析
2015-11-29黄宇欣高海成苗春生
黄宇欣,高海成,刘 凯,苗春生
(1.吉林大学理论化学研究所 理论化学计算国家重点实验室,吉林 长春 130012;2.长春工业大学基础科学学院物理教研室,吉林 长春 130012;3.吉林大学药学院临床药学教研室,吉林 长春 130021)
国内外文献[1-4]报道:皮下注射大剂量盐酸异丙肾上腺素(isoprenaline hydrochloride,Iso)会导致大鼠急性心肌缺血损伤,这种损伤与人的急性心肌缺血较为相似,可作为评价药物抗心肌缺血的动物模型。而Iso在诱发心肌缺血性纤维化的同时,能否造成其他脏器的损伤,目前国内外少有报道?如果造成其他脏器的损伤,可通过什么方法检测。近年来,拉曼光谱正逐渐出现在人们的视野。国外文献[5-8]报道:拉曼光谱在聚合物、生物分子、蛋白质和无机物等方面得到了广泛的应用。本实验利用Iso诱发大鼠心肌缺血模型,通过紫外和拉曼光谱分析Iso诱发心肌缺血性纤维化后肝脏的损伤,旨在为今后药物对各器官损伤的检测提供新的策略。
1 材料与方法
1.1 动物、主要试剂和仪器 雄性 Wistar大鼠20只,合格证号:SCXK(吉)2008-0005,体质量180~220g,由吉林大学实验动物中心提供。Iso注射液由上海禾丰制药有限公司生产。MD-100自动生化分析仪(美国),徕卡4215切片机(德国),Olympus PM-10AO全自动显微照相装置(日本Olympus公司)。
1.2 实验动物分组及建模 实验分为对照组及Iso组(包括4h、24h及1周组)。除对照组使用生理盐水刺激外,其余各组一次性皮下多点皮下注射Iso 15mg·kg-1。通过HE染色评价模型。
1.3 肝脏和心脏组织的HE染色 分别在注射Iso后4h、24h和1周时剖腹取大鼠心脏,经10%甲醛固定30min,常规石蜡包埋。用二甲苯脱腊10min,用100%乙醇置换二甲苯2min、95%乙醇置换1min、80%乙醇置换1min及用75%乙醇置换1min,蒸馏水冲洗2min。苏木素染色5min,自来水冲洗。盐酸乙醇分化30s。自来水浸泡15min。伊红染2min。常规脱水,透明,封片,拍照。
1.4 紫外吸收光谱 心脏和肝脏组织经蛋白提取液匀浆后,通过UV-2450光谱在200~1000nm处检测匀浆液的吸收,由此分析心脏和肝脏蛋白吸收谱(nm)。
1.5 拉曼光谱 肝脏组织经蛋白提取液匀浆后,通过拉曼光谱在1400~1700cm-1处检测匀浆液的吸收,由此分析肝脏蛋白吸收谱(cm-1)的变化。
2 结 果
2.1 各组大鼠心肌细胞病理学 对照组大鼠心肌排列整齐,横纹清晰,胞核明显,无细胞肿胀。Iso-24h组大鼠心肌出现较多的坏死,局限于心内膜下。Iso-1周组大鼠心肌出现界限清晰、多发散在坏死灶,坏死灶内有旺盛的成纤维细胞增生,并可见一定量的胶原纤维[9]。见图1(插页七)。
2.2 紫外检测心脏组织成分 对照组出现3个明显的吸收峰,波长分别是0.891、0.799和0.433,其吸收峰值分别是539、576和972nm。Iso-24h组峰位移动,吸收峰值向左或向右移动1个单位。Iso-1周组由1个峰位趋于正常。见图2。
2.3 紫外检测肝脏组织成分 对照组大鼠肝脏组织标本在968nm检测时发现有较明显的吸收峰,其吸收值是0.615;Iso-4h组吸收峰位未改变;Iso-24h组峰位是966nm,与对照组比较,移动了2个单位。Iso-1周组吸收峰位逐渐趋于平稳。见图3。
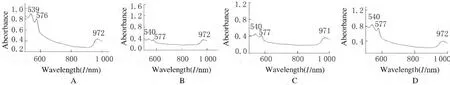
图2 各组大鼠心脏组织的紫外吸收光谱结果Fig.2 Results of UV absorption spectrometry in heart tissue of rats in various groups

图3 各组大鼠肝组织紫外光谱结果Fig.3 Results of UV absorption spectrometry in liver tissue of rats in various groups
2.4 拉曼光谱法检测肝组织成分 对照组大鼠肝脏组织在1589nm处可见明显的吸收峰。Iso-24h组在1590nm处见明显的吸收峰;Iso-1周组未检测到相同的峰位。见图4。

图4 各组大鼠肝脏组织拉曼光谱结果Fig.4 Results of Raman spectra in liver tissue of rats in various groups
2.5 各组大鼠肝组织病理学 肝组织病理学观察可见:对照组大鼠肝小叶界限清晰,无坏死灶;Iso各组大鼠肝小叶内有灶性坏死区,肝细胞出现水样变性;随着Iso注射时间的延长,肝脏病变程度加重。见图5(插页七)。
3 讨 论
肝脏是人体最大的内脏器官,质量为1.0~1.5kg[10]。肝脏由专门的细胞组成(如肝细胞、枯氏细胞和肝星状细胞),各类细胞在肝脏中均有重要的作用[11-12]。人体中最重要的代谢是蛋白质、碳水化合物和脂肪代谢,胆汁分泌、胆红素的排泄、矿物质(铁)和糖原、细菌和抗原等均在肝脏代谢中起作用[13-14]。心肌缺血是一种非常普通的心血管疾病。当发生缺血时,是否同时会造成肝脏的损伤已引起关注。
拉曼光谱技术是一种非破坏性的指纹成像技术。现已在材料、化工、生物医学和环保等领域有着广泛的应用。而根据拉曼光谱技术所发展起来的表面增强拉曼光谱技术(surface-enhanced Raman spectra,SERS)也在溶剂检测中得到了普遍的应用[9]。拉曼光谱可在不损伤细胞的条件下实时动态地监测细胞分子结构变化,亦可获得细胞的 “分子指纹”,具有敏感性高、实时检测、活样品不需固定或染色和不损伤细胞等众多特点。近年来,国内外研究者将拉曼光谱应用于细胞药物处理、细胞水平疾病诊断、单细胞生命活动监测、亚细胞结构等研究,取得了不同程度的进展。随着研究的深入,拉曼光谱分析技术必将在细胞、癌症研究、细胞分选和药物筛选等领域广泛应用[8]。在本实验中,HE染色结果显示:Iso在给药后4和24h诱发了大鼠心肌缺血,且24h时出现较多的点状坏死,在1周时出现纤维组织增生和纤维化;而紫外光谱分析显示:心肌蛋白谱右移1个单位,这些结果说明Iso诱发了大鼠心肌的损伤;而Iso诱发心肌缺血性纤维化的同时,紫外光谱分析显示肝脏蛋白谱右移1个单位;HE染色结果则显示肝脏组织中细胞堆积,成分增多;拉曼光谱分析显示:肝脏组织蛋白谱在4h~1周内右移3~6个单位,这些结果说明Iso诱发心肌损伤的同时,诱发了肝脏的损伤。
综上所述,Iso在4h、24h和1周诱发心肌损伤的同时,亦可能引发了肝脏的损伤。利用拉曼光谱检测更为敏感,紫外吸收谱也可检测到其损伤的相应特征。
[1]Rona G,Chappel CI,Balazs T,et al.An infarct like myocardiallesion and other toxic manifestations produced by isoproterenol in therat[J].Arch Pathol,1959,67(4):443-455.
[2]徐叔云.药理学实验方法 [M].2版.北京:人民卫生出版社,1991:897.
[3]朱彤莹,黄国英,顾 勇,等.两种心衰模型大鼠心功能的比较 [J].中国实验动物学报,2002,1(10):51-53.
[4]边长勇,秦永文,郑 兴,等.大鼠充血性心力衰竭模型的制备 [J].第二军医大学学报,2001,7(22):693-694.
[5]Li W,Liang J,Yang W,et al.Chiral functionalization of graphene oxide by optically active helical-substituted polyacetylene chains and its application in enantioselective crystallization [J].ACS Appl Mater Interfaces,2014,6(12):9790-9798.
[6]Gupta N,Gupta D,Aggarwal S,et al.Thermally stable plasmonic nanocermets grown on microengineered surfaces as versatile surface enhanced Raman spectroscopy sensors for multianalyte detection [J].ACS Appl Mater Interfaces,2014,6(24):22733-22742.
[7]Lewis EN,Qi W,Kidder LH,et al.Combined dynamic light scattering and Raman spectroscopy approach for characterizing the aggregation of therapeutic proteins [J].Molecules,2014,19(12):20888-20905.
[8]Szostak R,Mazurek S.Quantitative determination of acetylsalicylic acid and acetaminophen in tablets by FT-Raman spectroscopy [J].Analyst,2002,127(1):144-148.
[9]高海成,孙 波,苗春生,等.大剂量盐酸异丙肾上腺素诱发大鼠心肌缺血性坏死模型的建立 [J].中国生物制品学杂志,2009,22(3):288-296.
[10]Kasuya J,Tanishita K.Microporous membrane-based liver tissue engineering for the reconstruction of three-dimensional functional liver tissues in vitro [J].Biomatter,2012,2(4):290-295.
[11]Hartmann P,Chen WC,Schnabl B.The intestinal microbiome and the leaky gut as therapeutic targets in alcoholic liver disease [J].Front Physiol,2012,3(1-10):402.
[12]Cheng K,Benten D,Bhargava K,et al.Hepatic targeting and biodistribution of human fetal liver stem/progenitor cells and adult hepatocytes in mice [J].Hepatology,2009,50(4):1194-1203.
[13]Kochan K,Marzec KM,Chruszcz-Lipska K,et al.Pathological changes in the biochemical profile of the liver in atherosclerosis and diabetes assessed by Raman spectroscopy[J].Analyst,2013,138(14):3885-3890.
[14]David LA,Maurice CF,Carmody RN,et al.Diet rapidly and reproducibly alters the human gut microbiome [J].Nature,2014,505(7484):559-563.
[15]Pappas D,Smith BW,Winefordner JD.Raman spectroscopy in bioanalysis[J].Talanta,2000,51(1):131-44.
