正清风痛宁对偏头痛模型大鼠无菌性神经源性炎症反应的抑制作用
2015-11-29罗国标刘晓丽
罗国标,杨 丽,刘晓丽
(1.遵义医学院附属医院神经内科,贵州遵义 563099;2.贵州省黔东南州人民医院神经内科,贵州 凯里 556000;3.遵义医学院附属医院病理科,贵州 遵义 563099)
偏头痛是一种慢性反复发作性头痛,其发病机制尚未完全明了。最近几年的研究[1-2]表明:炎性细胞因子与偏头痛的疼痛有关联;三叉神经系统、神经肽和炎性介质在偏头痛的病理生理学中起关键作用。偏头痛的经典治疗药物曲马普坦类药物具有减少神经肽、蛋白及血浆渗出,减少偏头痛血管炎症反应等药理作用。正清风痛宁主要成分为盐酸青藤碱,其具有明显抗炎、抗免疫、镇痛、镇静和镇咳等药理作用,目前已广泛用于治疗类风湿性关节炎等。目前尚未见正清风痛宁用于治疗偏头痛的文献报道。本实验观察正清风痛宁对偏头痛模型大鼠脑干炎性细胞因子肿瘤坏子因子α(tumor necrosis factorα,TNF-α)和白细胞介素1β(interleukin-1β,IL-1β)表达及大鼠脑干蛛网膜下腔炎性细胞数的影响,以舒马普坦为阳性对照,了解正清风痛宁能否减少蛛网膜下腔炎性细胞数及脑干细胞因子(TNF-α和IL-1β)的表达从而抑制偏头痛的无菌性神经源性炎症(aseptic neurogenic inflammation,ANI)反应,为正清风痛宁临床用于治疗偏头痛提供实验依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器 清洁级 Wistar大鼠60只,雌雄各半,体质量(260±60)g,购于重庆第三军医大学大坪医院医学实验动物中心,许可证号:SCXK(渝)2007-0005。硝酸甘油注射液(nitroglycerin,NTG)(5g·L-1,批号:20100531)购自北京益民药业有限公司,正清风痛宁缓释片(每片含盐酸青藤碱60mg,批号:0903127)购自湖南正清制药集团股份有限公司,琥珀酸舒马普坦片(批号:0D6909T)购自天津华津制药有限公司,兔抗大鼠TNF-α抗体和兔抗大鼠IL-1β抗体购自武汉博士德生物公司。麦克奥迪BA400显微镜(麦克奥迪实业)。
1.2 实验分组、模型制作和给药 Wistar大鼠60只随机分为空白对照组、模型组、舒马普坦组(6mg·kg-1·d-1)和正清风痛宁低剂量组(100mg·kg-1·d-1)、正清风痛宁中剂量组(150mg·kg-1·d-1)、正清风痛宁高剂量组(200mg·kg-1·d-1),每组10只。采用皮下注射NTG制作大鼠偏头痛模型。Wistar大鼠称质量后按10mg·kg-1皮下注射NTG,制作实验性偏头痛模型。模型制作判定标准:模型制作后通过耳红、挠头、爬笼和烦躁不安等行为症状判定模型制作是否成功。成功的标准为模型动物精神不振,眼睛眯成线状,体温明显下降,蜷缩少动,肛门处有粪便堆积,体质量逐日下降。本实验中,除空白对照组外,其余各组动物造模后6~10min均出现双耳发红、前肢频繁搔头、摆头、爬笼次数增多和烦躁不安现象。模型组大鼠上述现象持续1~3h,继而出现蜷卧,活动减少状态。造模30min后按组分别灌服舒马普坦、各剂量正清风痛宁,模型组大鼠给予等量生理盐水灌胃。舒马普坦和各剂量正清风痛宁组大鼠在给药后上述现象逐渐消失,趋于正常。
1.3 取材和标本处理 造模4h后将大鼠用10%水合氯醛(0.30mL·100g-1)腹腔注射法进行全身麻醉后,仰卧固定,开胸从左心室至主动脉插管,剪开右心耳,首先迅速灌注无菌生理盐水200mL,然后灌注4℃4%多聚甲醛磷酸盐缓冲液200mL,灌注后断头,取出整个完整脑组织,4℃、4%多聚甲醛磷酸盐缓冲液浸泡后,去除硬脑膜、大脑,保留脑干、软脑膜和蛛网膜,在4%PFA磷酸盐缓冲液中固定24h,然后放入20%蔗糖-PBS液中,至组织块下沉。标本均经10%甲醛固定,石蜡包埋,制成4μm切片,常规HE染色。
1.4 计数蛛网膜下腔炎性细胞数 切片HE染色,奥林巴斯显微镜下观察每张切片脑干蛛网膜下腔炎的炎症反应,计数脑干蛛网膜下腔40倍视野单位面积(以视野为单位)炎性细胞数总数。全部标本的切片均由2名有经验的病理科医师观察复核。
1.5 免疫组织化学染色 常规HE染色,显微镜下观察确定组织结构未被破坏,采用免疫组织化学方法检测TNF-α和IL-1β表达情况。奥林巴斯显微镜下观察每张切片左上、右上、左下、右下和中央部5个视野40倍图片,计数每个视野TNF-α和IL-1β阳性细胞总数,取均值。全部标本的切片均由2名有经验的病理科医师观察复核。
1.6 统计学分析 采用SPSS 17.0统计软件对数据进行统计学分析。各组大鼠脑干中TNF-α和IL-1β阳性细胞数及蛛网膜下腔炎性细胞数以表示,多组间样本均数比较采用单因素方差分析。
2 结 果
2.1 各组大鼠脑干中TNF-α和IL-1β阳性细胞数显微镜下免疫组织化学染色阳性部位为细胞质染为棕黄色,细胞核用苏木精复染为蓝色。与空白对照组比较,模型组大鼠脑干中TNF-α和IL-1β阳性细胞数明显增多,差异有统计学意义(P<0.01);与模型组比较,正清风痛宁中、高剂量组和舒马普坦组大鼠脑干中TNF-α和IL-1β阳性细胞数明显减少,差异有统计学意义(P<0.05)。见表1、图1和图2(插页六)。
2.2 各组大鼠脑干蛛网膜下腔炎性反应 空白对照组大鼠蛛网膜下腔血管正常,无血管扩张及炎性细胞浸润;模型组大鼠脑干蛛网膜下腔血管明显扩张充血,炎性细胞(以淋巴细胞、单核细胞为主)浸润,炎性细胞数明显增多,与空白对照组比较,差异有统计学意义(P<0.01);正清风痛宁低、中、高剂量组及舒马普坦组炎性反应减轻,炎性细胞数(以淋巴细胞和单核细胞为主)明显减少,与模型组比较,差异有统计学意义(P<0.01)。见表2。
表1 各组大鼠脑干中TNF-α和IL-1β表达阳性细胞数Tab.1 Number of TNF-αand IL-1βexpression positive cells in brainstem of rats in various groups(n=10,)
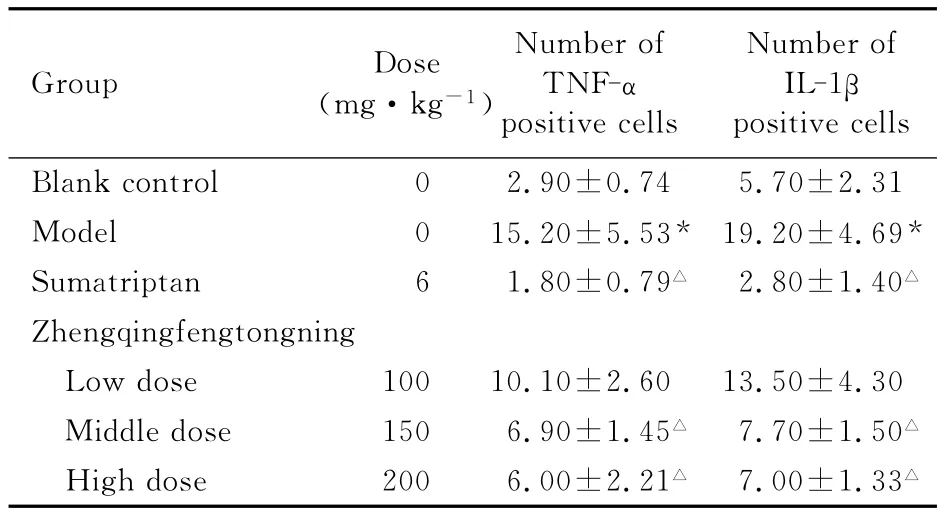
表1 各组大鼠脑干中TNF-α和IL-1β表达阳性细胞数Tab.1 Number of TNF-αand IL-1βexpression positive cells in brainstem of rats in various groups(n=10,)
*P<0.01compared with blank control group;△P<0.05 compared with model group.
0 2.90±0.745.70±2.31 Model 0 15.20±5.53*19.20±4.69*Sumatriptan 6 1.80±0.79△2.80±1.40△Zhengqingfengtongning Low dose 10010.10±2.6013.50±4.30 Middle dose 150 6.90±1.45△7.70±1.50△High dose 200 6.00±2.21△7.00±1.33 ositive cells Blank control Group Dose(mg·kg-1)Number of TNF-α positive cells Number of IL-1β p△
表2 各组大鼠脑干蛛网下腔炎细胞数Tab.2 Number of inflammatory cells in brainstem subarachnoid space of rats in various groups(n=10,)

表2 各组大鼠脑干蛛网下腔炎细胞数Tab.2 Number of inflammatory cells in brainstem subarachnoid space of rats in various groups(n=10,)
*P<0.01compared with blank control group;△P<0.01 compared with model group.
0 1.90±0.74 Model 0 28.33±2.06*Sumatriptan 6 11.00±1.05△Zhengqingfengtongning Low dose 100 9.10±1.10△Middle dose 150 5.60±0.97△High dose 200 2.60±0.84 ace Blank control Group Dose(mg·kg-1)Number of inflammatory cells of per unit area subarachnoid sp△
3 讨 论
偏头痛是一种原发性头痛,是临床常见病、多发病,其影响、困扰着全球总人口20%的人群,特别是20~50岁的女性[3],年患病率女性为3.3%~32.6%,男性为0.70%~16.1%[4]。偏头痛不但是神经科常见病,还是脑血管病的危险因素之一,与神经科许多疾病共患病,如焦虑症、抑郁症和癫痫等,但其发病机制目前尚无定论。三叉神经血管反射学说为目前的主流学说,该学说认为:三叉神经受损害、神经纤维受刺激导致脑膜ANI发生,诱发偏头痛。三叉神经系统、神经肽和炎性介质在偏头痛病理生理学中起关键作用[2]。细胞因子是重要的炎性介质之一,是炎性通路上的重要调质,与偏头痛发病机制有关联;细胞因子及其受体在中枢神经系统所有细胞类型、包括神经细胞中均表达[5]。细胞因子不仅在健康人大脑中产生,参与正常神经功能,而且在神经源性炎症中起作用,是神经源性炎症调质,诱导疼痛[6],TNF-a和IL-1能够引起强烈的痛觉过敏[5]。有报道[6]显示:在偏头痛患者偏头痛发作期,血浆TNF-α水平升高。IL-1在偏头痛患者中也被证实升高[7]。促炎性细胞因子TNF-α和IL-1β在调节疼痛中起到关键性作用,其有助于三叉神经纤维致敏[7]。在人体临床试验中TNF-α能够引起头痛,TNF-α抗体能减少疼痛。本实验通过皮下注射NTG复制偏头痛模型。注射NTG可引起大鼠硬脑膜迟发性炎症反应,调节促炎性细胞因子IL-1β和IL-6产生。本实验结果与前述的研究结果一致,TNF-α和IL-1β在模型组大鼠脑干中表达水平明显升高。此外,本文作者的前期实验[8]结果和本实验观察结果与何秋等[9]观察的结果一致:模型组大鼠蛛网膜下腔有大量淋巴细胞、单核细胞等炎性细胞浸润,空白对照组大鼠蛛网膜下腔无明显炎性反应。三叉神经血管反射学说认为:由于某种因素激活了脑膜血管周围的三叉神经末梢,释放某些神经肽,使脑膜血管舒张,产生ANI。ANI反应刺激中枢和三叉神经末梢释放化学物质或炎症介质,引起血管舒张、渗漏,造成疼痛的延长[10-12],此过程包括神经源性炎症、中枢痛觉致敏等偏头痛病理生理过程。神经源性炎症是偏头痛疼痛产生的关键环节。本实验结果证实:偏头痛模型大鼠存在ANI反应,蛛网膜下腔炎性细胞增多和中枢促炎性细胞因子表达增多。
正清风痛宁主要成分是盐酸青藤碱,是从中药青风藤中提取的单体生物碱,具有明显抗炎、抗免疫、镇痛、镇静和镇咳等药理作用。梁瑞燕等[13]通过体外实验研究表明:青藤碱对IL-1β基因表达有较强的抑制作用,并认为青藤碱可能是通过抑制炎症性细胞因子的产生而发挥其抗炎作用。另有研究[14]证实:青藤碱可通过抑制炎性细胞因子如IL-1β、IL-2、IL-8和TNF-α等的表达及合成而产生抗炎作用;青藤碱还能有效抑制巨噬细胞释放IL-1及TNF-α,从而有效抑制了新一轮炎症的启动[15]。
综上所述,青藤碱可抑制炎性细胞因子的表达和合成,从而减少炎性细胞因子所致的疼痛。曲普坦类药物是一类特异性5-HT1B/1D受体激动剂,包括舒马普坦等,是偏头痛急性发作期的主要治疗药物。曲坦类药物治疗偏头痛可能的机制:收缩已扩张的脑血管,减少神经肽、蛋白及血浆渗出,减少偏头痛的血管炎症反应,阻断疼痛在三叉神经系统传递,抑制三叉神经血管系统致敏中枢[16-19]。这些反应均是偏头痛疼痛发作的特征性特点。舒马曲坦是第1个人工合成的选择性5-HT(5-HT1B/1D)受体激动剂,其治疗偏头痛发作的作用机制:收缩特定的颅内血管,抑制激活突触前膜的5-HT受体,抑制活化的三叉神经元放神经递质和炎症介质[20-21]。本实验结果显示:NTG可引起模型组大鼠脑干中TNF-α和IL-1β表达及其蛛网膜下腔炎性反应明显增多,舒马普坦组和各剂量正清风痛宁组大鼠上述反应明显减轻,但舒马普坦组与各剂量正清风痛宁比较差异有统计学意义,各剂量正清风痛宁组大鼠蛛网膜下腔炎性细胞数比舒马普坦组减少更明显,且高剂量组与空白对照组比较无统计学差异,舒马普坦抑制脑干中TNF-α和IL-1β表达明显优于正清风痛宁组。本文作者推测:正清风痛宁有抑制实验性偏头痛模型大鼠ANI反应的作用,从而达到其在治疗偏头痛中的抗炎和镇痛作用。有研究[22-23]证实:神经源性炎症发生在人类偏头痛中,但这一直是一个有争议的领域。因此,需要更多的实验数据来进一步证实上述实验结果。
[1]Boettger MK,Weber K,Grossmann D,et al.Spinal tumor necrosis factor alpha neutralization reduces peripheral inflammation and hyperalgesia and suppresses autonomic responses in experimental arthritis:a role for spinal tumor necrosis factor alpha during induction and maintenance of peripheral inflammation [J].Arthritis Rheum,2010,62(5):1308-1318.
[2]Neeb L,Hellen P,Boehnke C,et al.IL-1βstimulates COX-2dependent PGE2synthesis and CGRP release in rat trigeminal ganglia cells [J].PLoS One,2011,6(3):e17360-e17369.
[3]Schürks M,Kurth T.Is migraine a predictor for identifying patients at risk of stroke?[J].Expert Rev Neurother,2011,11(5):615-618.
[4]中华医学会疼痛学分会头面痛学组.中国偏头痛诊断治疗指南 [J].中国疼痛医学杂志,2011,17(2):65-86.
[5]Yilmaz IA,Ozge A,Erdal ME,et al.Cytokine polymorphism in patients with migraine:some suggestive clues of migraine and inflammation [J].Pain Med,2010,11(4):492-497.
[6]Oikari LE,Stuart S,Okolicsanyi RK,et al.Investigation of lymphotoxinαgeneic variants in migraine[J].Gene,2013,512(2):527-531.
[7]Uzar E,Evliyaoglu O,Yucel Y,et al.Serum cytokine and pro-brain natriuretic peptide(BNP)levels in patients with migraine [J].Eur Rev Med Pharmacol Sci,2011,15(10):1111-1116.
[8]罗国标,刘晓丽,杨 丽.青藤碱对偏头痛模型大鼠蛛网膜下腔炎性细胞的影响 [J].中国神经精神疾病杂志,2014,40(4):198-201.
[9]何 秋,王怀良,章新华,等.5-HT1受体激动剂对偏头痛大鼠脑膜神经源炎症的影响 [J].中风与神经疾病杂志,2007,24(5):520-524.
[10]Maleki N,Becerra L,Borsook D.Migraine:maladaptive brain responses to stress [J].Headache,2012,52(suppl 2):102-106.
[11]谭 亮,樊光辉.偏头痛发病机制的研究进展 [J].中国临床神经外科杂志,2012,17(9):571-573.
[12]Ho TW,Edvinsson L,Goadsby PJ.CGRP and its receptors provide new insights into migraine pathophysiology [J].Nat Rev Neurol,2010,6(10):573-582.
[13]梁瑞燕,曹柳英,王文君,等.青藤碱抗炎作用机理研究 [J].广州中医药大学学报,2007,24(2):141-143.
[14]吴红娟,孙必强,朱传湘,等.盐酸青藤碱对家兔骨关节液IL-1β、PGE-2生成与关节组织结构的影响 [J].湖南中医药大学学报,2010,30(9):84-86.
[15]李蕴麟,粟 戟,尹小军,等.青藤碱替代激素治疗类风湿性关节炎疗效分析 [J].兰州大学学报:医学版,2013,39(3):18-21.
[16]Tfelt-Hansen P,Hougaard A.Sumatriptan:a review of its pharmacokinetics,pharmacodynamics and efficacy in the acutetreatment of migraine [J].Expert Opin Drug Metab Toxicol,2013,9(1):91-103.
[17]Mitsikostas DD,Knight YE,Lasalandra M,et al.Triptans attenuate capsaicin-induced CREB phosphorylation within the trigeminal nucleus caudalis:a mechanism to prevent central sensitization? [J].J Headache Pain,2011,12(4):411-417.
[18]Napoletano F,Lionetto L,Martelletti P.Sumatriptan in clinical practice:effectiveness in migraine and the problem of psychiatric comorbidity [J].Expert Opin Pharmacother,2014,15(3):303-305.
[19]Asadollahi S,Heidari K,Vafaee R,et al.Promethazine plus sumatriptan in the treatment of migraine:a randomized clinical trial[J].Headache,2014,54(1):94-108.
[20]De Corato A,Capuano A,Currò D,et al.Trigeminal satellite cells modulate neuronal responses to triptans:relevance for migraine therapy [J].Neuron Glia Biol,2012,7(2-4):109-116.
[21]Vause CV,Durham PL.Identification of cytokines and signaling proteins differentially regulated by sumatriptan/naproxen [J].Headache,2012,52(1):80-89.
[22]Goadsby PJ,Lipton RB,Ferrari MD.Migraine-current understanding and treatment [J].N Engl J Med,2002,346(4):257-270.
[23]Landy SH,Lobo BL.Migraine treatment throughout the lifecycle[J].Expert Rev Neurother,2005,5(3):343-353.
