贝母瓜蒌散对慢性阻塞性肺疾病大鼠肺组织中血管紧张素Ⅱ表达水平的影响
2015-11-29吴忠练黄学宽张超男
吴忠练,黄学宽,骆 言,张超男,蒋 娟
(重庆医科大学中医药学院中医经典教学研究室,重庆 401331)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)患病率和死亡率呈增长趋势,这严重影响了患者的生活质量和劳动力,目前缺乏有效的治疗方法[1]。关于COPD的发生,公认的有3个发病机制:①气道和肺部炎症;②蛋白酶-抗蛋白酶失衡;③氧化-抗氧化失衡。COPD患者大多存在不同程度的肺实质细胞破坏和炎症细胞浸润,导致气道和肺部血管结构的重构。气道重构是指气道壁增厚变形,其中平滑肌增厚显著,导致气道管腔狭窄和气流阻力增加的过程。病程进展导致缺氧和二氧化碳潴留,发展为肺动脉高压和肺心病。
国内外研究[2-3]表明:血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)不仅可诱发强烈气道平滑肌的收缩,还能通过促进细胞分泌单核细胞趋化蛋白和细胞间黏附分子,引起剧烈的炎症反应,其是参与慢性气道炎症形成和重塑的主要炎性介质之一。COPD患者长期慢性缺氧,肺血管内皮细胞损伤,代偿刺激血管平滑肌合成血管紧张素转化酶,进而催化血管紧张素Ⅰ(angiotensinⅠ,AngⅠ)转化成AngⅡ[2-4]。AngⅡ有强烈的缩血管作用,随着血管阻力进一步增加,COPD患者原本的气道狭窄加重,形成恶性循环。研究[5-6]提示:AngⅡ的表达可以通过缩血管作用,导致气道重构从而引起肺纤维化。临床采用中药方剂贝母瓜蒌散治疗COPD[7]很常见,但其机制并不清楚。研究[8-9]表明:浙贝母碱在低浓度下对支气管平滑肌有明显扩张作用,并能镇静和抗炎。瓜蒌有扩张微血管等作用[8-9]。本研究观察贝母瓜蒌散对COPD大鼠肺组织中AngⅡ表达的影响,初步探讨贝母瓜蒌散对肺组织的保护作用及机制。
1 材料与方法
1.1 实验动物 30只清洁级雄性SD大鼠(85~110d龄),体质量(200±20)g,由重庆医科大学实验动物中心提供,动物合格证号:SCXK渝20020001。
1.2 药品和试剂 贝母瓜蒌散由川贝母、瓜蒌、花粉、茯苓、橘红、白术和甘草等中药组成,原药购自重庆西部医药商城,经重庆医科大学中医药学院鉴定,按常规方法自制煎剂(即冷水浸30min,煮沸后煎30min,共煎3次,合并药液,浓缩为1.0g生药·mL-1),脂多糖(LPS)(美国Sigma公司,批号:20120501),宏声牌香烟(川渝中烟,焦油量11mg/支,烟气一氧化碳量12mg/支,烟气烟碱量10mg/支),AngⅡ抗体(武汉博士德生物有限公司,批号:Y-B2-07D27C)等。
1.3 仪器 切片机(LEZCARM2135),电热恒温水温箱(WSZ-261-79HW1,上海医用恒温设备厂),BMJ-Ⅲ型包埋机和Dy89-1型电子玻璃匀浆机(宁波新芝科器研究所),Biofuge fresco低温离心机(德国Herraces公司),BH-2型光学显微镜,显微摄像仪(日本 Olympus公司),Image-Pro Plus多功能真彩色细胞图象分析管理系统(美国Media Cybernetics公司),GDS8000凝胶成像分析系统(英国UVP公司),体描箱(北京贝兰博公司)。
1.4 动物分组和模型建立 30只大鼠随机分成正常组、模型组和贝母瓜蒌散组,每组10只。动物造模:取SD大鼠适应性饲养1周后,除正常组外,参照宋一平等[10]的方法,将大鼠分别于第1和15天气道内注入生理盐水溶解的LPS(200g·100L-1);第2~14天、第16~31天将大鼠置于密闭玻璃染毒箱中,将香烟插在50mL注射器针头上点燃后连续抽吸将烟雾注入箱内达到约5%浓度(每次约打入3600mL烟雾),使大鼠被动吸烟,持续30min后将大鼠移出箱子,每天2次,间隔4h以上。其余时间正常喂养。实验方法:造模期间,注意观察造模大鼠的精神状态、活动情况;造模成功后,自第8天起,正常组、模型组大鼠给予生理盐水灌胃(20mL·kg-1),贝母瓜蒌散组大鼠给予自制贝母瓜蒌散灌胃(20mL·kg-1),每天1次,连续22d。
1.5 肺功能测定实验 结束后的第31天,用10%水合氯醛(0.3mL·100g-1)对大鼠进行腹腔内注射麻醉后,行气管切开置人气管导管,将大鼠放入体描箱内,外接小动物肺功能检测分析系统(北京航天新概念软件公司),记录大鼠8个自主呼吸周期,获得气道压力(P),容积变化(V),相应计算得到呼吸相气道阻力(Re)、吸气相气道阻力(Ri);快速向大鼠气道内注入6mL空气造成大鼠被动深呼吸,即刻测定用力肺活量(FVC)、0.3s呼气容积(FEV 0.3)及0.3s用力呼气容积/用力肺活量(FEV 0.3/FVC)等指标。
1.6 实验标本获取和处理 末次实验后24h,用10%水合氯醛(0.3mL·100g-1)麻醉放血处死大鼠,将气管与双肺暴露,取右下肺,放入4%多聚甲醛中固定。石蜡包埋,切片5μm。AngⅡ免疫组织化学染色步骤按照SP试剂盒操作。各大鼠的免疫组织化学标本随机选10个视野,光镜下400倍观察。多功能彩色图像分析系统对AngⅡ的蛋白表达进行分析。胞浆棕褐色表示阳性反应,阳性细胞面积反映表达强度。
另将解剖取出的大鼠肺组织用生理盐水洗净其表面残血,滤纸吸干后,精密称取肺组织0.1g,研磨后加入预冷的蛋白裂解液0.5mL充分裂解。4℃、3000r·min-1离心10min后取上清液。测定蛋白质水平,取100μg蛋白加入上样缓冲液,煮沸3min后进行12%SDS-聚丙烯酰胺凝胶电泳。转PVDF膜,TTBS封闭液37℃封闭2h,滴加兔抗鼠AngⅡ单克隆抗体,4℃过夜,加入1∶2500稀释的辣根过氧化物酶标记的羊抗兔IgG二抗,37℃、2h,DAB显色。用抗体剥脱液剥脱抗体后,按同样方法与β-actin抗体(1∶300)孵育。以β-actin蛋白条带作为内参,用图像分析仪测定灰度值,计算目的蛋白相对表达水平。蛋白相对表达水平=目的蛋白条带灰度值/内参β-actin条带灰度值。
1.7 统计学分析 采用SPSS 18.0统计分析软件进行统计学处理。各组大鼠Re、FEV0.3、FEV0.3/FVC和AngⅡ表达水平以表示,各组之间比较采用单因素方差分析。
2 结 果
2.1 各组大鼠一般情况观察 实验过程中,与正常组比较,模型组和贝母瓜蒌散组大鼠表现出气急、喘咳、精神萎靡和吐痰流涎、毛发牙齿发黄等特征。而烟熏过程中尤为明显,有的甚至出现呼吸困难,抬头张口呼吸。解剖大鼠发现:模型组和贝母瓜蒌组大鼠肺组织颜色灰白晦暗,呈膨胀状态,模型组尤为明显,正常大鼠肺组织颜色偏白。见图1(插页五)。
2.2 各组大鼠肺功能 与正常组比较,模型组大鼠Re明显增加,FEV0.3和FEV0.3/FVC明显降低;与模型组比较,贝母瓜蒌散组大鼠Re明显降低,FEV0.3和FEV0.3/FVC明显升高。见表1。
表1 各组大鼠肺 Re、FEV0.3和FEV0.3/FVCTab.1 Re,FEV0.3,and FEV0.3/FVC of rats in various groups (n=10,)

表1 各组大鼠肺 Re、FEV0.3和FEV0.3/FVCTab.1 Re,FEV0.3,and FEV0.3/FVC of rats in various groups (n=10,)
*P<0.05 vs control group;△P<0.05 vs model group.
Group Re(cmH2O·mL-1·s-1)FEV0.3(V/mL)FEV0.3/FVC(η/%)Control 3.46±0.31 7.02±0.51 87.16±4.40 Model 3.85±0.46* 6.48±0.51*80.46±7.85*BeiMuGuaLou powder 3.40±0.34△ 6.99±0.63△85.79±3.87△
2.3 各组大鼠肺组织中AngⅡ的表达水平 与正常组比较,模型组和和贝母瓜蒌散组大鼠肺组织中AngⅡ表达水平明显增加,积分吸光度(IA)和阳性面积明显升高,差异具有统计学意义(P<0.05);与模型组比较,贝母瓜蒌散组大鼠肺组织中AngⅡ表达水平明显降低,其主要表达在吸收上皮细胞的细胞膜、细胞浆和细胞核,着色均呈均匀的褐色,阳性面积明显降低(P<0.05),IA值明显降低(P<0.05)。见表2和图2(插页六)。
表2 各组大鼠肺组织中AngⅡ表达水平Tab.2 Expression levels of AngⅡin lung tissue of rats in various groups (n=10,)

表2 各组大鼠肺组织中AngⅡ表达水平Tab.2 Expression levels of AngⅡin lung tissue of rats in various groups (n=10,)
*P<0.05 vs control group;△P<0.05 vs model group.
Group IA Positive area(S/μm2Control 96.96±16.98 55.72±14.68 Model 141.69±23.77* 88.34±9.53*BeiMuGuaLou powder 119.71±27.29△ 72.56±19.57)△
2.4 各组大鼠肺组织中AngⅡ蛋白表达水平 模型组大鼠肺组织中AngⅡ蛋白表达水平(0.60±0.09)明显高于正常组(0.45±0.17)(P<0.05),贝母瓜蒌散组大鼠肺组织中AngⅡ蛋白表达水平(0.48±0.12)明显低于模型组(P<0.05)。见图3。
3 讨 论
目前研究[11-13]认为符合临床实际的理想COPD动物模型应具备的标准是:①致伤因素与临床COPD常见诱因基本一致;②必须有气流阻塞存在,小气道阻力增加、肺动态顺应性下降;③气道重塑(建);④可伴有气道高反应性。根据以上理想COPD动物模型,目前经典造模方法可用熏香烟加气管内注入LPS法建立COPD大鼠模型,造模完成后,模型大鼠出现明显喘息、卧底弓背等形态学表现,呼吸功能检测及气道炎症反应证明造模成功。
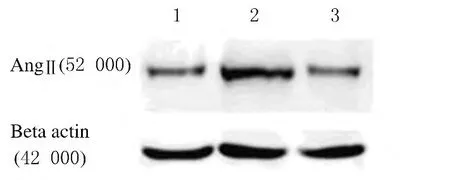
图3 各组大鼠肺组织中AngⅡ蛋白表达电泳图Fig.3 Electrophoregram of expressions of AngⅡprotein in lung tissue of rats in various groups
COPD是进行性气流受限为特征的慢性病,涉及肺脏吸入有害气体和颗粒的异常反应。本实验设计通过单纯被动吸烟法制备COPD大鼠模型,病理形态学检查符合典型COPD表现,模型复制成功。目前有关COPD和AngⅡ与肺动脉高压的研究[14]较多,本实验中模型大鼠长期慢性缺氧,肺血管内皮细胞损伤,代偿刺激血管平滑肌合成血管紧张素转化酶,进而催化AngⅠ转化成AngⅡ[15]。AngⅡ有强烈的缩血管作用[16],随着血管阻力进一步增加,COPD患者气道狭窄加重,影响呼吸功能,形成恶性循环[17],而目前尚无有效治疗方法[18-21]。本实验旨在研究贝母瓜蒌散是否可以通过抑制AngⅡ的表达而抑制血管收缩,从而减轻肺部炎症反应。
《灵枢胀论》:“肺胀者,虚满而喘咳”,根据COPD患者临床表现,即咳喘、咯痰和胸闷气促等症状,归类于中医 “喘证”、“咳嗽”、“肺胀”等。肺胀多因肺脏受内外邪侵袭,日久则肺虚清肃无权,痰浊潴留,肺不敛降,气还肺间,肺气胀满,复感外邪诱使病情发作或加剧。病久及心,出现喘脱等危候[22]。COPD的病机属于本虚合并标实[23]。贝母瓜蒌散润肺清热,理气化痰,临床上常用于治疗慢性支气管炎和肺气肿等疾病[24]。贝母瓜蒌散中贝母苦寒,润肺清热,化痰止咳;瓜蒌甘寒微苦,清肺润燥,开结涤痰,与贝母相须为用,是为润肺清热化痰的常用组合,共为君药。花粉清热涤痰而润燥为臣;茯苓、橘红健脾理气以祛痰为佐;桔梗载诸药入肺,宣肺利气为使。共奏清热润燥,理气化痰之功,使肺阴得润而燥痰可除,清肃有权则咳逆可止。现代运用于肺炎、肺结核等疾病[25]。因此观察贝母瓜蒌散对肺组织中AngⅡ表达的影响,可反映贝母瓜蒌散对肺组织炎性反应的影响。
本实验结果显示:对模型大鼠予以贝母瓜蒌散灌胃,大鼠咳喘、气急等表现明显好转。并测得大鼠AngⅡ的表达在贝母瓜蒌散组中明显低于未受到干预的模型组。因此推测,贝母瓜蒌散有通过扩张支气管平滑肌、扩张微血管的作用,而其机制可能与降低AngⅡ的表达有关联。本实验证明贝母瓜蒌散对肺功能有改善作用,为临床上用药提供了理论指导和依据。
[1]Karakurt P,Unsal A.Fatigue,anxiety and depression levels,activities of daily living of patients with chronic obstructive pulmonary disease [J].Int J Nurs Pract,2013,19(2):221-231.
[2]顾海彤,张沪生,杨 凌.血管紧张素转换酶基因多态性与慢性阻塞性肺病易感性的关系 [J].基础医学与临床,2003,23(2):174-177.
[3]Simsek S,Tekes S,Oral D,et al.The insertion/deletion polymorphism in the ACE gene and chronic obstructive pulmonary disease [J].Genet Mol Res,2013,12(2):1392-1398.
[4]Uhal BD,Li X,Xue A,et al.Regulation of alveolar epithelial cell survival by the ACE-2/angiotensin 1-7/Mas axis [J].Am J Physiol Lung Cell Mol Physiol,2011,301(3):L269-L274.
[5]Budinger GR.AngiotensinⅡand plumonaryfibrosis,a new twist on an old story [J].Am J Physiol Lung Cell Mol Physiol,2011,301(3):267-268.
[6]钱嫣蓉,万欢英.血管紧张素转换酶-2在肺部疾病中的研究进展 [J].国际呼吸杂志,2012,32(3):228-232.
[7]张红茹,蒙樱宗,张红意.中医药治疗慢性阻塞性肺疾病的研究进展 [J].药物评价研究,2012,35(4):315-318.
[8]黄兆胜.中药学 [M].北京:人民卫生出版社,2002:343-344.
[9]程世和.慢性阻塞性肺疾病的中医药治疗概况 [J].中国中医急症,2007,16(10):1255-1256.
[10]宋一平,崔德健,茅培英,等.慢性阻塞性肺疾病大鼠模型的建立及药物干预的影响 [J].中华内科杂志,2000,39(8):556-557.
[11]刘建明,廖前德,唐文祥,等.TNF-α对慢性阻塞性肺疾病模型鼠营养状态和呼吸肌蛋白质分解代谢的影响 [J].南方医科大学学报,2012:32(4):548-552.
[12]刘雪梅,杨 岚.聚合酶链式反应方法筛查慢性阻塞性肺疾病常见致病菌 [J].西安交通大学学报:医学版,2013,34(1):68-72.
[13]吴水淼,王妨娥,凌 敏,等.TNF-α基因多态性与新疆哈萨克族慢性阻塞性肺疾病易感性的关系 [J].西安交通大学学报:医学版,2014,35(6):820-823.
[14]Kaparianos A,Argyropoulou E.Local renin-angiotensinⅡsystems,angiotensin-converting enzyme and its homologue ACE2:their potential role in the pathogenesis of chronic obstructive pulmonary diseases,pulmonary hypertension and acute respiratory distress syndrome [J].Curr Med Chem,2011,18(23):3506-3515.
[15]梁先敏,杨克敌.Caspase和JNKPSAPK、p38MAPK与细胞凋亡 [J].国外医学:卫生学分册,2008,35(1):5-10.
[16]Nautiyal M,Arnold AC,Chappell MC,et al.The brain renin-angiotensin system and mitochondrial function:influence on blood pressure and baroreflex in transgenic rat strains [J].Int J Hypertens,2013,2013:1-8.
[17]张 奇,白晓东,付 小兵.p38MAPK 信号通路研究进展 [J].感染·炎症·修复,2005,6(2):121-123.
[18]张频捷,朱立新,耿小平.p38MAPK信号传导通路及其抑制剂的研究现状 [J].安徽医药,2010,14(5):596-598.
[19]CpG ODN通过活化p38MAPK上调A549细胞β防御素-2的表达 [J].广东药学院学报,2010,262:185-188.
[20]冯青青,夏熙郑.慢性阻塞性肺疾病患者肺组织中Bach1和Y-GCS的表达[J].郑州大学学报:医学版,2013,48(4):474-477.
[21]王富霞,夏熙郑,刘待见.慢性阻塞性肺疾病模型大鼠骨骼肌组织中Caspase-12和m-Calpain的表达 [J].郑州大学学报:医学版,2014,49(4):508-512.
[22]陈湘君.中医内科学 [M].上海:上海科学技术出版社,2004:63-70.
[23]朱晓龙.中药 “穴位贴敷”治疗慢性阻塞性肺疾病肺肾气虚型患者临床 [D].贵阳:贵阳中医学院,2011.
[24]曹文团,刘素香.贝母瓜蒌散加味治疗慢性支气管炎急性期35例疗效观察 [J].现代中医药,2003,6:16-17.
[25]邓中甲.方剂学 [M].北京:中国中医药出版社,2003:329-330.
