玉米弯孢叶斑病菌Clg2基因克隆、序列特征和不同发育阶段表达分析
2015-11-28侯巨梅王玉莹左豫虎赵丰舟王星茗
侯巨梅, 王玉莹, 左豫虎, 赵丰舟, 王星茗, 刘 铜
(黑龙江八一农垦大学农学院植物病理与应用微生物研究所, 大庆 163319)
玉米弯孢叶斑病菌Clg2基因克隆、序列特征和不同发育阶段表达分析
侯巨梅, 王玉莹, 左豫虎, 赵丰舟, 王星茗, 刘 铜*
(黑龙江八一农垦大学农学院植物病理与应用微生物研究所, 大庆 163319)
异源三聚体G信号通路在调控植物病原真菌的形态、侵染结构形成和致病力等方面具有重要作用。本研究根据玉米弯孢叶斑病菌新月弯孢全长cDNA文库中的EST序列,克隆获得一个含1 074 bp开放读码框(ORF)Gα基因。该基因包含5个外显子和4个内含子, 编码357个氨基酸,被命名为Clg2。通过序列比对和进化树分析,证明Clg2蛋白具有Gα蛋白结构特征和保守序列区,与小麦黄斑叶枯病菌(Pyrenophoratritici-repentisPt-1C-BFP)和大斑刚毛座腔菌(Setosphaeriaturcica)中的Gα蛋白相似性高达96%和97%,处于同一分支。采用实时荧光定量PCR技术分析了Clg2基因在病菌不同发育阶段的表达水平,显示在菌丝中表达水平最低,在分生孢子中表达量最高,暗示Clg2基因在病菌分生孢子形成期起重要作用。上述结果将为开展Clg2蛋白功能研究奠定基础。
G蛋白; 玉米弯孢叶斑病菌; Gα; 荧光定量PCR
由新月弯孢[Curvularialunata(Wakker) Boedijn]引起的玉米弯孢叶斑病是我国玉米上普遍发生的一种重要叶部病害,给玉米生产带来严重影响,有时甚至超过玉米大斑病和瘤黑粉病引起的损失[1-3]。近年来随着针对该病原菌的具有热带和亚热带血缘的抗性品种的选育和推广应用,该病害的危害程度明显降低,然而人们研究发现该病原菌致病性变异和生理分化现象非常明显[4-5],表明该病害有潜在大发生的风险,因此深入研究该菌的致病机理具有重要意义。但目前对该病菌的致病机理研究仅局限于致病因子鉴定和调控机理研究[6-7],由G蛋白介导的信号通路对该病菌的致病调控作用尚未见报道。
异源三聚体G蛋白是一类在真核生物中高度保守的蛋白,由α、β和γ3个亚基构成,各亚基由独立的基因编码[8-9]。α亚基分子种类最为多样,分子量在39~46 kD之间,具有一个GDP结合位点。β亚基分子量为36 kD左右,各种G蛋白的β亚基氨基酸序列很相似。γ亚基分子量在7~8 kD之间,各种G蛋白的γ亚基也比较相似但个别的也有差别[10]。当处于静息状态时,Gα上结合着GDP,并与α、β和γ构成稳定的三聚体形式。当与G蛋白偶联的胞膜表面受体结合配体后,活化的受体催化Gα与GDP发生解离,并于同一位置结合GTP,引起Gα构象发生变化,并从三聚体中分离出来,而Gβγ二聚体则可以分别对其相应的下游胞内效应器进行调节。由于Gα亚基上有GDP/GTP结合位点、受体结合位点、GTPase活性位点等功能位点,通常被认为是G蛋白的功能亚基[11]。研究发现Gα亚基在植物病原真菌中发挥重要的生物学功能[12]。然而迄今为止, 在玉米弯孢叶斑病菌还未见Gα蛋白报道,因此本研究拟分离与克隆该基因,对其氨基酸序列和不同发育时期的表达特征进行分析。研究结果将有助于Gα蛋白的功能解析,为开展由G蛋白介导的信号通路对致病调控机理研究奠定基础,也可为防治该病害开发新型药剂提供有效的靶位点,有望获得一种特异、高效的玉米弯孢叶斑病防治的新途径。
1 材料与方法
1.1 供试菌株和试剂
供试菌株玉米弯孢叶斑病菌(C.lunata)从典型的玉米弯孢叶斑病病株上分离获得,保存于黑龙江八一农垦大学植物病理与应用微生物研究所。大肠杆菌DH5α由本实验室保存。HiFi 聚合酶、T4 连接酶均购自北京经科宏达公司。质粒小量制备试剂盒、回收试剂盒、引物合成和序列测序都是由上海捷瑞生物工程技术有限公司提供。Trizol和反转录酶购自Introgen公司。
1.2 基因组DNA和RNA提取
将供试菌株置于马铃薯葡萄糖液体培养基中培养3 d后,用蒸馏水冲洗,吸水纸吸干收集菌丝, 置于-80 ℃冷冻过夜,通过冷冻干燥除去水分获得干燥菌丝,用液氮研磨后采用CTAB法提取DNA、Trizol法提取RNA。
1.3 第一链cDNA合成和引物设计
以总RNA为模板,利用Oligo(dT)18引物逆转录合成第一链cDNA。根据从全长cDNA文库中获得的一条EST序列扩增Clg2基因的引物,将该序列提交NCBI采用BLASTX分析设计1对特异引物CNB1: ATGTGCTTTGGACGGAAACCCTCCA;CNB2: TCATAGTATCAAAGCGTTGAGGTTT用于克隆基因的读码框。
1.4 基因克隆
分别以第一链cDNA 和基因组为模板,CNB1/ CNB2 为引物对,用HiFi 聚合酶进行PCR 扩增。反应条件为:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,35 个循环;72 ℃延伸5 min。PCR 产物用1.0%(W/V)的琼脂糖凝胶电泳检测,分别回收目的片段并连接到pMD19-T 载体上,转化E.coliDH5α 感受态细胞,随机筛选白色菌落,利用M13引物对阳性克隆测序。
1.5 序列分析和系统进化树构建
利用Pfam27.0 (http:∥pfam.xfam.org/search) 和NCBI CDD (http:∥www.ncbi.nlm.nih.gov/structure/cdd/wrpsb.cgi)在线软件对Clg2蛋白的功能结构域进行预测。采用Clustal W2 程序(http:∥www.ebi.ac.uk/Tools/msa/clustalw2/)对Clg2氨基酸序列和其他Gα蛋白序列进行比对,并输出到 GENEDOC软件, 分析其保守结构域。利用 ProtScale Tool 程序(http:∥cn.expasy.org/tools/protscale.html)采用 Kyte 和Doolittle 的方法[13]对编码氨基酸序列进行了疏水性/亲水性分析,利用 http:∥npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html 网站中Combet 等[14]的方法进行Clg2全序列的二级结构预测。应用http:∥web.expasy.org/compute_pi/ 进行分子量和等电点等预测。使用MEGA5 (http:∥megasoftware.net)软件的邻近比较法构建Clg2系统发育进化树。
1.6 荧光定量PCR
分别收集在PDA平板培养基上生长7 d的分生孢子、在铺有玻璃纸的PDA平板上萌发3、6 h和9 h分生孢子和在液体培养基中培养3 d的菌丝。采用Trizol方法提取5个时期材料的总RNA,反转录成cDNA。根据Clg2 cDNA序列采用Primer 5.0软件设计引物Clg2ds 5′-GTTGTGCTATTCCTCGTCG-3′和Clg2da 5′-TGGTGTCTGTGGCATTTGT-3′进行扩增,以GAPDH为内参基因。PCR反应体系为:10×buffer 2.5 μL,MgCl22.5 μL,2 mmol/L dNTPs 2.5 μL,Taq酶 0.4 μL,50×SYBR Green 0.3 μL,模板cDNA 1 μL,引物各1 μL,用ddH2O补至25 μL。反应程序为:95 ℃ 1 min;95 ℃ 20 s,60 ℃ 30 s,72 ℃ 40 s,40个循环;72 ℃ 10 min。程序结束后导出生成的循环数值。试验重复3次,以分生孢子时期表达量为参照,相对表达量通过2-ΔΔCt的方法进行计算。
2 结果
2.1 基因克隆与结构
以第一链cDNA为模板,用CNB1/ CNB2 为引物扩增出一条1 074 bp片段(图1),与预期片段大小一致。经过测序和生物信息学分析,这段序列即为Clg2基因的开放读码框,基因登录号为KJ130018。以基因组为模板,采用相同引物进行扩增时获得一条特异DNA条带,测序分析为1 353 bp(图1)。通过ClustalX 1.8 软件对所获的DNA和cDNA 序列比较分析发现:该基因含有5个外显子和4个内含子,其内含子的大小分别为110、61、56和52 bp,编码357个氨基酸。

图1 Clg2 基因PCR扩增检测结果Fig.1 Electrophoresis of Clg2 gene by PCR amplification
2.2 序列特征分析
利用Pfam 27.0和NCBI CDD在线软件对Clg2结构域进行分析,发现该蛋白质与其他来源的G蛋白α亚基蛋白具有GTP/GDP 结合活性位点、ADP-核糖基化位点、质膜受体识别与结合位点、胞内效应器结合位点等相同的位点,表明该蛋白可能属于G蛋白α亚基蛋白成员。为了进一步明确其氨基酸特征序列,从NCBI 数据库下载了一些植物病原真菌的G蛋白α亚基的氨基酸序列,通过DNAMAN对氨基酸同源性比对发现Clg2蛋白与小麦黄斑叶枯病菌(Pyrenophoratritici-repentisPt-1C-BFP)、大斑刚毛座腔菌(Setosphaeriaturcica)、菜豆壳球孢菌(MacrophominaphaseolinaMS6)、斐济假尾孢菌(Pseudocercosporafijiensis)和绿色木霉(Trichodermavirens)有较高的同源性, 分别为96%、97%、76%、72%和57%。它们在保守结构域都具有相同的氨基酸序列,特别GTP/Mg2+结合位点具有GAGESGKS 氨基酸序列,在G-region 结构域有TNATDT特征性保守序列,在C-terminus有LIL特征性序列(图2)。
进一步通过scanProsite软件对Clg2蛋白分析,发现Clg2蛋白第65~328位氨基酸为蛋白激酶区,第71~79和94位氨基酸为ATP结合位点,第188位氨基酸为质子接受位点。通过对编码氨基酸序列进行疏水性/亲水性分析,结果表明,Clg2 第226位亮氨酸(Leu)疏水性最强,第30位赖氨酸(Lys)亲水性最强,并且Clg2大部分的氨基酸属于亲水性氨基酸(分值为负值),因此Clg2属于亲水性蛋白。通过二级结构的预测结果发现: Clg2 蛋白由52.10%的α-螺旋、10.36%的β-折叠、4.20%的β-转角、33.33%的随机卷曲组成。α-螺旋结构是Clg2 蛋白的主要组成部分,而α-螺旋、β-折叠和β-转角则散布于蛋白序列中。通过对分子量和等电点预测表明,Clg2分子量为40.9 kD,等电点为5.58。
2.3 系统进化树分析
利用ClustalX 2.0 软件将Clg2氨基酸序列与从NCBI GenBank 数据获取的其他植物病原真菌P.tritici-repentisPt-1C-BFP、S.turcica、C.apollinis、P.fijiensis、M.phaseolina、T.virens等的Gα氨基酸序列进行比对分析后,利用MEGA5.0 软件NJ 法构建了系统进化树。结果如图3所示, Clg2蛋白与小麦黄斑叶枯病菌(P.tritici-repentisPt-1C-BFP)和大斑刚毛座腔菌(S.turcica)处于同一分支上,表明亲缘关系最近,与斐济假尾孢菌(P.fijiensis)等亲缘关系较远。

图2 Clg2蛋白特殊保守结构域比对与分析Fig.2 Alignment and analysis of special conserved motifs of Clg2 protein
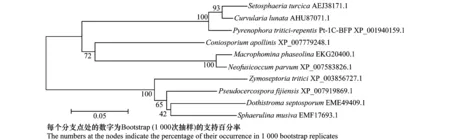
图3 玉米弯孢叶斑病菌Clg2蛋白系统进化树Fig.3 Phylogenetic tree of Clg2 protein sequences from C.lunata and other sources
2.4 病菌不同发育阶段Clg2 基因表达水平
为了研究Clg2 基因在病菌不同发育时期的表达水平,利用荧光定量PCR技术检测Clg2基因在分生孢子、不同萌发时期的分生孢子和菌丝中的表达量。结果显示,Clg2基因在5个时期均表达,其中在分生孢子中表达水平最高,其次在萌发3、6和9 h分生孢子中表达逐渐降低,在菌丝中表达最低(图4)。
3 讨论
G蛋白介导的信号传导途径是真核生物中一种非常保守的跨膜信号转导,它可以介导下游的Ca2+信号途径、cAMP信号途径和MAPK信号途径,调控病菌的生长发育和致病性[15-16],因此G蛋白在研究真菌的信号转导中处于重要的地位。

图4 实时荧光定量PCR分析病菌不同发育阶段下Clg2基因表达情况Fig.4 Expression of Clg2 gene in different development stages of C.lunata by real-time fluorescence-quantitative RT-PCR
G蛋白是由α、β和γ3个亚基构成,其中Gα被认为是G蛋白的功能亚基,在信号传导中至关重要。研究发现Gα蛋白在生物进化过程中高度保守,利用分子生物学技术比较容易获得其核苷酸序列。目前已经从灰葡萄孢菌(Botrytiscinerea)[12, 17]、构巢曲霉(Aspergillusnidulans)[18-19]、粗糙链孢菌(Neurosporacrassa)[20]、异旋孢腔菌(Cochliobolusheterostrophus)[21]、稻瘟菌(Magnaporthegrisea)[22]、玉蜀黍黑粉菌(Ustilagomaydis)[23]和尖镰孢(Fusariumoxysporum)[24]等病原菌中分离和克隆出Gα蛋白。
本研究从玉米弯孢叶斑病菌获得的Clg2蛋白,通过Pfam27.0和NCBI CDD在线分析它含有Gα蛋白的所有结构域和保守结构域的一些特征性的序列,因此认为属于Gα蛋白。将Clg2蛋白与其他植物病原真菌Gα蛋白进行多序列比对,发现它与所有Gα蛋白一样,在GTP/Mg2+结合位点都具GAGESGKS 氨基酸序列,在G-region 结构域具有TNATDT特征性保守序列,在C-terminus有LIL特征性序列,因此从保守结构和保守结构的特征序列上判断玉米弯孢叶斑病菌的Clg2蛋白应属于Gα蛋白。但是在对序列多重比对时发现菜豆壳球孢和斐济假尾孢菌在TNATDT和LIL特征性序列区各相差一个核苷酸,这表明Clg2蛋白亲缘关系可能与这两个病原菌会更远些。随后在系统进化树中也发现玉米弯孢叶斑病菌的Clg2蛋白与菜豆壳球孢和斐济假尾孢菌不处于同一个分支上,并离斐济假尾孢菌较远,该结果与保守基因序列分析结果一致。
目前在高等真核生物中发现至少有21种Gα亚基,在多数丝状真菌中也有3个Gα亚基,并且根据它们保守区序列可以划分为5种亚型,各亚型间的Gα亚基在功能方面存在一定的差异。例如在异旋孢腔菌(C.heterostrophus)中一种Gα基因可以调控病菌有性交配和附着胞的形成[21],magA基因在稻瘟菌(M.grisea)中调控病菌生长、发育和致病性[22],在玉米大斑病菌中Stga-1基因(一种Gα亚型)可以调控玉米大斑病菌的致病性、交配、毒素合成及色素的代谢[25],而Stga-2(另一种Gα亚型)推测可能与大斑病菌的有性交配有关[26]。然而Gα在玉米弯孢叶斑病菌中的功能尚无人研究,本文克隆出Clg2基因,并通过荧光定量PCR技术发现它在分生孢子形成期表达量最高,暗示它可能与分生孢子形成有关。研究发现,玉米弯孢叶斑病菌在自然界中主要以无性繁殖为主,其无性阶段产生的分生孢子通过接触寄主萌发侵入寄主,在寄主中扩展、繁殖、产生大量的分生孢子。分生孢子可借助介质形成再侵染和循环。因此分生孢子成为该病害发生和流行的主要影响因子。通过Clg2蛋白研究将有可能寻找到与病菌无性产孢的调控通路,这将为防治该病害开发新型药剂提供有效的靶位点,通过抑制病菌分生孢子产生和降低致病性,可有效地阻止病害的传播、发生与危害,为创建持久、有效防治技术提供理论基础。
[1] 戴法超, 高卫东, 王晓鸣,等. 玉米弯孢菌叶斑病的初步研究简报[J]. 植物保护, 1996, 22(4): 36-37.
[2] 戴法超, 王晓鸣, 朱振东,等. 玉米弯孢菌叶斑病研究[J]. 植物病理学报, 1998, 28(2): 123-129.
[3] 吕国忠, 刘志恒, 何富刚. 辽宁省暴发一种新病害-玉米弯孢菌叶斑病[J]. 植物保护, 1997, 23(4): 20-23.
[4] Xu S F, Chen J, Liu L X, et al. Proteomics associated with virulence differentiation ofCurvularialunatain maize in China [J]. Journal Integrative Plant Biology, 2007, 49(4): 487-496.
[5] Gao S G, Liu T, Li Y Y, et al. Understanding resistant germplasm-induced virulence variation through analysis of proteomics and suppression subtractive hybridization in a maize pathogenCurvularialunata[J]. Proteomics, 2012, 12(23/24): 3524-3535.
[6] Gao J X, Liu T, Chen J. Insertional mutagenesis and cloning of the gene required for the biosynthesis of the non-host-specific toxin inCochlioboluslunatusthat causes maize leaf spot [J]. Phytopathology, 2014, 104: 332-339.
[7] Liu T, Xu S F, Liu L X, et al. Functional analysis of multi-copy Brn1 gene from the phytopathogenic fungusCurvularialunata[J].Europe Journal of Plant Pathology,2011,131:211-219.
[8] Neves S R, Ram P T, Iyengar R. G protein pathways [J]. Science, 2002, 296: 1636-1639.
[9] Downes G B, Gautam N. The G protein subunit gene families[J]. Genomies, 1999, 62: 544-552.
[10]Strathmann M, Wilkie T M, Simon M I. Diversity of the G-protein family:sequences from five additionalαsubunits in the mouse [J]. Proceedings of the National Academy of Sciences, 1989, 86: 7407-7409.
[11]Clapham D E, Neer E J. G proteinβγsubunits [J]. Annual Review of Pharmacology and Toxicology,1997,37:167-203.
[12]Döhlemann G, Bemdt P, Hahn M. Different signaling pathways involving a G-αprotein cAMP and a MAP kinase control germination ofBotrytiscinemaconidia [J]. Molecular Microbiology, 2006, 59: 821-835.[13]Kyte J, Doolittle R F. A simple method for displaying the hydropathic character of a protein [J]. Journal of Molecular Biology, 1982, 157: 105-132.
[14]Combet C, Jambon M, Deleage G, et al. Geno3D: automatic comparative molecular modeling of protein [J]. Journal Bioinformatics, 2002, 18: 213-214.
[15]Gummer J P A, Trengove R D, Oliver R P. A comparative analysis of the heterotrimeric G-protein Gα, Gβ and Gγ subunits in the wheat pathogenStagonosporanodorum[J]. BMC microbiology, 2012, 12: 131.
[16]Studt L, Humpf H U, Tudzynski B, et al. Signaling governed by G proteins and cAMP is crucial for growth secondary metabolism and sexual development inFusariumfujikuroi[J]. PLoS ONE,2013,8(2):e58185.
[17]Gronover S, Kasulkc C, Tudzynski D, et al. The role of G protein alpha subunits in the infection process of the gray mold fungusBotrytiscinema[J]. Molecular Plant-Microbe Interaction, 2001, 14:1293-1302.
[18]Lafon A, Seo J A, Hart K H, et al. The heterotrimeric G-protein GanB(α)-SfaD(β)-GpgA(γ) is a carbon source sensor involved in early cAMP-dependent germination inAspergillusnidulans[J]. Genetics, 2005, 171: 71-80.
[19]Chang M H, Chae K S, Hart D M, et al. The GanB Gα-protein negatively regulates asexual sporulation and plays a positive role in conidial germination inAspergillusnidulans[J]. Genetics, 2004, 167: 1305-1315.
[20]Kays A M, Rowley P S, Baasiri R A, et al. Regulation of conidiation and adenylyl cyclase levels by the Gαprotein GNA-3 inNeurosporacrassa[J]. Molecular and Cellular Biology, 2000, 20: 7693-7705.
[21]Horwitz B A, Sharon A, Lu S W, et al. A G protein alpha subunit fromCochliobolusheterostrophusinvolved in mating and appressorium formation [J].Fungal Genetics and Biology,1999,26:19-32.
[22]Liu S, Dean R A. G proteinαsubunit genes control growth, development and pathogenicity ofMagnaporthegrisea[J]. Molecular Plant-Microbe Interaction, 1997, 10: 1075-1086.
[23]Regenfelder E, Spellig T, Harlmann A, et al. G proteins inUstilagomaydis:transmission of multiple signals [J]. EMBO Journal, 1997, 16: 1934-1942.
[24]Jain S, Akiyama K, Mac K, et al. Targeted disruption of a G proteinαsubunit gene results in reduced pathogenicity inFusariumoxysporum[J]. Current Genetics,2002,41:407-413.
[25]郝志敏. 玉米大斑病菌G蛋白和磷脂酶C基因的克隆与功能分析[D]. 保定: 河北农业大学生命学院, 2008.
[26]郝志敏,申珅,李志勇,等.玉米大斑病菌Stga-2及其启动子的克隆与基因表达分析[J].中国农业科学,2010,43(18):3705-3712.
(责任编辑:田 喆)
Cloning, sequence characteristics and expression analysis ofClg2 gene in different development stages ofCurvularialunata
Hou Jumei, Wang Yuying, Zuo Yuhu, Zhao Fengzhou, Wang Xingming, Liu Tong
(Institute of Plant Pathology and Applied Microbiology, College of Agronomy,Heilongjiang Bayi Agricultural University, Daqing 163319, China)
G protein signal pathway plays an important role in regulation of morphology, infection structure formation and virulence of the plant pathogen. To study the regulation mechanism of G protein inCurvularialunata, a Gαgene with an ORF of about 1 074 bp was cloned based on an EST from the full-length cDNA library, which was named asClg2. This gene included 5 exons and 4 introns, and encoded 357 amino acids through comparing genomic DNA and cDNA sequences. Sequence alignment and phylogenetic analysis showed that this protein contained the characteristic conserved sequence like that of other Gαproteins, and shared 96% and 97% similarity with Gα protein fromPyrenophoratritici-repentisPt-1C-BFPandSetosphaeriaturcica, respectively. Expression ofClg2 in different development stages ofC.lunatawas analyzed by fluorescence-quantitative RT-PCR. These results showed that the highest expression level was found in conidia, whereas the lowest in hyphae, which suggested thatClg2 might play a vital role in the formation of conidia, which may provide additional information for the study of the function of Clg2.
G protein;Curvularialunata; Gα; fluorescence-quantitative RT-PCR
2014-11-26
2015-02-14
黑龙江八一农垦大学博士启动基金(B2011-03)
S435.131
A
10.3969/j.issn.0529-1542.2015.04.013
* 通信作者 E-mail:liutongamy@sina.com
