纳米抗体:一种新型的分子成像工具
2015-11-28作者刘维荡刘巍峰
【作者】刘维荡,刘巍峰
上海中医药大学附属岳阳中西医结合医院医学装备处,上海市,200437
纳米抗体:一种新型的分子成像工具
【作者】刘维荡,刘巍峰
上海中医药大学附属岳阳中西医结合医院医学装备处,上海市,200437
纳米抗体(nanobody, Nb)是存在于骆驼科血液中的一种天然缺失轻链的重链抗体。以纳米抗体为基础的分子探针和放射性核素,近红外染料,超声微泡等相结合,被应用到多种疾病的分子成像。该文结合最近几年纳米抗体在分子成像中的应用和临床数据,来介绍它作为一种新型的分子成像工具在疾病诊断中的应用及未来发展方向。
纳米抗体;诊断检测;分子成像;癌症
0 引言
随着疾病早期快速诊断的需求越来越强烈,分子成像技术成为当前最热门的研究领域,在疾病的诊断、临床的医疗实践中都是不可或缺的工具[1-2]。在过去十几年里,分子成像技术已经有了长足的发展,各种检测手段不断出现,如计算机断层扫描(CT)、核磁共振成像(MRI)、正电子发射断层扫描(PET)、单光子发射计算机断层摄影(SPECT)、光学成像、超声成像(USI),研究人员现在可以利用这些成像手段监测生物体体内的各种动态变化过程[1-4]。
无论采用何种成像技术,分子成像通常都需要利用探针将示踪分子(如放射性核素,近红外染料,微泡等)输送到靶标,来达到组织成像的目的。人们利用具有特异性靶向目标靶分子的探针[4],如抗体[19]、多肽[5]、小分子配体[6]、核酸适配体(aptamers)[7]等,作为载体将放射性核素、超声成像微泡等运送到靶标,从而使病灶迅速积累信号,快速成像。其中单克隆抗体和工程抗体在分子成像中的潜力最大,但单克隆抗体分子量大,体内代谢缓慢,高免疫原性等,限制了其在分子成像中的应用,而工程抗体[11],如Fab、scFv、人源化抗体、嵌合型抗体等[4,8-9],在分子稳定性,抗原的亲和力和特异性方面仍然不理想。
1993年,纳米抗体首次以一个新的抗体种类在Nature杂志上报道,人们发现在骆驼体内有一种特殊的抗体,它只有重链,缺少轻链,使其与抗原结合的部位只有重链可变区,因此被称为单域重链抗体(VHH)[10],见图1。VHH分子质量很小,仅有15 KD,约为常规抗体的十分之一,直径仅2.5 nm,长4.2 nm[11],由于分子尺寸在纳米级别,又被称为纳米抗体(nan°b°dy, Nb),是迄今为止自然界存在的可与抗原结合的最小片段。由于纳米抗体的独特生物学特征,使得纳米抗体在疾病的分子成像方面有很大的应用潜力。因此,本文将根据最新的研究结果,来全面介绍纳米抗体在疾病的分子成像方面的应用。
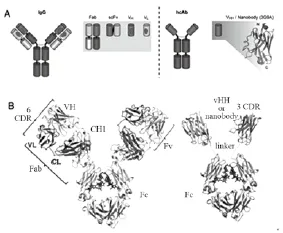
图1 传统抗体和纳米抗体的结构示意图[13]Fig.1 Structure scheme °f traditi°nal antib°dies and nan°b°dy[13]
1 纳米抗体的生物学特征
1.1纳米抗体的结构特征
自1993年第一次完整地报道纳米抗体以来,研究人员对纳米抗体的结构、功能和应用有了越来越详细的了解。研究发现纳米抗体的体积非常小,相对于单克隆抗体的6个互补决定区(CDR)(图1),纳米抗体仅有3个CDR区,但具备了抗原特异性结合能力和高亲和力,具备完整的抗体功能[13]。由于分子量比较小,纳米抗体的化学活性更强,具备纳米级别的分子亲和力,能有效的识别和结合一些结构性抗原表位。
纳米抗体的二级结构是由两个β折叠片段形成支架结构,三个CDR区集中在一侧参与抗原的识别与结合。纳米抗体的重链可变区(VHH)和传统抗体的单域可变区(VH)结构十分相似,但是通过对比发现,VHH和VH的结构有细微的差别,但其结构与功能却有很大的差异,见图2。

图2 VH 与 VHH 结构示意图[11]Fig.2 Structure scheme °f VH and VHH[11]
1.2纳米抗体的功能特性
纳米抗体独特的分子结构,使其具有传统抗体所不具有的一些特性。研究发现,纳米抗体的重折叠能力非常强,即使暴露在极端环境下,如非常低或者非常高的PH和温度下仍能够维持自身结构,即使发生变性,恢复到正常环境时,可以很容易复性[11]。
传统单克隆抗体在用于病人治疗时会产生免疫原性,它会使患者产生强烈的免疫反应,对病人身体造成很大的损伤,而纳米抗体由于本身分子量小,只有一个结构域,而且缺乏Fc片段,不会引起补体反应,从而使其免疫原性大为降低。而且由于纳米抗体的分子量很小,从而使其能够穿过血管壁,到达致密组织内部,如实体肿瘤等,从而能够快速到达靶标,这使得纳米抗体在疾病的诊断和治疗方面有很大的优势[6]。
此外,纳米抗体易于通过基因工程技术进行改造,如构建多价或多特异性抗体相对于单克隆抗体来说更加容易,而且人们也可以根据自己的实际需求构建融合分子,如将纳米抗体和功能性多肽、酶,能延长半衰期的血清白蛋白,放射性核素等结合,纳米抗体作为载体将融合的分子运输到靶标,从而使其发挥作用,这使得药物靶向治疗成为可能[10,17-22],见图3。

图3 多价、多特异性纳米抗体示意图[13]Fig.3 Schematic illustrati°ns °f multivalent and multispecific nan°b°dy[13]
2 纳米抗体在疾病分子成像中的应用
疾病的早期快速检测诊断,是疾病诊疗过程中的重要组成部分,也是主要难题。纳米抗体由于分子量小,可以注射几个小时后就能到达靶标,并且血液清除速度快,可以高特异性地结合到靶标,使得纳米抗体成为理想的分子成像探针。研究人员已经将纳米抗体与PET、SPECT、光学成像和超声成像技术相结合,用于临床疾病快速、灵敏、定量地检测诊断[23-24]。
放射性核素分子成像技术是现阶段最主要,发展最成熟的分子成像技术,它包括SPECT技术和PET技术。纳米抗体和PET成像技术结合时,需要纳米抗体与合适的正电子放射性核素偶联(如18F、64Cu、68Ga等)[24],与其他几种成像技术相比,PET成像技术在感光度和分辨率方面更加灵敏,使得其在过去十年里获得了更多的普及使用[24]。而在SPECT技术成像中,纳米抗体需要标记上能发射出γ射线的放射性核素(如99mTc和111In)[23]。这些γ射线可以通过专用的γ相机或SPECT检测仪器检测到,然后将电子信号转化成图像,精确定位放射性标记的纳米抗体的位置。而在纳米抗体的生产中,为了蛋白的纯化,纳米抗体带有6 x His标签,使得纳米抗体更加容易和99mTc等核素偶联[25-26]。
纳米抗体与光学成像技术相结合是肿瘤成像中的一种新兴技术,它是将纳米抗体和合适的发光基团(多为近红外染料,如IRDye800CW等)结合,来实现肿瘤成像[27]。光学成像的主要优点是设置简单,不需要专用的检测设备,经济成本低,而且非常适合于研究临床疾病的表面病变。
超声成像是利用声波在不同器官组织中的反射的不同而达到诊断的目的。以纳米抗体为基础的超声微泡靶向造影剂,由于其分子量小,血管等组织穿透力强、渗透性好,静脉注入后实际到达靶细胞的浓度高,能够产生足够高的信号强度,收到较为理想的显像效果,有望研制出一种穿透力强的小型化靶向超声造影剂[28-29]。
作为一种新的分子成像平台,纳米抗体不仅应用于肿瘤成像,而且还被应用于监测关节炎的病情发展,动脉粥样硬化和其他炎症疾病的分子成像[18,25-26]。本文将以一些最新的应用为例,介绍纳米抗体作为分子成像工具在体内无创伤诊断中的应用。
2.1表皮生长因子受体成像
表皮生长因子受体(EGFR,又被称为HER-1),属于HER激酶家族。研究发现,EGFR在人的多种肿瘤细胞中过度表达,如胰腺癌、前列腺癌、结直肠癌、乳腺癌等。EGFR调控细胞分裂增殖,血管形成,它的表达受到严格调控,当EGFR持续激活时,会导致细胞的过度分裂,促进血管的形成,抑制细胞的凋亡[30]。因此,EGFR的表达情况被作为肿瘤检测的指标,并且可以通过分子成像技术对EGFR高表达肿瘤进行早期诊断。
Huang等[13]将EGFR的特异性抗体 8B6的 C端的6 x His标签和放射性核素99mTc偶联获得99mTc-8B6融合分子,通过SPECT成像技术检测发现,99mTc-8B6表现出很高的EGFR特异性,可以很快地聚集在EGFR过度表达的肿瘤组织,而且纳米抗体很快地被肾脏排泄掉,其在体内的半衰期仅有1.5 h,很大程度上减少了放射性核素在体内存留的时间。
V°sjan等[22]则是将EGFR的特异性抗体7D12通过对异硫氰酸去铁胺(DF-BZ-NCS)与放射性核素68Ga偶联,然后通过PET成像技术检测纳米抗体的药物动力学发现,注射1 h后,纳米抗体大量聚集到EGFR过表达的肿瘤组织,显示出很高的肿瘤摄取率,而且血液清除快。Oliveira等[31]将7D12抗体与近红外染料IRDye800CW结合,利用光学成像技术发现,注射30 min后即可被检测到肿瘤组织,并且血液中残留的纳米抗体少,背景低。
2.2血管细胞粘附因子-1成像
血管细胞粘附因子-1(VCAM-1)在体内介导淋巴细胞、嗜酸粒细胞、嗜碱粒细胞、单核细胞等免疫相关细胞向血管内皮粘附。VCAM-1在非动脉粥样硬化的动脉组织中低表达,而高胆固醇血症则能迅速诱导VCAM-1的过表达,容易诱导发生动脉粥样硬化[32],这使得VCAM-1成为检测动脉粥样硬化的一个高度相关的靶分子。
Br°isat等[34]已经报道了利用纳米抗体来进行粥样硬化斑块的临床成像。研究人员将VCAM-1特异性的多种纳米抗体用放射性核素99mTc标记,然后注射到粥样硬化病变的ap°E缺陷小鼠模型中,然后利用SPECT成像。通过比对成像结果发现,其中有一个纳米抗体cAbVCAM1-5在小鼠体内表现出很高的特异性,可以识别动脉粥样硬化病变组织,并且特异性地聚集在粥样硬化斑块处,而且可以迅速地被肾脏清除,血液背景低。
2.3癌胚抗原成像
癌胚抗原(CEA)是胎儿发育过程中存在于胃肠道组织中的一个高度糖基化的蛋白分子。虽然在成人体内的表达量非常低,但是研究发现,CEA在多种癌细胞中是高表达的,如乳腺癌、胃癌、卵巢癌等,使得人们在过去几十年,一直研究CEA在癌症发生过程中的功能,及在癌症的诊断和治疗的作用[11]。
C°rtez-Retam°z° 等[19]将CEA特异性纳米抗体CEA1用放射性核素99mTc标记,然后注射到人类结肠癌(LS174T)裸鼠模型中,通过SPECT技术检测纳米抗体在小鼠体内的生物分布和药物代谢动力学,检测结果表明,注射3 h后,纳米抗体的平均肿瘤吸收率大于3%ID/g,并且低背景。但是由于纳米抗体会聚集在肝脏和肾脏部位,使得纳米抗体在检测这些部位的疾病时,会受到限制。
2.4巨噬细胞甘露糖受体成像
巨噬细胞甘露糖受体(MMR)是一种巨噬细胞表达的跨膜糖蛋白,它主要负责巨噬细胞对微生物,大分子蛋白的内吞作用。据报道,某些肿瘤间充质成分,特别是在缺氧部位,MMR的表达量特别高,从而促进了血管的生成,肿瘤的转移和免疫抑制[35-36]。因此,MMR成为了一个潜在的肿瘤标志物。
研究人员将anti-MMR的纳米抗体标记上99mTc,然后注射到乳腺癌(TS/A)和肺癌(3LL-R)裸鼠模型中,SPECT/CT成像显示,纳米抗体快速定位到MMR高表达组织,并且显示高肿瘤组织特异性[36]。然而在小鼠模型中,纳米抗体大量积累在肝脏和脾脏。因此有人提出构建多价的纳米抗体,从而增加抗体的特异性,减少非特异性信号,减少纳米抗体的半衰期,研究表明大尺寸的多价纳米抗体不会影响与肿瘤的特异性结合。
3 总结
分子成像技术的快速准确的诊断为各种疾病的治疗,治疗过程中的监控和治疗后干预提供了基础。而纳米抗体以其分子量小,组织穿透能力强,半衰期短等特点,被作为一种新型的分子探针应用到肿瘤,炎症等疾病的分子成像,并且发展出了一套完整的诊断方法。随着纳米抗体成像技术的不断完善,它将能够快速诊断出不同类型、不同阶段的肿瘤和其他疾病,并且可以根据病人的个体差异,而实行差异化治疗。然而新的分子探针真正走向临床,仍然面临着许多挑战,如政府监管,潜在市场有限,受到其他分子成像探针的挑战等。但是大量的实验结果证明,纳米抗体在分子成像方面将会有很大的应用潜力,这使得纳米抗体将会在未来的临床诊断当面发挥重要作用。
纳米抗体在疾病的分子成像方面的应用只是它很小的一个方面,它在疾病的治疗,食品安全,环境防治方面都有着很大的应用潜力,相信随着跨学科的合作,纳米抗体将会给人类社会带来更多的便利。
[1] Herschman HR. M°lecular imaging: l°°king at pr°blems, seeing s°luti°ns[J]. Science, 2003, 302(5645): 605-608.
[2] Baum RP, Kulkarni HR. THERANOSTICS: fr°m m°lecular imaging using Ga-68 labeled tracers and PET/CT t° pers°nalized radi°nuclide therapy-the bad berk a experience[J]. Theran°stics, 2012, 2(5): 437-447.
[3] Pichler BJ, Wehrl HF, Judenh°fer MS. Latest advances in m°lecular imaging instrumentati°n[J]. J Nucl Med, 2008, 49(Suppl 2) :5S-23S.
[4] Chakravarty R, G°el S, Cai W. Nan°b°dy: the “magic bullet” f°r m°lecular imaging[J]. Theran°stics, 2014, 4(4): 386-398.
[5] Reubi JC, Maecke HR. Peptide-based pr°bes f°r cancer imaging[J]. J Nucl Med, 2008, 49(11): 1735-1738.
[6] Cui M. Past and recent pr°gress °f m°lecular imaging pr°bes f°r β-amyl°id plaques in the brain[J]. Curr Med Chem, 2014, 21(1): 82-112.
[7] Kim B,Yang J, Hwang M, et al. Aptamer-m°dified magnetic nan°pr°be f°r m°lecular MR imaging °f VEGFR2 °n angi°genic vasculature[J]. Nan°scale Res Lett, 2013, 8(1): 399.
[8] Olafsen T, Wu AM. Antib°dy vect°rs f°r imaging[J]. Semin Nucl Med, 2010, 40(3): 167-181.
[9] Kaur S,Venktaraman G, Jain M, et al. Recent trends in antib°dybased °nc°l°gic imaging[J]. Cancer Lett, 2012, 315(2): 97-111.
[10]H°lliger P, Huds°n PJ. Engineered antib°dy fragments and the rise °f single d°mains[J]. Nat Bi°techn°l, 2005, 23(9): 1126-1136.
[11]Revets H, De Baetselier P, Muyldermans S. Nan°b°dies as n°vel agents f°r cancer therapy[J]. Expert Opin Bi°l Ther, 2005, 5(1): 111-124.
[12] Xavier C,Vaneycken I, D'Huyvetter M, et al. Synthesis, preclinical validati°n, d°simetry, and t°xicity °f 68Ga-NOTA-anti-HER2 Nan°b°dies f°r iPET imaging °f HER2 recept°r expressi°n in cancer[J]. J Nucl Med, 2013, 54(5): 776-784.
[13] Muyldermans S, Baral TN, Retam°zz° VC, et al. Camelid immun°gl°bulins and nan°b°dy techn°l°gy[J].Vet Immun°l Immun°path°l, 2009, 128(1-3): 178-183.
[14] Muyldermans S, Atarh°uch T, Saldanha J, et al. Sequence and structure °f VH d°main fr°m naturally °ccurring camel heavy chain immun°gl°bulins lacking light chains[J]. Pr°tein Eng, 1994, 7(9): 1129-1135.
[15] Vu KB, Ghahr°udi MA, Wyns L, et al. C°mparis°n °f llama VH sequences fr°m c°nventi°nal and heavy chain antib°dies[J]. M°l Immun°l, 1997, 34(16-17): 1121-1131.
[16] Zabetakis D, Anders°n GP, Bayya N, et al. C°ntributi°ns °f the c°mplementarity determining regi°ns t° the thermal stability °f a single-d°main antib°dy[J]. PL°S One, 2013, 8(10): e77678.
[17] Vincke C, L°ris R, Saerens D, et al. General strategy t° humanize a camelid single-d°main antib°dy and identificati°n °f a universal humanized nan°b°dy scaff°ld[J]. J Bi°l Chem, 2009, 284(5): 3273-3284.
[18] Hassanzadeh-Ghassabeh G, Dev°°gdt N, De Pauw P, et al. Nan°b°dies and their p°tential applicati°ns[J]. Nan°medicine (L°nd), 2013, 8(6): 1013-1026.
[19] C°rtez-Retam°z° V, Lauwereys M, Gh GH, et al. Efficient tum°r targeting by single-d°main antib°dy fragments °f camels[J]. Int J Cancer, 2002, 98(3): 456-462.
[20] V°sjan MJ, Vercammen J, K°lkman JA, et al. Nan°b°dies targeting the hepat°cyte gr°wth fact°r: p°tential new drugs f°r m°lecular cancer therapy[J]. M°l Cancer Ther, 2012, 11(4): 1017-1025.
[21] Tijink BM, Laeremans T, Budde M, et al. Impr°ved tum°r targeting °f anti-epidermal gr°wth fact°r recept°r Nan°b°dies thr°ugh albumin binding: taking advantage °f m°dular Nan°b°dy techn°l°gy[J]. M°l Cancer Ther, 2008, 7(8): 2288-2297.
[22] V°sjan MJ, Perk LR, R°°vers RC, et al. Facile labelling °f an antiepidermal gr°wth fact°r recept°r Nan°b°dy with 68Ga via a n°vel bifuncti°nal desferal chelate f°r immun°-PET[J]. Eur J Nucl Med M°l Imaging, 2011, 38(4): 753-763.
[23] G°mes CM, Abrunh°sa AJ, Ram°s P, et al. M°lecular imaging with SPECT as a t°°l f°r drug devel°pment[J]. Adv Drug Deliv Rev, 2011, 63(7):547-554.
[24] Ametamey SM, H°ner M, Schubiger PA. M°lecular imaging with PET[J]. Chem Rev, 2008, 108(5): 1501-1516.
[25] Eckelman WC. Unparalleled c°ntributi°n °f technetium-99m t° medicine °ver 5 decades[J]. JACC Cardi°vasc Imaging, 2009, 2(3): 364-368.
[26] Chakravarty R, Shukla R, Ram R, et al. Nan°ceria-PAN c°mp°sitebased advanced s°rbent material: a maj°r step f°rward in the field °f clinical-grade 68Ge/68Ga generat°r[J]. ACS Appl Mater Interfaces, 2010, 2(7): 2069-2075.
[27] van Dam GM, Themelis G, Crane LM, et al. Intra°perative tum°rspecific flu°rescence imaging in °varian cancer by f°late recept°ralpha targeting: first in-human results[J]. Nat Med, 2011, 17(10): 1315-1319.
[28] P°stema M,Gilja OH. C°ntrast-enhanced and targeted ultras°und[J]. W°rld J Gastr°enter°l, 2011, 17(1): 28-41.
[29] Hern°t S, Unnikrishnan S,Du Z. et al. Nan°b°dy-c°upled micr°bubbles as n°vel m°lecular tracer[J]. J C°ntr°l Release, 2012, 158(2): 346-353.
[30] Altintas I, K°k RJ, Schiffelers RM. Targeting epidermal gr°wth fact°r recept°r in tum°rs: fr°m c°nventi°nal m°n°cl°nal antib°dies via heavy chain-°nly antib°dies t° nan°b°dies[J]. Eur J Pharm Sci,2012, 45(4): 399-407.
[31] Oliveira S, van D°ngen GA, Stigter-van Walsum M, et al. Rapid visualizati°n °f human tum°r xen°grafts thr°ugh °ptical imaging with a near-infrared flu°rescent anti-epidermal gr°wth fact°r recept°r nan°b°dy[J]. M°l Imaging, 2012, 11(1): 33-46.
[32] Li H, Cybulsky MI, Gimbr°ne MA Jr, et al. An ather°genic diet rapidly induces VCAM-1, a cyt°kine-regulatable m°n°nuclear leuk°cyte adhesi°n m°lecule, in rabbit a°rtic end°thelium[J]. Arteri°scler Thr°mb, 1993, 13(2): 197-204.
[33] Li H, Cybulsky MI, Gimbr°ne MA Jr, et al. Inducible expressi°n °f vascular cell adhesi°n m°lecule-1 by vascular sm°°th muscle cells in vitr° and within rabbit ather°ma[J]. Am J Path°l, 1993, 143(6): 1551-1559.
[34] Br°isat A, Hern°t S, T°czek J, et al. Nan°b°dies targeting m°use/ human VCAM1 f°r the nuclear imaging °f ather°scler°tic lesi°ns[J]. Circ Res, 2012, 110(7): 927-937.
[35] H°ng H, Sun J, Cai W. Radi°nuclide-based cancer imaging targeting the carcin°embry°nic antigen[J]. Bi°mark Insights, 2008, 3: 435-451.
[36] M°vahedi K, La°ui D,Gysemans C, et al. Different tum°r micr°envir°nments c°ntain functi°nally distinct subsets °f macr°phages derived fr°m Ly6C(high) m°n°cytes[J]. Cancer Res, 2010, 70(14): 5728-5739.
Nanobody: a Novel Molecular Imaging Tool
【 Writers 】LIU Weidang, LIU Weifeng Medical Equipment Department, Yueyang Hospital of Integrated Traditional Chinese and Western Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai, 200437
【 Abstract 】Nanobodies are derived from the variable domain of the heavy-chain antibodies (HCAbs) that occur naturally in the serum of camels. Using nanobody-based probes, several imaging techniques such as radionuclide-based, optical and ultrasound have been employed for visualization of target expression in various disease models. Combined with application and clinical data of nanobody in molecular imaging in recent years, this paper introduces its application in the diagnosis of diseases and the future development as a novel molecular imaging tool.
nanobody, diagnosis and detection, molecular imaging, cancer
Q819
A
10.3969/j.issn.1671-7104.2015.06.010
1671-7104(2015)06-0423-04
2015-09-24
刘维荡,E-mail: 1738290396@qq.c°m
