医用注射器具中DEHP增塑剂溶出量测定
2015-11-28作者郑建王敏珠王安燕徐萍华韩银文燕张莉
【作者】郑建,王敏珠,王安燕,徐萍华,韩银,文燕,张莉
国家食品药品监督管理局杭州医疗器械质量监督检验中心,杭州市,310009
医用注射器具中DEHP增塑剂溶出量测定
【作者】郑建,王敏珠,王安燕,徐萍华,韩银,文燕,张莉
国家食品药品监督管理局杭州医疗器械质量监督检验中心,杭州市,310009
建立气相色谱-串联质谱(GC-MS/MS)测定医用注射器具医疗器械产品中DEHP溶出量分析方法,探讨样品前处理对测定的影响和评价。通过分析确认,模拟临床使用条件,在37oC条件下平衡浸提,浸提液经氯仿萃取,萃取液进行气相色谱-串联质谱分析。该方法简便快速,方法检出限低,定性定量准确。定量下限(S/N =5)为 0.075 μg/mL,平均加标回收率为92%~ 98%,相对标准偏差为1.01%~1.61%。 此方法样品前处理简单、干扰少、重现性好、分离效率高, 可做为医用注射器具医疗器械产品中DEHP溶出量的质量控制的方法之一。
注射器;气相色谱-质谱法;DEHP;塑化剂
一次性无菌注射器是我国20世纪80年代引进的一种新型医疗器械。它能避免交叉感染,使用方便,是临床上广泛使用的一种注射穿刺器械,目前,国内年产量约160亿只,年产值约50亿元[1]。其结构主要由芯杆、活塞、外套与注射针构成,主要原材料有注射针—奥氏体不锈钢(GB 18457—2001)、注射器(注射器外套—聚丙烯、芯杆—聚丙烯或聚乙烯、活塞—天然橡胶、润滑剂—聚二甲基硅氧烷)[2-4]。由高分子材料组成的注射器往往可能加入邻苯类物质增强注射器的可塑像和柔软度,特别是注射器所用橡胶活塞采用的天然橡胶[5]部位尤为明显。因而采用一次性注射器吸取、溶配及注射含脂溶性溶剂的注射液时,则可能溶出邻苯类物质,而邻苯类物质应用最多的是DEHP。动物实验研究表明,DEHP具有广泛的不良反应,明显表现为肝脏毒性和睾丸萎缩[7]。“台湾塑化剂事件”中DEHP是通过胃肠道吸收后对人体产生不良影响,注射器中溶出的DEHP,则能直接进入人体血液、器官和组织,相对于胃肠道吸收可能对患者带来更严重的危害[8],因此有必要控制注射器中的DEHP含量,从而更有效地加强对注射器的技术监控工作,保证消费者使用其安全性。
1 实验部分
1.1仪器和试剂
安捷伦7890A/5975C 气相质谱联用仪;邻苯二甲酸二(2-乙基已基)酯(DEHP)标准品(FLUKA公司),三氯甲烷(色谱纯),乙醇(色谱纯,TEDIA“天地”试剂公司),无水硫酸钠(色谱纯,西格玛公司), Milli-Q超纯水系统;样品:一次性使用无菌注射器(带针)。
1.2浸提液制备
参考行业标准YY/T 0927—2014:聚氯乙烯医疗器械中邻苯二甲酸二(2一乙基己基)酯(DEHP)溶出量测定指南及医疗器械在临床中的使用情况,本文选用乙醇水溶液(密度为0.937 8 g/mL)、氯化钠注射作为浸提液,样品加浸提液至公称容量,在37±1°C下恒温(1 h),将样品与液体分离,冷却至室温作为样品浸提液。
1.3样品浸提液的预处理
取“1.2”制备的浸提液于玻璃离心管中,加入氯仿震荡5 min,离心分离,取氯仿层作为检验液待测。
1.4仪器条件[8]
气相-质谱联用仪: 安捷伦7890A-5975C。
色谱柱:HP-5MS石英毛细管柱30 m×0.25 mm×0.25 μm。
柱温:150°C保持0.5 min,然后以10°C/min的速度升温至280°C,保持7 min。
进样口温度:280°C。
EI离子源温度:230°C, 四级杆温度:150°C。进样体积:1 μL。载气:氦气,纯度≥99.99%, 流速:1.5 mL/min。测定方式:全扫描总离子图(TIC)定性,选择离子检测(SIM)定量。
1.5标准溶液制备
准确称取标准物的DEHP约1.0 g,用氯仿配成100 mg/mL的储备液,再用氯仿配置0.5~10 μg/mL 5个系列DEHP标准溶液待测。
2 结果与讨论
2.1样品浸提液预处理方法的选择
水或盐溶液容易对柱子及离子源造成污染,缩短使用寿命,不能将“1.2”制备出的浸提液直接进仪器分析,因此需要对浸提液进行预处理将水和盐成分去除。若参考行业标准YY/T 0927—2014,即采用将浸提液在50°C真空干燥箱中干燥,待浸提液完全消失再用等体积正己烷溶解的方法[9],试验发现浸提液中水分子很难被蒸发,特别是盐溶液中的水分子更不容易去除,同时一般注射器医疗器械产品中DEHP含量很微量,用等体积的正己烷溶解后,供试液中待测物一般在仪器检出限以下。因此本文根据DEHP微溶于水而易溶于氯仿的性质,采用浸提液中加入氯仿震荡5 min,离心分离,取氯仿层作为检验液的方法。该方法快速,简单,又降低方法检出限。
2.2定性分析
通过测定DEHP标准溶液,可以确定在“1.4”仪器条件下DEHP色谱峰的保留时间在7.62 min,DEHP总离子图及特征离子图见图1、图2。样品液检出的色谱峰不受其他峰干扰与标准溶液色谱峰的保留时间一致,并且样品扣除背景的质谱图中DEHP的全部特征离子均出现。
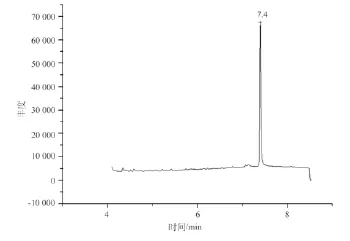
图1 DEHP总离子图Fig.1 Full scan pr°duct i°n spectrum
2.3定量分析
采用外标法,选择DEHP的定量选择离子为m/z=70、149、167,在气相-质谱联用仪的SIM扫描模式下,分别对“1.5”工作标准溶液和“1.3”的样品检验液进行分析。由DEHP的浓度对响应值建立工作标准曲线及回归方程,根据工作标准曲线计算样品检验液中DEHP的含量,最终计算出每副样品中DEHP的溶出含量。
2.4方法学验证
2.4.1校准曲线、线性范围及检出限
在分析确认的色谱条件下测定DEHP标准系列的响应值,在0.5~10 μg/mL的线性范围内曲线方程y=5.561E+004x(回归方程强制过零),r2=0.999 4。以3倍信噪比S/N对应作检出限0.015 μg/mL,将5倍的检出限作为方法定量下限0.075 μg/mL。
2.4.2精密度及准确度
配制0.5 μg/mL的DEHP标准溶液试样进行6次测定。得精密度(RSD)为1.71%,回收率97.3%。结果表明精密度准确度良好。
2.4.3加标回收率试验
准备6份一次性使用注射器(带针)样品,分别采用乙醇水及生理盐水浸提制备检验液,检验液经处理后分别精密加入标准溶液0.5、1.0、2.0 mL,每种浓度制备3份。按上述方法测定DEHP含量。结果显示:乙醇水为浸提液,回收率在92%~98%(表1)、生理盐水为浸提液,回收率在90%~98%(表2),表明回收率情况良好。
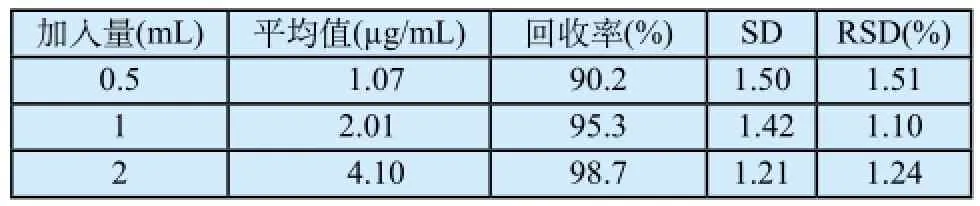
表2 生理盐水为浸提介质的回收率试验结果(n=3)Tab.2 The rec°very rate °f water as extracti°n medium test results
2.5样品测定
采用本方法对10批市售一次性使用注射器(带针)样品进行测试,实验中发现,注射器活塞的顶端(活塞—天然橡胶)有一层薄薄的油状物质,对此进行氯仿萃取分析,发现注射器活塞中有相当高的DEHP溶出量,采用生理盐水作为浸提液,则发现注射器活塞中DEHP溶出含量在0.82~1.67 μg/副,乙醇作为浸提介质溶出量在1.86~6.55 μg/副;注射器(带针)整个产品以生理盐水作为浸提介质DEHP溶出量在1.02~2.03 μg/副,乙醇作为浸提介质DEHP溶出量在1.99~7.24 μg/副。
2.6结论
根据DEHP微溶于水而易溶于三氯甲烷的性质,采用在浸提液中加入氯仿震荡5 min,离心分离,取氯仿层作为检验液的方法。该方法快速,简单,定性定量准确,定量下限低,特别适合注射器(DEHP含量较低)产品的分析。可做为一次性使用注射器样品中DEHP溶出量控制的方法之一。
通过实验发现,目前部分国内非聚氯乙烯材料的医疗器械产品注射器被检测出有DEHP溶出量,则可能是注射器组成部件活塞材料中添加DEHP导致。希望本次试验的发现能够引起相关企业及监管部门的重视。
[1] 李静莉, 杨婉娟, 郝擎, 等. 一次性使用无菌注射器上市后质量现状分析与思考[J]. 中国医疗器械杂志, 2012, 36(6): 441-443.
[2] 国家食品药品监督管理局. YY/T 0242—2007 医用输液, 输血,注射器具用聚丙烯专用料[S].
[3] 国家食品药品监督管理局. YY/T 0114—2008 医用输液, 输血,注射器具用聚乙烯专用料[S].
[4] 国家食品药品监督管理局. YY/T 0243—2003 一次性使用无菌注射器用活塞[S].
[5] 商务部对外贸易司. 一次性使用注射器出口质量控制指南[Z].中国医药保健品进出口商会, 2010.
[6] 于乐云, 王朦夏, 秦栎媛, 等. 邻苯二甲酸二异辛酯对雄性小鼠主要脏器及生殖功能的影响[J]. 新乡医学院学报, 2008, 25(5): 505.
[7] 陈琳, 钱青, 张吉吉, 等. 医疗途径中增塑剂DEHP的溶出及其安全性研究概况[J]. 中国药房, 2011, 22(33): 3073-3075.
[8] 国家食品药品监督管理局. YY/T 0927—2014 聚氯乙烯医疗器械中邻苯二甲酸二(2-乙基己基)酯(DEHP)溶出量测定指南[S].
Determination of Plasticizer DEHP Released from Medical Injection Equipment
【 Writers 】ZHENG Jian, WANG Minzhu, WANG Anyan, XU Pinghua, HAN Yin, WEN Yan, ZHANG Li Medical Device Supervising and Testing Center of Hangzhou, State Food and Drug Administration, Hangzhou, 310009
【 Abstract 】To established an effective GC-MS /MS method for the contents determination of the residual DEHP in injection equipment, and investigate the effect of the pretreatment on the measurement. To simulate the clinical conditions of use, under the condition of 37oC balance extraction, extract liquor by chloroform extraction, then the extract followed by analysis of GC-MS /MS. The method was simple, rapid, sensitive and accurate. The limits of quantitation( LOQ, S/N = 5) of cyclohexanone was 0.075 μg/mL, The spiked average recoveries ranged from 92% to 98%.The relative standard deviations( RSDs) of the method ranged from 1.01% to 1.61%, The method was simple, fast,sensitive and accurate,and may serve as a mass control method for residual DEHP in injection equipment.
injection equipment, gas chromatography tandem mass spectrometry, DEHP, plasticizer
X132
A
10.3969/j.issn.1671-7104.2015.06.017
1671-7104(2015)06-0451-03
2015-06-11
浙江省科技厅计划项目(2015F30009)
郑建,工程师,E-mail: fancyzl1@163.c°m
