完善医疗器械分类方法的建议
2015-11-28作者杨昕卓越
【作者】杨昕,卓越
上海市医疗器械检测所,上海市,201318
完善医疗器械分类方法的建议
【作者】杨昕,卓越
上海市医疗器械检测所,上海市,201318
该文介绍了美国FDA以及欧盟的医疗器械分类情况,并与中国的医疗器械分类现况进行了比较,分析了我国医疗器械分类现存的问题,并提出合理建议。
医疗器械; 分类方法
我国医疗器械产业进步飞速,医疗器械的品类越来越多。医疗器械分类目录的完善不仅能加强规范我国医疗器械的分类,利于政府监管,亦能提高医疗器械企业的产品注册效率。2002年发布的医疗器械分类目录随着时间的推移,逐渐难以满足产业发展的需求,无法界定医疗器械新产品。应生产企业的申请和技术审评的需求,只能以总局发文的形式进行分类界定,迄今发文界定的已有数十条之多,涵盖的产品种类亦达千余种。因此医疗器械分类目录亟待修订。
本文将国外和国内的医疗器械分类情况作了对比,并对我国医疗器械分类存在的问题加以分析并提出建议,希望能对新目录的修订提供帮助。
1 美国FDA和欧盟的医疗器械分类情况
1.1美国FDA的医疗器械分类规则、分类目录、运行机制及特点
美国食品药品监督管理局(简称FDA)根据医疗器械管理法规对医疗器械产品建立了两种分类模式:基于产品风险划分和基于医学专业用途划分。根据《美国联邦法典》第21编中860部分,FDA根据医疗器械的使用风险和可能产生的风险程度,将其分为三个管理类别,采取不同程度的控制措施。产品的风险类别不同,制造商向FDA申请获批上市的程序和提交资料将有所区别。医疗器械风险管理的三个等级为:Ⅰ类器械:该类器械只需经过一般监管就可确保其功效与安全性,如:拐杖、眼镜片等等;Ⅱ类器械:指单独依靠医疗器械的一般监管不足以确保其安全性和有效性,而需采取一些强制执行性能标准等特殊管理措施以提供相应保证的器械;Ⅲ类器械:主要指维持、支持生命或植入人体内的器械,该类器械对病人具有潜在危险,可能造成伤害或引发疾病。该类产品包括:心率调节器、婴儿保温箱、外科矫形植入物等。
FDA主要根据《美国联邦法典》第21编中862-892部分,对现有的1 700余种医疗器械产品进行分类,根据医疗器械临床医学领域划分了16个医疗器械子目录,见表1所示。每个子目录又分别列出了通用产品的名称、预期用途及管理类别,并同时结合穷举法列举了所有归属此目录的所有已上市产品的列表数据库[1]。
FDA为每个分类目录设置了对应每个专家小组,每个小组有一个该领域的专家和六位学者组成,小组在讨论某一医疗器械产品分类的过程中,允许不具投票权的消费者代表、行业及企业代表参与。FDA数据库通常每年更新一次。企业在申报全新产品时,企业和FDA需依照下列原则进行比对和拟定:① 有否相关法规现成的规定;② 器械预期用途;③ 器械应用的适应症;④ 器械的技术以及是否带来新的安全有效的风险。最终由FDA批准一个分类号给这个新产品(新的分类号或原有数据库中已有分类号)。对于新产品的新分类号,FDA数据库会定期进行更新。
FDA分类目录具有如下的特点和优势:① 基本已经覆盖美国现有的全部医疗器械品种;② 具有扩展性和延伸性,对新产品可自行拓展、随时增补,无需做大规模调整,定期更新(每年);③ 结合实际情况,对某些高风险的器械产品应通过风险分析的理念重新确定分类。④ 具有动态变化的产品的风险等级划分,产品风险等级将随科技的发展和技术的成熟而降低。
1.2欧盟的医疗器械分类规则、运行机制及优劣
欧盟的医疗器械分类管理不同于美国和中国,欧盟只给出分类规则,具体分类由企业负责,企业根据分类规则进行分类,由公告机构进行评估。根据这些年的运作来看,这种方式是适合欧盟的一套方法,因为根据分类规则,90%~95%的产品分类规则都能准确分类,I类,IIa和IIb即使是不准确分类,对企业和公告机构也没有产生很大影响,当然只有在III产品的分类出现争议时,由于技术要求不同,才会对企业和公告机构产生重大的影响。
欧盟医疗器械分类的优点为节约政府资源,不必要为分类专门成立部门。缺点则是不便于操作,企业和公告机构必须清楚分类规则,遇到分歧时需要权威部门参与[2-4]。
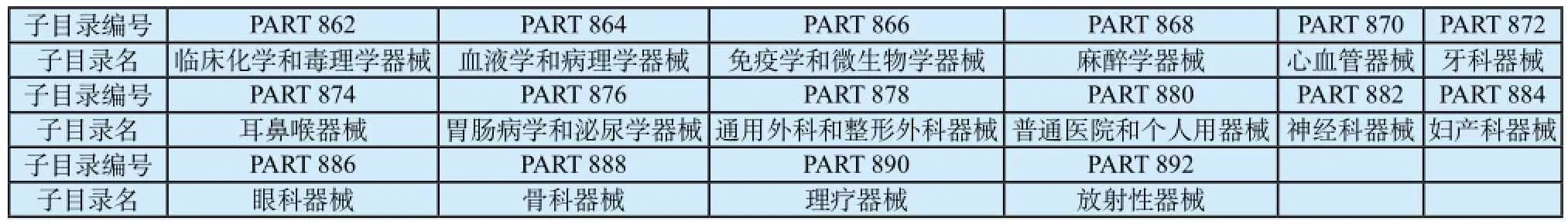
表1 美国FDA根据其临床医学领域划分为16个子目录Tab.1 16 subcatal°gs °f medical devices by FDA
2 我国医疗器械分类原则、分类目录、运行机制
我国医疗器械分类的方式与美国类似,按照风险等级亦分为三类,同样使用穷举法进行归属。第一类是指,通过常规管理足以保证其安全性、有效性的医疗器械。第二类是指,对其安全性、有效性应当加以控制的医疗器械。第三类是指,植入人体;用于支持、维持生命;对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械[5]。
我国现行的《医疗器械分类目录》于2002年发布,共有43个子目录,根据《医疗器械监督管理条例》及《医疗器械分类规则》制定[6],参照国际通行的分类,从严掌握。与美国类似,使用风险是制定产品分类目录的基础,但与美国不同,分类依据不仅限于按照临床医学领域划分,还包括医疗器械的技术特征等。
运行机制上,全国省级监管部门平行工作,依据《医疗器械分类目录》不能确定医疗器械分类时,由省级药品监督管理局根据分类规则进行预先分类,并报国家局核定[7]。
3 我国现行分类目录的缺点和问题
现行的分类方式在经过多年运行后暴露出了一些缺点和问题。
3.1目录划分原则相互交叉
由于我国医疗器械的类目划分原则同时采用临床领域和技术特征两种属性,例如:“6854手术室、急救室、诊疗室设备及器具”是按照临床领域划分的子目录,而“6823 医用超声仪器及有关设备”子目录则按照技术特征划分,这就有可能给执行者实际操作时带来困扰,难以准确定位。
3.2目录缺少对产品类别的描述定义
理论上,由于我国采用了穷举法,可以在执行中避免误划,而实际上,由于我国现有的分类目录仅有产品类别名称,无相关描述,而医疗器械命名又尚未标准化。简单的名称显然无法对医疗器械进行清晰定义和区分,从而导致在实际执行中很容易将功能类似的产品仅因为产品名称不同被划分至不同类别,或功能完全不同的产品因为名称相同而被误划至同一分类,甚至导致管理类别的高类低划、低类高划,也就是管理类别的误划的问题。例如:心排量测试仪,有两种工作机理,一种使用无创的方法,基于生物阻抗心动描计法,用于临床监测和显示成人心排出量;另一种使用有创的方法,通过采集有创血压测量和显示心排量。若目录无产品具体描述,则该类产品注册时容易产生II、III类不同高低的管理类别误划。
3.3分散管理,执行尺度难以统一
由于全国省级监管部门平行工作,在产品分类的判别上难免有判别尺度不统一的情况。虽然国家局会定期针对部分分类争议发布补充规定。然而由于发布方式为分散的发文形式,并不对现有分类目录进行修改。大量分散的文件也难以对分类工作起到统一指导的作用。
3.4现行分类目录对风险估计总体偏高
依据注册情况统计,我国的III类医疗器械约占全部医疗器械的22%,在美国,该比例仅为7%,详见表2。

表2 美国与中国各类医疗器械占比的对比Tab.2 C°mparis°n between the pr°p°rti°ns °f 3 categ°ries °f medical devices in US and China
4 建议
针对上述我国医疗器械分类存在的问题,本文提出以下建议。
4.1微调分类框架
虽然我国分类目录划分原则存在交叉重叠,但由于最终采取的是穷举法,可以有效避免由此产生的误划,因此并不建议对经多年使用已熟悉的分类目录框架进行大规模调整。仅按需新增部分新兴领域目录,合并部分成熟萎缩产业目录即可,以避免大规模调整目录框架带来的混乱。
4.2增加目录中对产品类别的具体描述
新的分类目录中应增加每个类别的具体描述,含临床预期用途及结构原理两栏。同时对每个分类单项以编号区分,或与通用名区分,避免不规范的命名造成混淆。这样就能提高医疗器械产品分类工作的准确性和效率,亦方便分类目录的使用者理解与查阅。
4.3成立分类工作中心专家组
建议成立分类工作中心专家组,为管理部门提供分类工作的技术支持,把握最终的产品分类,统一标准,以解决执行尺度不一的问题。并起草分类操作指南,作为专家组为执行部门提供的作业指导,统一分类的判别标准。集中培训,专家组定期对执行部门的反馈意见进行处理。此外,对于已分类产品亦可重新梳理,同时完善分类目录,专家组参与首次注册新产品的审核,直接给予准确分类。
4.4适时考虑降类
针对实践中已证明风险可控的产品,适时考虑降低其管理类别,使中国的医疗器械各个风险类别的比例更趋于合理,合理缩减企业的注册成本和政府的监管成本。
4.5建设分类目录数据库
建议设计建设分类目录数据库,并在网络上公开发布。以便查询分类目录的最新版本,保证信息畅通和分类目录的统一一致。
[1] http://www.fda.g°v/MedicalDevices.
[2] http://ec.eur°pa.eu/gr°wth/sect°rs/medical-devices.
[3] MEDICAL DEVICES: Guidance d°cument-Classificati°n °f medical devices, MEDDEV 3.4/Rev.9.
[4] COUNCIL DIRECTIVE 93/42/EEC, OJ L 169, 12.7.1993, p.1.
[5] 国家药品监督管理局. 医疗器械监管条例[ER/OL]. [2000-01-04]. http://www.sda.g°v.cn/WS01/CL0784/16570.html.
[6] 国家药品监督管理局. 医疗器械分类规则[ER/OL]. [2000-04-05]. http://www.sda.g°v.cn/WS01/CL0053/24454.html.
[7] 国家药品监督管理局. 医疗器械分类目录[ER/OL]. [2002-08-28]. http://www.sda.g°v.cn/WS01/CL0284/18027.html.
Advices on lmproving the Classification Method of Medical Devices
【 Writers 】YANG Xin, ZHUO Yue Shanghai Testing & Inspection Institute for Medical Devices, Shanghai, 201318
【 Abstract 】This article introduces the classifications of medical devices by FDA and EU and compares them with the situation in China. Towards the problems found, several reasonable advices are put forward.
medical devices, classification method
R197.39;F203
A
10.3969/j.issn.1671-7104.2015.06.016
1671-7104(2015)06-0449-02
2015-06-05
杨昕,E-mail: 13761693825@qq.c°m
