软骨细胞膜片复合3D打印内支撑构建管状软骨的初步研究
2015-11-28何晓敏徐志伟鲁亚南
葛 阳 韩 露 冯 蓓 白 洁 何晓敏 殷 猛 王 伟 徐志伟 付 炜 鲁亚南
软骨细胞膜片复合3D打印内支撑构建管状软骨的初步研究
葛 阳 韩 露 冯 蓓 白 洁 何晓敏 殷 猛 王 伟 徐志伟 付 炜 鲁亚南
目的利用猪耳廓软骨细胞制备软骨细胞膜片,与3D打印聚酰胺带孔管状支架结合,构建管状软骨组织,用于气管软骨的缺损重建。方法用酶消化法分离获得原代猪耳廓软骨细胞,以5×105cells/mL的密度将第2代软骨细胞接种于6 cm细胞培养皿上,在软骨细胞膜片培养环境中培养约14 d,获得完整软骨细胞膜片;4层软骨细胞膜片依次卷叠于3D打印的聚酰胺(PA12)带孔管状内支架上,以构建管状软骨组织复合物;体外静态培养12周或裸鼠皮下培养8周,对形成的管状软骨组织行大体观察及石蜡切片组织学染色鉴定。结果体外静态培养12周后,半透明管状软骨组织形成,组织学染色可见少量分泌的软骨细胞外基质,质软,弹性差;体内培养8周后,白色管状软骨组织形成,其组织学染色可见大量软骨细胞外基质分泌,质较硬,有一定弹性。结论利用软骨细胞膜片复合3D打印聚酰胺支架,可构建组织工程管状软骨,有望将其用于气管软骨缺损的修复。
细胞膜片技术软骨细胞膜片3D打印支架管状软骨
目前,针对未达到严重狭窄及缺损程度的病例,即成人气管狭窄或缺损长度<6 cm,儿童气管狭窄或缺损长度<1/3总气管长度的,临床上多采用狭窄及缺损切除后端端吻合的治疗方式;而对于狭窄或缺损长度超过6 cm(或1/3总气管长度)的,此种治疗方式显现出极大的弊端与不足[1]。组织工程技术利用细胞自身生长特性以重建相应组织,为严重气管狭窄和缺损的修复带来了希望与可能[2-3]。
目前,利用组织工程方法构建软骨用于气管修复的研究,主要包括利用种子细胞、组织工程支架及各种诱导方式三要素在内的经典组织工程构建方法,以及不依赖于支架的细胞膜片技术[4-8],后者的最大优点就是避免了因支架降解引起的炎症反应。3D打印技术具有成型快速、精细度高等特点受到生物医学领域的关注[9-10]。考虑到个体之间存在的差异,3D技术结合现有的医学影像成型技术将会更加适用于未来医学的个体化治疗理念。因此,本研究尝试利用细胞膜片技术结合3D打印技术,以构建组织工程管状软骨,并用于气管软骨修复的可行性。
1 材料与方法
1.1 实验动物与试剂
实验动物包括健康新生猪2只,约1周龄,体质量约2 Kg(上海交通大学农学院)。8周龄雄性裸鼠10只,体质量约20 g(上海斯莱克公司)。
H-DMEM培养液(HyClon公司),青霉素、链霉素(HyClone公司),FBS(BioInd公司),胶原酶(SERVA公司),0.25%胰蛋白酶-EDTA(Gibco公司),PBS(HyClone公司),mouse-anti-humanⅡ型胶原IgG单克隆抗体(Abcam公司),FITC标记的donkey-anti-mouse IgG荧光二抗(life technologies公司),4',6-二脒基-2-苯基吲哚(Enzo公司),抗坏血酸(Sigma公司),非必需氨基酸(Gibco公司),L-proline(Sigma公司)。
细胞培养箱(Thermo公司);DM300荧光倒置显微镜(Leica公司)。
1.2 猪耳廓软骨细胞的分离与原代培养
1.2.1 软骨细胞的分离与培养
新生猪2只麻醉后取耳廓组织,去除皮肤及表面血管等,以含抗生素的生理盐水与PBS分别漂洗3次,置于0.25%胰蛋白酶溶液中,37℃预消化25~30 min,去除表面残留组织,PBS漂洗,剪碎至1~2 mm3大小,加入0.075%胶原酶,37℃摇床震荡消化过夜。单细胞滤器过滤,1 500 r/min离心,获得原代软骨细胞。PBS漂洗,重悬于含有1%抗生素、10%血清的H-DMEM完全培养基,以2.5×104cells/cm2密度接种于细胞培养皿中。置于37℃、湿度95%、5%CO2的细胞培养箱中培养4~5 d,当软骨细胞增殖达80%~90%融合时,0.25%胰蛋白酶消化传代。
1.2.2 软骨细胞的鉴定
取少量第2代软骨细胞以2×105个/孔的密度接种于24孔板。待软骨细胞生长至80%融合时,进行软骨细胞的鉴定。PBS漂洗3次,4%多聚甲醛固定30 min;PBS漂洗3次,0.5%Triton X-100破膜30 min;PBS漂洗3次,10%山羊血清封闭,37℃孵育30 min;弃去封闭液,加入mouse-anti-human单克隆抗体,4℃孵育过夜;PBS漂洗3次,加入FITC标记的donkey-anti-mouse荧光二抗,37℃避光孵育30 min;PBS漂洗后加入新鲜配置的DAPI衬染细胞核30 sec,PBS漂洗,置于荧光显微镜下观察。
1.3 软骨细胞膜片的制备与获得
取第2代软骨细胞,以5×105cells/cm2密度接种于6 cm细胞培养皿中,以H-DMEM培养液(含10%FBS,1%青霉素、链霉素,50 μg/mL抗坏血酸,40 μg/mL L-proline,0.1 mmol/L非必需氨基酸)体外培养,隔天换液。约14 d后,将完整的软骨细胞膜片从培养皿底揭下。
1.43 D打印聚酰胺支架
利用3D打印技术中的选择性激光烧结技术,打印聚酰胺带孔管状支架,内径6 mm,外径8 mm,管壁设计为多孔结构,以利于营养物质的渗透。高温高压消毒后备用(图1A)。
1.5 管状软骨样组织构建
1.5.1 软骨细胞膜片复合3D打印聚酰胺支架体外构建管状软骨样组织
将3D打印聚酰胺带孔管状支架置于H-DMEM培养液中预先浸润,将完整的软骨细胞膜片4张,依次卷叠于支架上(图1B)。

图1 3D打印支架与管状软骨样组织的构建Fig.13D printed supporter and construction of tubulous cartilage-like tissue
1.5.2 体外培养获得管状软骨
将4层软骨细胞膜片复合3D打印支架的复合体,置于含H-DMEM培养液的离心管中,37℃,5% CO2细胞培养箱中静态培养12周,隔日半量换液。
1.5.3 体内培养获得管状软骨
体外培养1周后,将部分复合体移植至裸鼠背部皮下,培养8周。
1.6 管状软骨的组织学鉴定
体外静态培养12周时,取出管状软骨组织复合体中的聚酰胺内支架,对形成的管状软骨组织行大体观及组织学观察。
体内培养至8周,颈椎脱臼法处死裸鼠,背部正中剪开皮肤后,剥离管状软骨组织复合体,抽出3D打印聚酰胺内支架,对形成的管状软骨组织行大体观察与组织学鉴定(HE染色、甲苯胺蓝染色、番红O-固绿染色和Ⅱ型胶原免疫组化染色)。
2 结果
2.1 软骨细胞的形态及鉴定
原代软骨细胞培养24 h,可见软骨细胞已铺展于培养皿底,呈多角形。第2代软骨细胞接种于24孔板后,Ⅱ型胶原免疫荧光染色约60%呈强阳性(图2)。

图1 猪耳廓软骨细胞的形态及鉴定Fig.1Morphology and identification of porcine auricular cartilage derived chondrocytes
2.2 软骨细胞膜片镜下观察
第2代软骨细胞接种第1天,镜下观察可见高密度接种后的软骨细胞贴壁良好,排列紧密(图3A);培养至第14天,软骨细胞呈高度紧密的排列方式,细胞间紧密相连(图3B)。已成膜的软骨细胞膜片可从培养皿底揭下(图3C)。

图3 软骨细胞膜片的制备与获得(标尺=100 μm)Fig.3The preparation and acquisition of chondrocyte sheets(Bar:100 μm)
2.3 管状软骨的大体观及组织学检测结果
2.3.1 体外静态培养管状软骨的大体观与组织学检测
体外静态培养12周后,抽出内支撑支架,半透明管状软骨组织形成,外表面光滑,具有一定的韧性和弹性,但弹性较弱,不足以维持规则的环状结构(图4A-C);组织学发现,有软骨陷窝形成,且软骨细胞分泌了少量细胞外基质(图4D-K)。
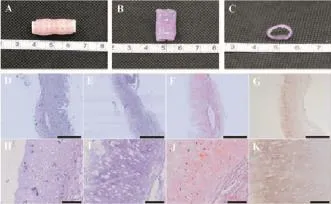
图4 体外静态培养12周后管状软骨大体观及组织学鉴定Fig.4Gross view and histological identification of tubulous cartilage tissue after 12 weeks'culture in vitro
2.3.2 体内培养管状软骨的大体观与组织学检测
裸鼠体内培养8周后,形成具有一定厚度的管状软骨组织,色白,但外表面不平整(图5A-C);因体内培养的大体标本硬度较强,且有软骨长入内支撑支架孔隙内,抽出后软骨即有破坏,因此将管状软骨自中间剖开、剥离并施以外力后仍可维持卷曲状态(图5C);组织学可见有大量软骨陷窝存在,且分泌了大量的细胞外基质(图5D-K)。
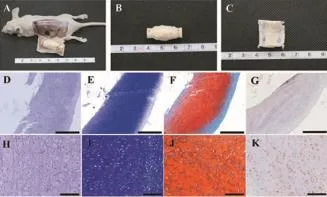
图5 体内培养8周后管状软骨大体观及组织学鉴定Fig.5Gross view and histological identification of tubulous cartilage tissue after 8 weeks'culture in vivo
3 讨论
目前,对于气管狭窄及气管缺损的治疗,仍是以端端吻合的手术方式为主。同种异体气管移植和自体软骨移植曾被认为是治疗长段狭窄及缺损的有效方式,但免疫排斥和供体不足等限制了其推广和应用[1,11-12]。组织工程技术通过体外扩增方式,获得充足的用于组织构建的种子细胞,种植于生物相容性好且可降解的材料支架上,随着支架的降解,细胞分泌基质并逐渐取代支架材料,最终构建出相应的组织,用于组织器官的修复和再造[2,10]。但是这种经典的组织工程构建方法也存在着一定的缺陷,其中支架材料降解引起的炎症反应,是限制其在大动物体内,以及未来临床应用的最主要因素[13-14]。
细胞膜片技术的出现,为组织构建提供了一种不依赖于生物材料支架,同时又能避免细胞损失的新的构建方式[15-16]。这种技术在组织工程组织构建中的研究应用已涵盖了心肌组织、角膜上皮、食管上皮等[17-19]。本实验中,我们采用细胞膜片技术来构建气管软骨,发现依赖细胞膜片间细胞的吸附作用,将多层软骨细胞膜片通过卷叠的方式来构建管状软骨是可行的;此外,本实验还采用了3D打印聚酰胺支架作为内支撑。不同于以往实验所用的硅胶管内支撑,这种基于3D打印的支架制备更加高效,且其最大的优点是能够达到个体化治疗目的,更加适应未来医学的需要。聚酰胺材料,广泛应用于多个领域,其纤维丝在血液透析方面的应用提示聚酰胺这种材料具有良好的组织相容性,为本实验3D支架材料的选择提供了参考[20]。组织学鉴定结果显示,以软骨细胞膜片形式生长的软骨细胞经过12周的体外培养,依然可以维持足够的软骨表型并形成具有一定力学性能的软骨组织;通过进一步裸鼠皮下培养,我们构建出了较为满意的管状软骨组织,同时组织学观察到大量Ⅱ型胶原、硫酸软骨素等软骨基质的分泌,且组织周围未见明显的炎细胞浸润,提示这种聚酰胺的3D支架具有较好的组织相容性,并且利用这种支架与软骨细胞膜片复合,可构建具有一定力学支撑性能的管状软骨。
[1]Fishman JM,Wiles K,Lowdell MW,et al.Airway tissue engineering: an update[J].Expert Opin Biol Ther,2014,14(10):1477-1491.
[2]Vacanti JP.Beyond transplantation.Third annual Samuel Jason Mixter lecture[J].Arch Surg,1988,123(5):545-549.
[3]Kojima K,Vacanti CA.Tissue engineering in the trachea[J]. Anatomical record,2014,297(1):44-50.
[4]Hong HJ,Chang JW,Park JK,et al.Tracheal reconstruction using chondrocytes seeded on a poly(L-lactic-co-glycolic acid)-fibrin/ hyaluronan[J].J Biomed Mater Res A,2014,102(11):4142-4150.
[5]Zhang JR,Chen FL,Wu W,et al.Constructing tissue engineered trachea-like cartilage graft in vitro by using bone marrow stromal cells sheet and PLGA internal support:experimental study in bioreactor[J].Zhonghua Zheng Xing Wai Ke Za Zhi,2009,25(2): 124-128.
[6]Yamada N,Okano T,Sakai H,et al.Thermo-responsive polymeric surfaces;control of attachment and detachment of cultured cells [J].Makromol Chem Rapid Commun,1990,11(11):571-576.
[7]Elloumi-Hannachi I,Yamato M,Okano T.Cell sheet engineering: a unique nanotechnology for scaffold-free tissue reconstruction with clinical applications in regenerative medicine[J].J Int Med, 2010,267(1):54-70.
[8]Tani G,Usui N,Kamiyama M,et al.In vitro construction of scaffoldfree cylindrical cartilage using cell sheet-based tissue engineering [J].Pediatr Surg Int,2010,26(2):179-185.
[9]Mosadegh B,Xiong G,Dunham S,et al.Current progress in 3D printing for cardiovascular tissue engineering[J].Biomed Mater, 2015,10(3):034002.
[10]Crowley C,Birchall M,Seifalian AM.Trachea transplantation: from laboratory to patient[J].J Tissue Eng Regen Med,2015,9(4): 357-367.
[11]Xue B,Liang B,Wang S,et al.One-stage surgical correction of congenital tracheal stenosis complicated with congenital heart disease in infants and young children[J].J Card Surg,2015,30(1): 97-103.
[12]Jacobs JP,Elliott MJ,Haw MP,et al.Pediatric tracheal homograft reconstruction:a novel approach to complex tracheal stenoses in children[J].J Thorac Cardiovasc Surg,1996,112(6):1549-1558.
[13]Xue J,Feng B,Zheng R,et al.Engineering ear-shaped cartilage using electrospun fibrous membranes of gelatin/polycaprolactone [J].Biomaterials,2013,34(11):2624-2631.
[14]Zheng R,Duan H,Xue J,et al.The influence of Gelatin/PCL ratio and 3-D construct shape of electrospun membranes on cartilage regeneration[J].Biomaterials,2014,35(1):152-164.[15]Chang JW,Park SA,Park JK,et al.Tissue-engineered tracheal reconstruction using three-dimensionally printed artificial tracheal graft:preliminary report[J].Artif Organs,2014,38(6):E95-E105.
[16]Matsuura K,Utoh R,Nagase K,et al.Cell sheet approach for tissue engineering and regenerative medicine[J].J Control Release, 2014,190:228-239.
[17]Tano N,Narita T,Kaneko M,et al.Epicardial placement of mesenchymal stromal cell-sheets for the treatment of ischemic cardiomyopathy;in vivo proof-of-concept study[J].Mol Ther, 2014,22(10):1864-1871.
[18]Gomes JA,Geraldes Monteiro B,Melo GB,et al.Corneal reconstruction with tissue-engineered cell sheets composed of human immature dental pulp stem cells[J].Invest Ophthalmol Vis Sci,2010,51(3):1408-1414.
[19]Kanai N,Yamato M,Okano T.Cell sheets engineering for esophageal regenerative medicine[J].Ann Transl Med,2014,2(3):28.
[20]Panichi V,Bianchi AM,Andreini B,et al.Biocompatibility evaluation of polyamide hemofiltration[J].Int J Artif Organs, 1998,21(7):408-413.
Construction of Tubulous Cartilage with Chondrocyte-sheets and 3D Printed Supporter
GE Yang1,HAN Lu1,2,FENG Bei1,2,BAI Jie1,HE Xiaomin1,YIN Meng1,WANG Wei1,XU Zhiwei1,FU Wei1,2,LU Yanan1.
1 Department of Pediatric Cardiothoracic Surgery,Shanghai Children's Medical Center,Shanghai Jiaotong University School of Medicine,Shanghai 200127,China;
2 Institute of Pediatric Translational Medicine,Shanghai Children's Medical Center,Shanghai Jiaotong University School of Medicine,Shanghai 200127,China.Corresponding authors:FU Wei(E-mail:fuweizhulu@163.com),LU Yanan(E-mail:luscmc@163.com).
ObjectiveTo construct tubulous cartilage by porcine auricular cartilage-derived chondrocyte-sheets combing with 3D printed supporter for repairing tracheal cartilage defects.MethodsPrimary chondrocytes were isolated from porcine auricular cartilage with methods of trypsin enzyme digestion and collagenase enzyme digestion.After proliferation in vitro,the chondrocytes of passage 2 were seeded on culture dish with a high density of 5×105cells/mL,and intact chondrocyte-sheets were detached after cultured in a specific cell sheet culture environment for 14 days in vitro.Four detached chondrocytesheets were rolled onto a 3D printed supporter of PA material one by one to construct a tubulous cartilage-like complex. Twelve weeks’static culture in vitro as well as 8 weeks'subcutaneous culture in nude mouse were performed.Gross inspection and paraffin section staining were applied for evaluation.ResultsBoth in-vitro and in-vivo culture contributed to formation of tubulous cartilage with specific mechanical property.The cartilage extracellular matrix secretion and mechanical property of tissue engineered tubulous cartilage tissue cultured in vivo were better than that cultured in vitro. ConclusionIt is feasible to construct tissue engineered tubulous cartilage tissue by chondrocyte-sheets and 3D printed PA supporter for tracheal cartilage repair.
Cell sheet technology;Chondrocyte sheets;3D printed supporter;Tubulous cartilage tissue
Q813.1+2
A
1673-0364(2015)04-0225-05
10.3969/j.issn.1673-0364.2015.04.002
2015年4月23日;
2015年6月5日)
国家自然科学基金(31200735,81370117);上海市自然科学基金-青年项目(12ZR1446500);上海市浦东新区科技发展基金(PKJ2012-Y48);上海交通大学医工交叉项目(YG2012MS36,YG2012MS35);上海卫生和计划生育委员会(20144Y0166);上海高校选拔培养优秀青年教师基金(ZZjdyx1211)。
200127上海市上海交通大学医学院附属上海儿童医学中心心胸外科(葛阳,韩露,冯蓓,白洁,何晓敏,殷猛,王伟,徐志伟,付炜,鲁亚南);200127上海市上海交通大学医学眼附属上海儿童医学中心儿科转化医学研究所(韩露,冯蓓,付炜)。
付炜(E-mail:fuweizhulu@163.com),鲁亚南(E-mail:luscmc@163.com)。
