无金属参与的CO2催化转化的研究进展
2015-11-27王彦波宋开放楚明超赵宇飞陈丹云
王彦波,宋开放,楚明超,赵宇飞,陈丹云
(1.河南大学 化学化工学院,河南 开封 475004;2.河南省科学技术信息研究院,河南 郑州 450003)
由于人类社会活动造成煤、石油和天然气等化石燃料的大量燃烧,导致CO2的排放量急剧上升,严重破坏了CO2在大气圈和生物圈的原有平衡.CO2作为主要的温室气体,其含量的不断增加将会引起全球气候的变化,严重地威胁着人类的生存环境,因此CO2的资源化利用已成为全球备受关注的研究课题之一[1-6].由于CO2是地球上重要的碳资源,具有无毒、廉价易得和储量丰富等众多优点,若能通过化学方法将CO2转化为高附加值的有机化学品将是CO2资源化利用的重要途径.目前尽管金属催化剂在CO2催化转化方面得到了广泛的应用,然而金属催化剂普遍存在价格昂贵、稳定性较差以及在一些重要行业如食品添加剂、医药等存在金属(特别是重金属)残留等问题,极大地限制了其应用与发展;而使用有机小分子催化体系进行CO2催化转化可以避免以上问题,因此无金属参与的有机小分子催化体系在CO2催化转化的研究越来越受到广泛的关注.
本文作者依据CO2催化转化所涉及到的反应类型以及得到产物的不同,从制备五元环状碳酸酯、噁唑啉酮以及CO2还原等几个方面对近年来CO2有机催化转化方面的研究进行了简要综述,并对相关研究中出现的问题进行了讨论.
1 制备五元环状碳酸酯
1.1 与环氧烷烃的环加成反应
五元环状碳酸酯被广泛用于印染、纺织、聚合物合成和电化学等方面,同时在精细化工中间体的合成中也具有重要作用[7].通过CO2与环氧烷烃的反应是制备五元环状碳酸酯最有效的方法之一,常见的有机催化剂主要包括有机胺催化剂[8-9]、离子液体催化剂[10-16]、氮杂环卡宾催化剂[17-19]和酚氧甜菜碱催化剂[20]等.
1.1.1 有机胺催化剂
SARTORIA等[8]在2002年 报 道 了7-甲 基-1,5,7-三氮杂二环[4.4.0]癸-5-烯(MTBD)催化CO2与环氧烷烃的环加成反应(图1),用于合成相应的环状碳酸酯.研究结果表明,端位环氧烷烃的催化活性要明显高于内环氧烷烃的.然而,尽管不同的环氧烷烃能顺利实现该催化反应,但是反应条件苛刻,转化率较低.随后,施敏等[9]报道了4-二甲氨基吡啶、吡啶和三乙胺等有机碱用于催化CO2制备环状碳酸酯,他们发现加入苯酚后可明显提高催化活性.
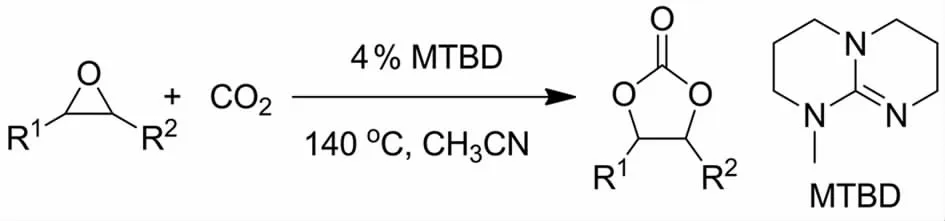
图1 MTBD催化环氧烷烃与CO2的反应Fig.1 Reaction of CO2with epoxides catalyzed by MTBD
1.1.2 离子液体催化剂
离子液体作为一种绿色溶剂,具有较好的热稳定性、蒸汽压可忽略、难以挥发和不易燃烧等众多优点,因此被广泛应用于有机催化转化的研究[21],在CO2催化转化合成五元环状碳酸酯方面也得到了较多应用.邓友全等[10]在2001年首次使用离子液体[BMIM]BF4作为溶剂和催化剂催化转化CO2合成五元环状碳酸酯(图2).使用[BMIM]BF4作为催化剂,当CO2压力为2.5MPa时,在110℃下反应6 h,产率高达100%.研究发现,该离子液体重复使用5次后反应活性略有所降低.随后,2002年CALÓ等[11]报道了当CO2压力为0.1MPa时四丁基溴化铵在无溶剂下催化转化CO2合成环状碳酸酯.基于以上离子液体对CO2催化转化的研究,不同课题组相继开发了一些功能化和载体负载化的离子液体催化剂[12-16].
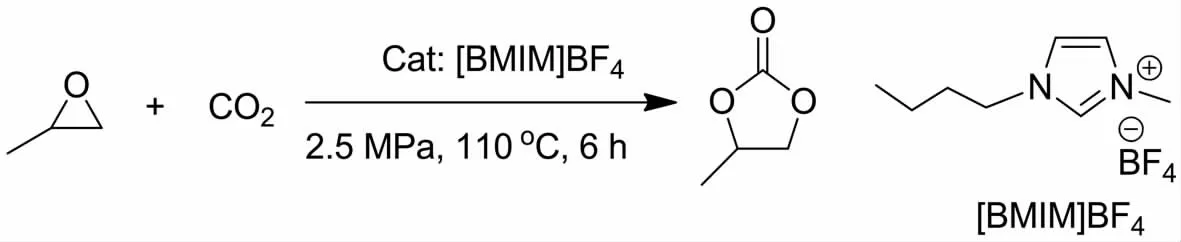
图2 离子液体[BMIM]BF4催化环氧烷烃与CO2环加成反应Fig.2 Cycloaddition reaction of CO2with epoxides catalyzed by ionic liquids[BMIM]BF4
1.1.3 氮杂环卡宾催化剂
氮杂环卡宾由于拥有较高的稳定性和较强的供电性,其作为优良的配体被广泛用于金属有机配合物的合成,同时其作为有机催化剂还可以有效地催化多种有机反应[22].吕小兵等[17]在2008年报道了氮杂环卡宾CO2加合物(NHCs-CO2加合物)可以高效地催化CO2与环氧烷烃反应制备环状碳酸酯,反应的选择性高达100%.在研究不同结构的NHCs-CO2加合物对催化活性的影响时发现,热稳定性差和脂溶性好的IPr-CO2加合物2的催化活性最高.当使用0.5%(物质的量分数,下同)催化剂2,CO2压力为2MPa,在120℃反应24h时,不同的端位环氧烷烃均能较好实现该催化反应(图3).在此基础上,该课题组[18-19]相继设计与合成了基于高分子链和介孔材料MCM-41为载体的氮杂环卡宾功能化CO2吸附材料.实验结果表明,这些材料均能实现在低温捕获CO2和高温释放CO2这一可逆过程;同时以上材料均可作为催化剂用于CO2催化转化,并且较好地实现了催化剂的循环使用.
1.1.4 酚氧甜菜碱催化剂
SAKAI等[20]于2010年设计并合成酚氧类甜菜碱两性离子化合物,该类甜菜碱可以有效地催化环氧烷烃与CO2反应制备环状碳酸酯(图4).作者研究发现,甜菜碱化合物中阴阳离子的距离与其周围取代基的位阻对催化活性有直接的影响.当阴阳离子都处于苯环邻位时,小位阻催化剂6活性比大位阻催化剂7或8高;当具有相似的阴阳离子催化剂,邻位取代催化剂6活性比间位或对位取代的催化剂9或10低.基于此考虑,作者尝试通过两种方式来增加阴阳离子的距离以提高催化活性:一种是制备阴阳离子处于苯环的间与对位的催化剂9和10;另一种则设计合成具有联苯或联萘桥连的催化剂11、12和13.结果显示,与催化剂6相比,它们的催化活性均有所提高.此外作者还发现,与酚氧甜菜碱9和10相比,相似结构的离子对化合物14具有较低的催化活性,这可能是由于离子对结合太紧密,显著降低酚氧负离子的亲核性所致.
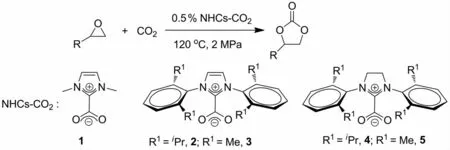
图3 NHCs-CO2加合物催化环氧烷烃与CO2的环加成反应Fig.3 Cycloaddition reaction of epoxides with CO2catalyzed by NHCs-CO2adducts
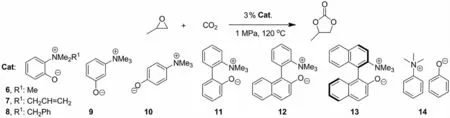
图4 酚氧甜菜碱固定CO2Fig.4 Fixation of CO2by phenoxy betaines
1.2 与炔醇的羧环化反应
α-亚烷基五元环状碳酸酯作为重要的合成中间体被广泛应用在聚合物材料合成及有机合成等领域,所以该类化合物的合成具有十分重要的意义[23].而通过丙炔醇与CO2的羧环化反应的方法来制备α-亚烷基五元环状碳酸酯是一条有效途径,因为该方法完全符合原子经济型的要求.目前,使用该方法催化转化CO2取得了较大的进展,有机膦[24-27]、有机胍类[28]、氮杂环卡宾[29-30]、氮杂环烯[31]和烷氧甜菜碱[32]等有机小分子相继被报道用以催化CO2合成α-亚烷基五元环状碳酸酯.其中,有机膦和有机胍催化剂需在超临界CO2条件下实现该羧环化反应,反应条件相对比较苛刻,在此我们主要讨论后3种催化体系的研究工作.
1.2.1 氮杂环卡宾催化剂
IKARIYA等[29]在2009年报道了NHCs-CO2加合物在无溶剂和温和的反应条件下催化丙炔醇与CO2的羧环化反应.结果表明,NHCs-CO2加合物的结构对催化反应有着较大的影响,当咪唑环氮原子上连有芳香基取代的iPr-CO2加合物2时几乎没有活性,而叔丁基取代的NHC-CO2加合物17催化活性最高.在最佳的反应条件下(使用5%加合物17作为催化剂,CO2压力为4.5MPa,反应温度为60℃)底物炔醇均能高选择性以及高产率得到Z构型的α-亚烷基五元环状碳酸酯(图5).
1.2.2 氮杂环烯催化剂
氮杂环烯由于具有较强的供电性和亲核性,通常被用来作为供电配体和亲核试剂,以此作为催化剂的研究报道还比较少[33].吕小兵等[31]于2013年设计并制备了一系列氮杂环烯CO2加合物(NHOs-CO2加合物),研究发现该加合物可以高选择性和高产率催化CO2与丙炔醇的羧环化反应,制备Z-构型α-亚烷基环状碳酸酯(图6).这一催化体系是目前报道的有机小分子催化该羧环化反应活性最高的体系.值得注意的是,对于内炔醇底物苯环上连有吸电子基团如三氟甲基,乙酰基可以在常温下高产率得到相应的环状碳酸酯.通过简单的动力学研究发现,结构类似的NHOs-CO2加合物的催化活性要远远高于相应的NHCs-CO2加合物的,这可能是由于NHOs-CO2加合物热稳定性较差所致,这一推测通过原位红外实验和相应的单晶数据得以验证.此外,通过对底物炔醇和催化剂进行同位素标记实验,作者对该反应的机理进行了详细研究.
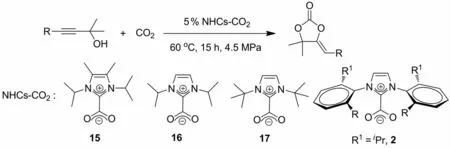
图5 NHCs-CO2加合物催化炔醇与CO2羧环化反应Fig 5 Carboxylative cyclization of propargyl alcohols with CO2catalyzed by NHCs-CO2adducts
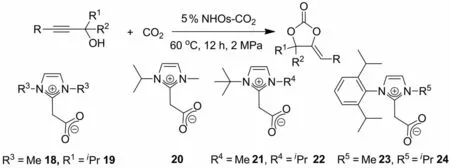
图6 NHOs-CO2加合物催化丙炔醇与CO2羧环化反应Fig.6 Carboxylative cyclization of propargyl alcohols with CO2catalyzed by NHOs-CO2adducts
1.2.3 烷氧功能化甜菜碱催化剂
基于酚氧功能化甜菜碱的设计以及甜菜碱类化合物在催化反应的优势,吕小兵等[32]成功设计并合成了烷氧功能化甜菜碱化合物(AFIBs).该类甜菜碱可以快速实现对CO2的活化与固定,得到相应的AFIBs-CO2加合物.实验结果表明,该加合物可以在温和条件下高效地催化端炔醇底物,而对于内炔醇则表现出较低的催化活性(图7).
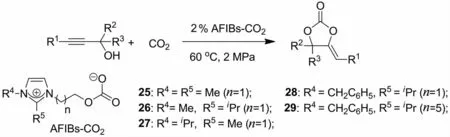
图7 AFIBs-CO2催化丙炔醇与CO2的羧环化反应Fig.7 Carboxylative cyclization of propargylic alcohols with CO2catalyzed by AFIBs-CO2
2 制备噁唑啉酮
噁唑啉酮作为重要的五元杂环化合物,广泛应用于医药与有机合成等领域[34].目前合成噁唑啉酮最有效的方法之一就是通过CO2与氮杂环丙烷的反应来实现.何良年等[35]在2010年应用离子液体作为催化剂在无溶剂下催化CO2与氮杂环丙烷环加成反应制备5-芳基-2-噁唑啉酮(图8).该反应使用的离子液体由简单原料DABCO经过季铵化制得,具有合成方法简便,产物能稳定存在于空气和水中,以及在反应结束后易于回收循环利用等优点.在此基础上,功能化和聚合物负载化的离子液体催化剂相继被设计与合成出来[36-37].
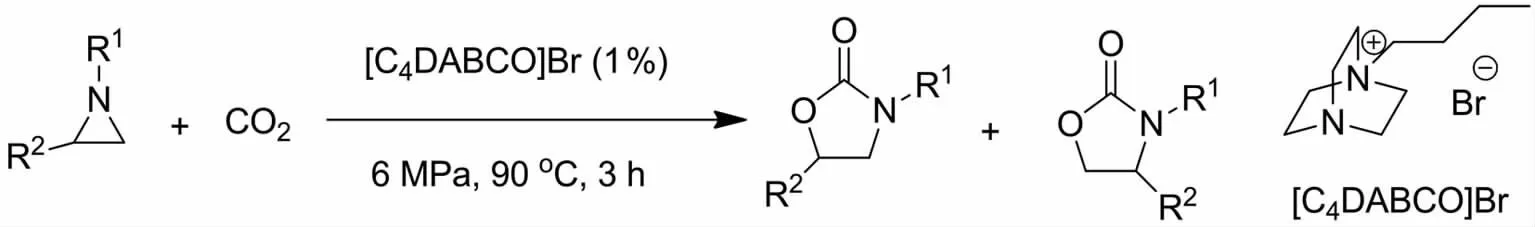
图8 离子液体[C4DABCO]Br氮杂环丙烷与CO2合成噁唑啉酮Fig.8 Synthesis of 2-oxazolidinones from aziridines and CO2catalyzed by[C4DABCO]Br
刘国生等[38]于2011年报道了DBN在添加剂KI作用下有效地催化CO2与氮杂环丙烷制备噁唑啉酮类化合物(图9).研究结果表明,在无催化剂DBN时反应比较缓慢;只有当加入少量的DBN反应才能顺利进行.
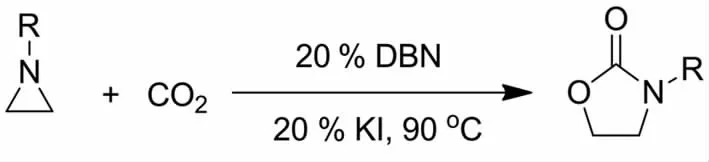
图9 DBN催化CO2与氮杂环丙烷的环加成合成噁唑啉酮Fig.9 Fixation of CO2to aziridine for the synthesis of 2-oxazolidinone catalyzed by DBN
SEAYAD等[39]在2012年报道了NHCs-CO2加合物催化反应活性较差的N-对甲苯磺酰基氮杂环丙烷与CO2环加成制备相应的噁唑啉酮.研究发现,当底物氮杂环丙烷的2位连有取代基时,CO2将高选择性插入氮原子与连有取代基的碳原子之间(图10).此外,当作者使用具有光学活性的氮杂环丙烷时得到构型保持的产物.基于此,他们推测反应过程可能经历两次手性碳的翻转.随后IKARIYA等[40]在2013也报道了NHCs-CO2加合物在无溶剂条件下有效地催化CO2与氮杂环丙烷反应合成噁唑啉酮.值得注意的是,向反应体系中加入乙醚可以将催化剂沉淀分离出来,从而实现了催化剂的循环利用,催化剂重复使用5次后催化活性没有明显的降低.
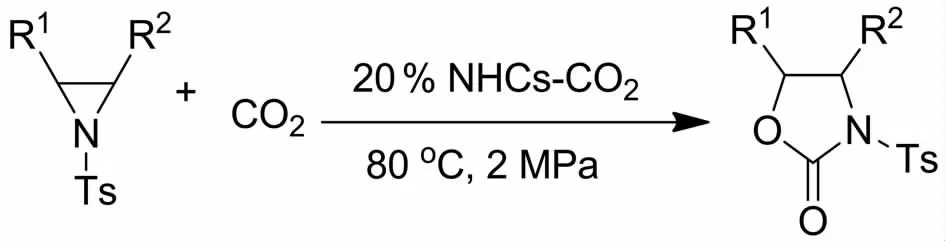
图10 NHCs-CO2加合物催化氮杂环丙烷与CO2的环加成Fig.10 Cycloaddition reaction of aziridines with CO2catalyzed by NHCs-CO2adducts
3 CO2还原
CO2具有高度的热力学稳定性,通过化学方法将其还原通常需要较为苛刻的条件或使用金属催化剂;而无金属催化体系在温和的反应条件下实现该转化仍然是一个具有挑战性的课题.2009年,ZHANG等[41]报道了氮杂环卡宾在室温条件下催化CO2的氢硅化反应制备甲醇(图11).在氮杂环卡宾催化下,CO2在3倍量硅氢试剂作用下经过多步反应获得硅甲醚与二硅醚,硅甲醚进一步在碱性条件下水解而制备重要的化工原料甲醇.与之前报道的过渡金属催化剂相比,氮杂环卡宾体系具有无毒、稳定和活性高等优点.此外,该反应对空气中的O2不敏感,所以CO2还原合成甲醇可以在干燥空气中进行.
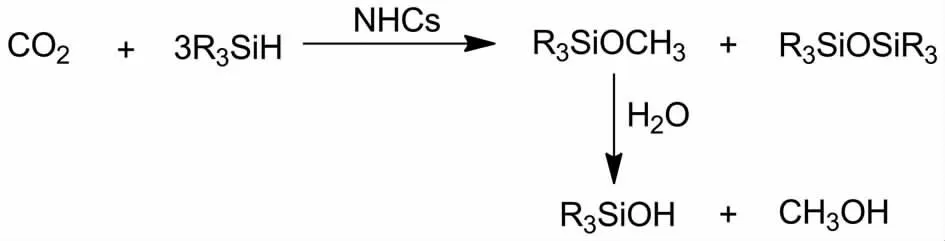
图11 NHCs催化CO2的硅氢化合成甲醇Fig.11 Hydrosilylation of CO2to methanol catalyzed by NHCs
最近STEPHAN等开发了一类受阻的路易斯酸碱对体系,即“frustrated Lewis pairs(FLPs)”[42],成功用于多种小分子的活化与固定,其中该体系在催化CO2还原制备甲醇和甲烷方面的研究也取得了一定进展.ASHLEY等[43]报道了B(C6F5)3和2,2,6,6-四甲基哌啶TMP形成的FLPs在还原剂H2存在下与CO2反应得到多种反应中间体.作者通过质谱检测发现,在160℃反应6d后甲醇的产率只有24%(图12,a).尽管这一催化体系表现出较低的催化活性,然而该转化的实现开启了FLPs体系对CO2还原的研究.在此基础上,2010年PIERS等[44]报道了使用相同的FLPs体系以三乙基硅烷作为还原剂将CO2还原为甲烷(图12,b).
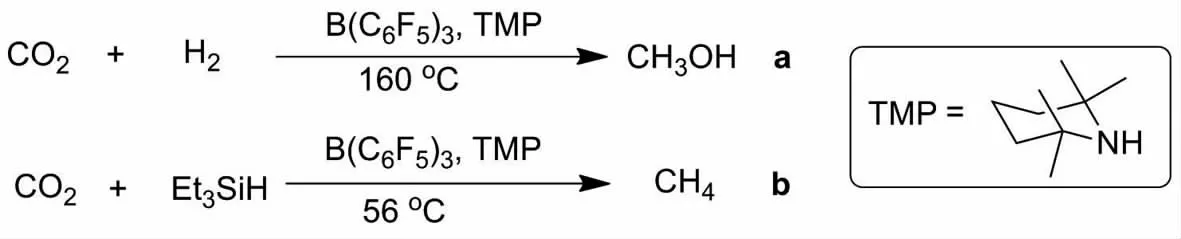
图12 FLPs还原CO2制备甲醇与甲烷Fig.12 Synthesis of methanol and methane by reducing CO2 catalyzed by FLPs
2012年STEPHAN等[45]报道了双硼试剂29与PtBu3组成酸碱对体系,向此体系通入CO2形成稳定CO2加合物30.加合物30具有较好的热稳定性,在溶液中加热80oC没有检测到加合物的分解.基于加合物30较好的稳定性,分别在H2或者氨基硼烷还原剂作用下可以将CO2还原为甲醇(图13).
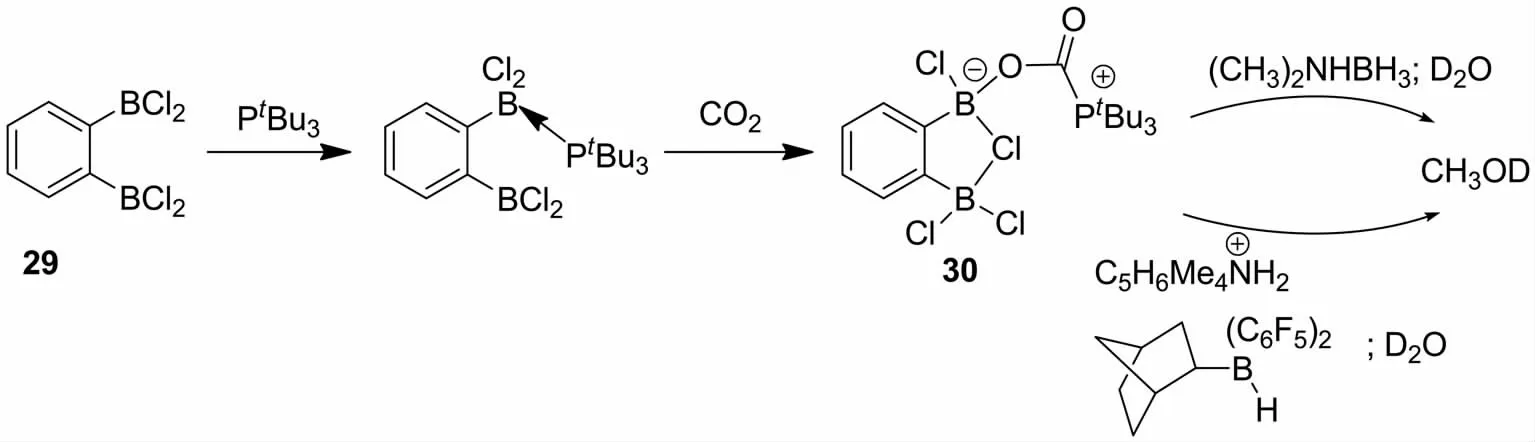
图13 FLPs还原CO2合成甲醇Fig.13 Synthesis of methanol by reducing CO2 catalyzed by FLPs
4 结语与展望
本文作者简要地介绍了CO2的有机催化转化合成五元环状碳酸酯、噁唑啉酮及其还原制备甲醇和甲烷的研究.与金属试剂催化转化CO2相比,有机催化体系尽管存在活性较低,催化剂用量大和底物适用性差等缺点,然而通常有机催化剂具有价格低廉、容易制备、毒性低以及易于高分子负载等众多优点,因此在温和反应条件下开发高效的有机催化体系,促使CO2化学在医药和食品行业等领域突显一定的竞争力,将是有机催化体系未来发展CO2绿色化学的关键所在.
[1]SAKAKURA T,CHOJ J C,YASUDA H.Transformation of carbon dioxide[J].Chem Rev,2007,107(6):2365-2387.
[2]RIDUAN S N,ZHANG Y.Recent developments in carbon dioxide utilization under mild conditions[J].Dalton Trans,2010,39(14):3347-3357.
[3]LU X B,DARENSBOURG D J.Cobalt catalysts for the coupling of CO2and epoxides to provide polycarbonates and cyclic carbonates[J].Chem Soc Rev,2012,41(4):1462-1484.
[4]YANG Z Z,HE L N,GAO J,et al.Carbon dioxide utilization with C-N bond formation:carbon dioxide capture and subsequent conversion[J].Energy Environ Sci,2012,5(5):6602-6639.
[5]ZHANG W Z,LU X B.Synthesis of carboxylic acids and derivatives using CO2as carboxylative reagent[J].Chin J Catal,2012,33(5):745-756.
[6]MAEDA C,MIYAZAKI Y,EMA T.Recent progress in catalytic conversions of carbon dioxide[J].Catal Sci Technol,2014,4(6):1482-1497.
[7]NORTH M,PASQUALE R,YOUNG C.Synthesis of cyclic carbonates from epoxides and CO2[J].Green Chem,2010,12(9):1514-1539.
[8]BARBARINI A,MAGGI R,SARTORIA G,et al.Cycloaddition of CO2to epoxides over both homogeneous and silica-supported guanidine catalysts[J].Tetrahedron Lett,2003,44(14):2931-2934.
[9]SHEN Y M,DUAN W L,SHI M.Phenol and organic bases Co-catalyzed chemical fixation of carbon dioxide with terminal epoxides to form cyclic carbonates[J].Adv Synth Catal,2003,345(3):337-340.
[10]PENG J J,DENG Y Q.Cycloaddition of carbon dioxide to propylene oxide catalyzed by ionic liquids[J].New J Chem,2001,25(5):639-641.
[11]CALÓV,NACCI A,MONOPOLI A,et al.Cyclic carbonate formation from carbon dioxide and oxiranes in tetrabutylammonium halides as solvents and catalysts[J].Org Lett,2002,4(15):2561-2563.
[12]ZHOU Y X,JIANG T,HAN B X,et al.Synthesis of cyclic carbonates from carbon dioxide and epoxides over betaine-based catalysts[J].J Mol Catal A:Chem,2008,284(1/2):52-57.
[13]SUN J,ZHANG S J,CHENG W G,et al.Hydroxylfunctionalized ionic liquid:a novel efficient catalyst for chemical fixation of CO2to cyclic carbonate[J].Tetrahedron Lett,2008,49(22):3588-3591.
[14]YANG Z Z,ZHAO Y N,HE L N,et al.Highly efficient conversion of carbon dioxide catalyzed by polyethylene glycol-functionalized basic ionic liquids[J].Green Chem,2012,14(2):519-527.
[15]GHAZALI-ESFAHANI S,PAUNESCU E,DYSON P J,et al.Cycloaddition of CO2to epoxides catalyzed by imidazolium-based polymeric ionic liquids[J].Green Chem,2013,15(6):1584-1589.
[16]DAI W L,JIN B,LUO S L,et al.Polymers anchored with carboxyl-functionalized dication ionic liquids as efficient catalysts for the fixation of CO2into cyclic carbonates[J].Catal Sci Technol,2014,4(2):556-562.
[17]ZHOU H,ZHANG W Z,LU X B,et al.CO2adducts of N-heterocyclic carbenes:thermal stability and catalytic activity toward the coupling of CO2with epoxides[J].J Org Chem,2008,73(20):8039-8044.
[18]ZHOU H,ZHANG W Z,LU X B,et al.N-Heterocyclic carbene functionalized polymer for reversible fixation-release of CO2[J].Macromolecules,2009,42(15):5419-5421.
[19]ZHOU H,WANG Y M,LU X B,et al.N-Heterocyclic carbene functionalized MCM-41as an efficient catalyst for chemical fixation of carbon dioxide[J].Green Chem,2011,43(3):644-650.
[20]TSUTSUMI Y,YAMAKAWA K,SAKAI T,et al.Bifunctional organocatalyst for activation of carbon dioxide and epoxide to produce cyclic carbonate:betaine as a new catalytic motif[J].Org Lett,2010,12(24):5728-5731.
[21]QURESHI Z S,DESHMUKH K M,BHANAGE B M.Applications of ionic liquids in organic synthesis and catalysis[J].Clean Techn Environ Policy,2014,16(8):1487-1513.
[22]HERRMANN W A.N-Heterocyclic carbenes:a new concept in organometallic catalysis[J].Angew Chem Int Ed.2002,41(8):1290-1309.
[23]OCHIAI B,ENDO T.Carbon dioxide and carbon disulfide as resources for functional polymers[J].Prog Polym Sci.2005,30(2):183-215.
[24]FOURNIER J,BRUNEAU C,DIXNEUF P H,et al.Phosphine catalysed synthesis of unsaturated cyclic carbonates from carbon dioxide and propargylic alcohols[J].Tetrahedron Lett,1989,30(30):3981-3982.
[25]JOUMIER J M,FOURNIER J,DIXNEUF P H,etal.Functional carbonates:cyclicα-methylene andβ-oxopropyl carbonates from prop-2-ynyl alcohol derivatives and CO2[J].J Chem Soc Perkin Trans 1.1991:3271-3274.
[26]JOUMIER J M,BRUNEAU C,DIXNEUF P H.A new route to functionalα-enones via pro-2-ynyl alcohol derivatives and carbonates[J].Synlett,1992:453-454.
[27]KAYAKI Y,YAMAMOTO M,IKARIYA T.Stereoselective formation ofα-alkylidene cyclic carbonates via carboxylative cyclization of propargyl alcohols in supercritical carbon dioxide[J].J Org Chem,2007,72(2):647-649.
[28]DELLA CA’N,GABRIELE B,COSTA M,et al.Effective guanidine-catalyzed synthesis of carbonate and carbamate derivatives from propargyl alcohols in supercritical carbon dioxide[J].Adv Synth Catal,2011,353(1):133-146.
[29]KAYAKI Y,YAMAMOTO M,IKARIYA T.N-heterocyclic carbenes as efficient organocatalysts for CO2fixation reactions[J].Angew Chem Int Ed,2009,48(23):4194-4197.
[30]TOMMASI I,SORRENTINO F.1,3-Dialkylimidazolium-2-carboxylates as versatile N-heterocyclic carbine-CO2adducts employed in the synthesis of carboxylates andα-alkylidene cyclic carbonates[J].Tetrahedron Lett,2009,50(1):104-107.
[31]WANG Y B,WANG Y M,LU X B,et al.Fast CO2sequestration,activation,and catalytic transformation using N-heterocyclic olefins[J].J Am Chem Soc,2013,135(32):11996-12003.
[32]WANG Y B,SUN D S,LU X B,et al.Alkoxidefunctionalized imidazolium betaine for CO2activation and catalytic transformation[J].Green Chem,2014,16(4):2266-2272.
[33]FURSTNER A,ALCARAZO M,GODDARD R.et al.Coordination chemistry of ene-1,1-diamines and a prot-otype“carbodicarbene”[J].Angew Chem Int Ed,2008,47(17):3210-3214.
[34]BARBACHYN M R,FORD C W.Oxazolidinone structure-activity relationships leading to linezolid[J].Angew Chem Int Ed,2003,42(18):2010-2023.
[35]YANG Z Z,HE L N,PENG S Y,et al.Lewis basic ionic liquids-catalyzed synthesis of 5-aryl-2-oxazolidinones from aziridines and CO2under solvent-free conditions[J].Green Chem,2010,12(10):1850-1854.
[36]ZHAO Y N,YANG Z Z,HE L N,et al.Design of task-specific ionic liquids for catalytic conversion of CO2with aziridines under mild conditions[J].Catal Today,2013,200:2-8.
[37]WATILE R A,BAGAL D B,BHANAGE B M,et al.Polymer supported diol functionalized ionic liquids:an efficient,heterogeneous and recyclable catalyst for 5-aryl-2-oxazolidinones synthesis from CO2and aziridines under mild and solvent free condition[J].J Mol Catal A:Chem,2011,351:196-203.
[38]WU Y C,LIU G S.Organocatalyzed cycloaddition of carbon dioxide to aziridines[J].Tetrahedron Lett,2011,52(48):6450-6452.
[39]SEAYAD J,SEAYAD A M,NG P J K,et al.N-Heterocyclic carbene(NHC)catalyzed cycloaddition of CO2to N-tosyl-aziridines:regio and stereoselective synthesis of oxazolidin-2-ones[J].ChemCatChem,2012,4(6):774-777.
[40]UENO A,KAYAKI Y,IKARIYA T.Cycloaddition of tertiary aziridines and carbon dioxide using a recyclable organocatalyst 1,3-di-tertbutylimidazolium-2-carboxylate:straightforward access to 3-substituted 2-oxazolidones[J].Green Chem,2013,15(2):425-430.
[41]RIDUAN S N,ZHANG Y,YING J Y.Conversion of carbon dioxide into methanol with silanes over N-heterocyclic carbene catalysts[J].Angew Chem Int Ed,2009,48(18):3322-3325.
[42]STEPHAN D W.Frustrated Lewis pairs:a new strategy to small molecule activation and hydrogenation catalysis[J].Dalton Trans,2009,17:3129-3136.
[43]ASHLEY A E,THOMPSON A L,O’HARE D.Non-metal-mediated homogeneous hydrogenation of CO2to CH3OH[J].Angew Chem Int Ed,2009,48(52):9839-9843.
[44]BERKEFELD A,PIERS W E,PARYEZ M.Tandem frustrated Lewis pair/tris(pentafluorophenyl)boranecatalyzed deoxygenative hydrosilylation of carbon dioxide[J].J Am Chem Soc,2010,132(31):10660-10661.
[45]SGRO M J,DOMER J,STEPHAN D W.Stoichiometric CO2reductions using a bisborane-based frustrated Lewis pair[J].Chem Commun,2012,48(58):7253-7255.