甲硫醚降解菌JLM-8的分离鉴定与降解条件优化
2015-11-26邱吉国李爱文叶杰旭陈建孟
邱吉国,李爱文,叶杰旭,陈建孟
甲硫醚降解菌JLM-8的分离鉴定与降解条件优化
邱吉国,李爱文,叶杰旭,陈建孟
(浙江工业大学生物与环境工程学院,浙江杭州 310014)
从制药厂的活性污泥中分离到一株能以唯一碳源和硫源降解甲硫醚的菌株JLM-8,经过生理生化测试与16S rDNA系统发育树分析鉴定为嗜麦芽寡养单胞菌()。通过测定菌株的生长量、甲硫醚的降解率,利用响应面法优化最佳降解条件,并测定了该菌降解甲硫醚的动力学参数。结果表明:当接种量为25 mg·L-1时,通过响应面法优化的最佳降解条件为温度31.3℃、pH 7.5,初始甲硫醚浓度50 mg·L-1时最大预测降解率为98.2%,实验验证降解率为97.9%。菌株降解动力学参数最大比降解速率、半饱和系数抑制系数分别为2.37 h-1、143.55 mg·L-1、51.35 mg·L-1,临界抑制浓度为78.46 mg·L-1。
甲硫醚;嗜麦芽寡养单胞菌;降解;动力学;环境
引 言
随着我国化工、石化、轻工等工业的迅速发展,大量挥发性有机硫化物(volatile organic sulfur compounds,VOSCs)被随意排放进入大气中,其中甲硫醚(dimethyl sulfide,DMS)是主要的有机硫化物。同大多数VOSCs一样,DMS是恶臭气体,嗅阈值较低[(0.07~5.9)×10-3μl·L-1][1-2],且其具有生物毒性和腐蚀性,当空气中的浓度高于0.5 μl·L-1时就可对身体健康产生危害[3]。DMS这一恶臭气体的存在严重影响了人们的生活质量,给人类的健康带来极大的危害[4-5]。在工业生产中,DMS是低碳硫醚系列的主要品种之一,是重要的化工原料和中间体,可以合成多种农药杀虫剂、杀菌剂,在合成农药领域占有重要地位。因此采用高效经济的方法来处理DMS是一项意义重大的举措[6]。国内外有不少的学者采用化学法、物理法来处理DMS[7],但是这些方法都存在一定的缺陷和不足,这些方法需要较高的成本和能量供应,并会产生二次污染,因此,化学、物理的方法不是经济有效的处理方法。相比之下,生物法处理恶臭气体既环保又经济,尤其对那些低浓度高通量的恶臭气体的去除更加有效[8-10]。
当前大部分报道的降解菌株都能利用DMS为唯一碳源和能源生长,如Suylen等[11]从造纸厂生物过滤器中筛选到的sp. EG。Schäfer[12]从英吉利海峡的海水中筛选的sp. DMS026。少部分细菌则只能以共代谢的方式降解DMS,如ATCC 19178a[13]和NI[14]。另外,不动杆菌sp. 20B能利用DMS为硫源生长[15]。在厌氧条件下,一些产甲烷古菌如和等可以利用硝酸盐作为电子受体厌氧转化DMS[3]。这些不同的降解方式显示了微生物代谢DMS的生物多样性。研究结果显示,DMS降解菌虽分布较广,但DMS降解能力较弱[16-17]。因此,为提高环境中DMS的降解效率,进一步筛选高效降解DMS的菌种,并研究其生物降解特性就具有重要的意义[18]。
在本文的研究中,从活性污泥中分离得到了一株DMS的高效降解菌嗜芽单胞菌JLM-8,采用响应面分析的方法[19]优化菌株的降解条件,用动力学模型分析底物的降解情况以及菌体的生长情况,为生物法处理DMS污染物奠定了生物学基础。
1 实验材料和方法
1.1 试剂与培养基
甲硫醚购自上海百灵威科技公司。其他常规试剂购自杭州常青化工公司。
基础无机盐培养基(MSM,g·L-1):Na2HPO4·12H2O 4.5,KH2PO41.0,NH4Cl 1.5,MgCl20.2,CaCl20.023,微量元素母液1 ml。微量元素母液(g·L-1):FeCl21.0,H3BO30.014, MnCl20.10,ZnCl20.10,Na2MoO4·2H2O 0.02,CoCl2·6H2O 0.02。
LB培养基(g·L-1):蛋白胨 10,酵母膏 5,NaCl 10。
1.2 降解菌株的分离鉴定
活性污泥取自浙江台州某医药厂污水池。将污泥放置广口瓶中,以DMS为唯一碳源和能源进行驯化、富集。数月后取上层菌悬液,接种至含50 ml MSM培养基的250 ml密封蓝盖瓶中,以DMS作为唯一碳源和能源,30℃、180 r·min-1继续培养。将在蓝盖瓶中经过多次传代富集的混合菌液进行稀释涂布,依据菌体群落的差异性挑取单菌落,进行多次划线分离后,再接种至以DMS为唯一碳源和能源的MM培养基中,验证其是否具有DMS降解能力。选择具有DMS降解能力的纯菌,低温保藏。除观察菌落特征外,还要结合显微镜等设备检测并记录菌体的个体形态特征,并进一步用JEOLJEM- 1200EX透射电子显微镜观察菌体形态。
常规生理生化方法按照文献[20]的方法进行。16S rDNA序列分析:以菌株基因组DNA为模板,以16S rDNA通用引物(27F和1492R)扩增全长的16S rDNA序列。PCR产物经上海生工生物工程公司测序后,所得DNA序列在GenBank进行BLAST,对获得的同源序列进行分析,用ClusterX4.0进行序列分析,采用Mega5.0邻位相连法构建进化树。
1.3 菌体培养
从斜面中将菌种转接至装100 ml LB培养基的250 ml三角瓶中,置于30℃、180 r·min-1摇床培养12 h,离心收集菌体(4℃、9000 r·min-1、10 min),并用磷酸缓冲液(50 mmol·L-1、pH 8.0)冲洗2次,得到降解用静息细胞,再加入适量液体基础盐培养基配制成静息细胞悬浊液。
1.4 DMS的降解实验
在测定菌株利用DMS的生长情况时,使菌种接种量在5 mg·L-1。在培养条件优化及放大培养中,控制培养液初始生物量为25 mg·L-1进行降解。DMS初始浓度为50 mg·L-1,于30℃、180 r·min-1摇床培养。同时设未接种的对照组。定期取样测定菌体生长和DMS的残留情况。细菌的生长情况通过单位体积的生物量(干重)的值来进行检测,剩余的DMS的量通过GC来测量。在相同的条件下,菌株JLM-8对DMS降解动力学分析采用不同的起始浓度(25、50、100、150、200、250和300 mg·L-1)。
1.5 响应面法优化DMS降解条件
利用响应面法优化菌株JLM-8对DMS的最佳降解条件。采用Design-Expert(version 8.0.6)软件,依据Box-Benhnken的中心组合试验设计原理,以温度、pH和降解菌株初始接种量3个反应条件为自变量,以DMS的降解率(%)为响应值进行优化,因素和水平值见表1。
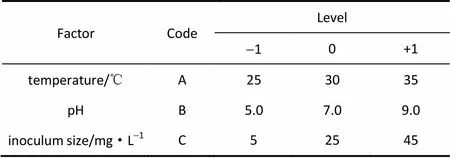
表1 试验设计的因素及对应值
1.6 DMS的降解动力学模型
依据式(1)计算底物DMS的不同起始浓度与菌株JLM-8的比降解速率
式中,为比降解速率,h-1;为底物浓度,mg·L-1;为反应时间,h。
菌株JLM-8的比生长速率依据Haldane’s模型进行计算[21-22],其方程如下
式中,max为最大比降解速率,h-1;s为半饱和系数,mg·L-1;i为抑制常数,mg·L-1。
1.7 分析方法
DMS通过带有FPD检测器的安捷伦气相色谱(HP-Innowax 硅胶毛细管柱,30 m×0.32 mm×0.5 μm,J&W Scientific,USA)测定,方法为:H2和空气流速50 ml·min-1,载气为N2,流速为200 ml·min-1,进样口温度、柱温、检测器温度分别为180、100、180℃。每个样品进样量为200 μl。
2 实验结果与讨论
2.1 降解菌的分离和鉴定
经过驯化、富集、稀释涂布、挑取单菌落等一系列步骤后,根据菌体群落形态的差异,筛选出一株菌体能高效降解DMS,将其命名为JLM-8。菌株JLM-8利用无机盐培养基中的DMS作为唯一的C源和S源,10 h内能将50 mg·L-1的DMS降解完全。菌株革兰染色呈阴性,杆状,大小为(0.2~0.5)μm×(1.2~1.7)μm,无芽孢,平板上菌落呈小圆状、白色、形态饱满、光滑湿润,易挑起,菌苔沿划线生长。V-P试验、H2S试验、氧化酶试验、淀粉水解试验呈阳性,吲哚试验、明胶液化试验、甲基红试验、接触酶试验、精氨酸双水解试验、荧光色素试验呈阴性。菌株能利用麦芽糖、柠檬酸和苹果酸生长,不能利用甘露糖和乳酸。该菌对红霉素和四环素有耐药性,对于青霉素、氯霉素和庆大霉素敏感。以菌株的基因组DNA为模板PCR获得 约1400 bp的16S rDNA扩增产物(GenBank:KP979740)。通过BLAST发现该菌16s rDNA序列与嗜麦芽寡养单胞菌模式菌株B6(GenBank:JQ579644)和.D457(GenBank:HE798556)的相似度分别为100%和99.4%。JLM-8的系统发育树如图1所示。根据菌株生理生化特性与16S rDNA系统发育树分析,将JLM-8鉴定为嗜麦芽寡养单胞菌()。迄今为止,尚未有嗜麦芽单胞菌属(spp.)的菌株具有DMS降解能力的报道。
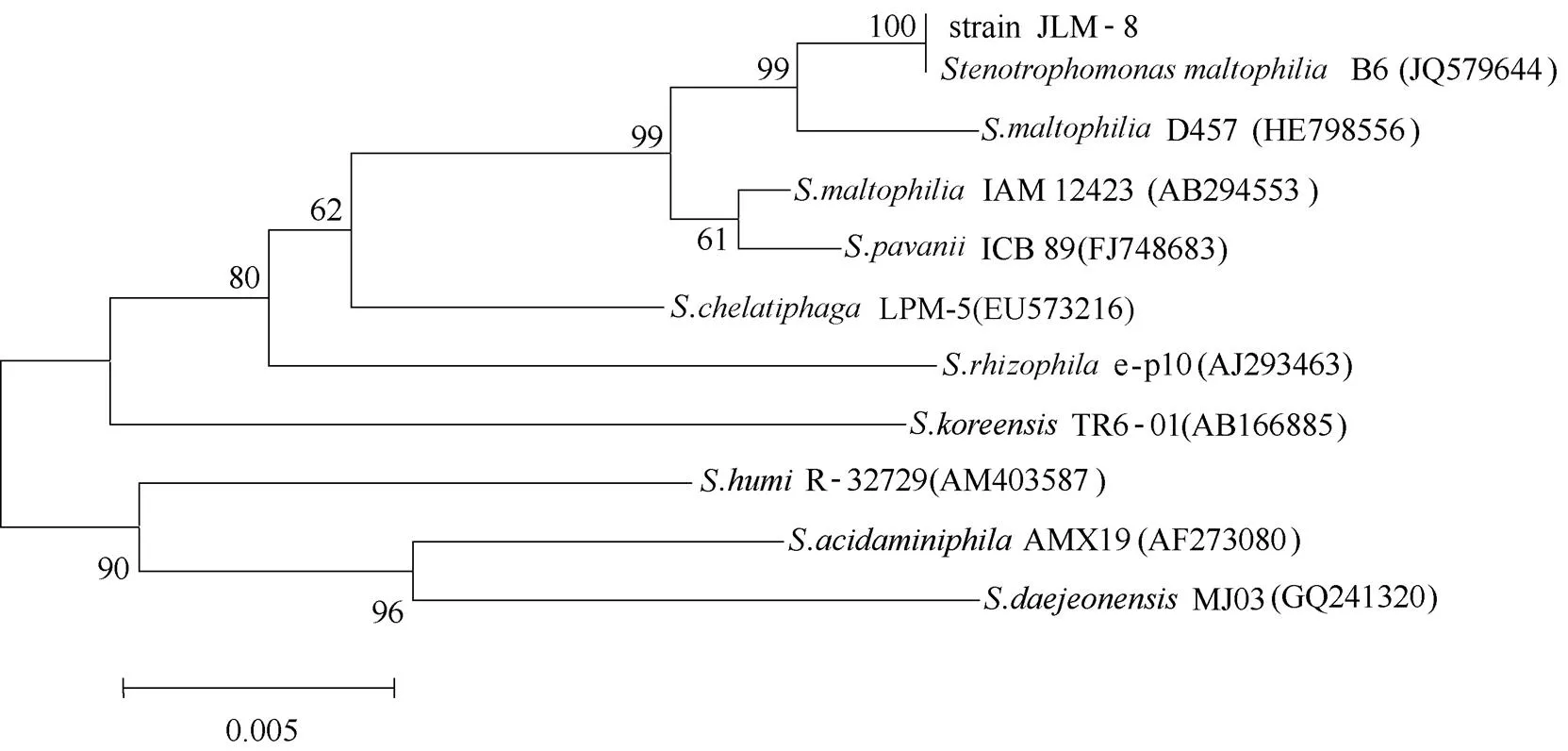
图1 JLM-8与Stenotrophomonas属中典型菌株的系统发育树
2.2 菌株JLM-8利用DMS的生长特性
菌株JLM-8在MSM中以DMS为唯一碳源、硫源的降解过程及菌体的生长曲线如图2所示。在接种后的2~8 h,底物DMS的降解速率最大,约90%。经过10 h后,DMS降解率接近100%。菌株JLM-8降解DMS的速率为6.25 mg·L-1·h-1,优于已报道的两株细菌sp. 20B(5.65 mg·L-1·h-1)[15]和DS1(5.9 mg·L-1·h-1)[23]。经过约4 h的延滞期,菌体生长迅速增加,最终浓度达到26 mg·L-1。菌体在DMS降解完后继续生长可能是降解中间产物没有完全降解,JLM-8能利用中间产物继续生长。
2.3 菌株JLM-8降解DMS的最佳降解条件
根据单因素试验结果,设定温度在25~35℃之间,初始pH范围在5.0~9.0之间,接种量在5~45mg·L-1之间,以DMS降解率为响应值,经软件Design Expert V8.0.7设计出响应面分析S试验,结果见表2。用Design Expert对试验数据(表2)中的DMS降解率的试验数值进行多项式回归拟合,可以得出各影响因子对响应值的影响,得到二次多项式方程如下
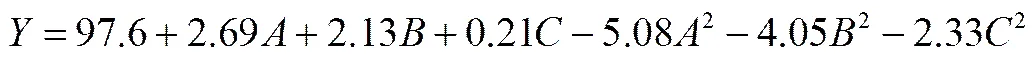
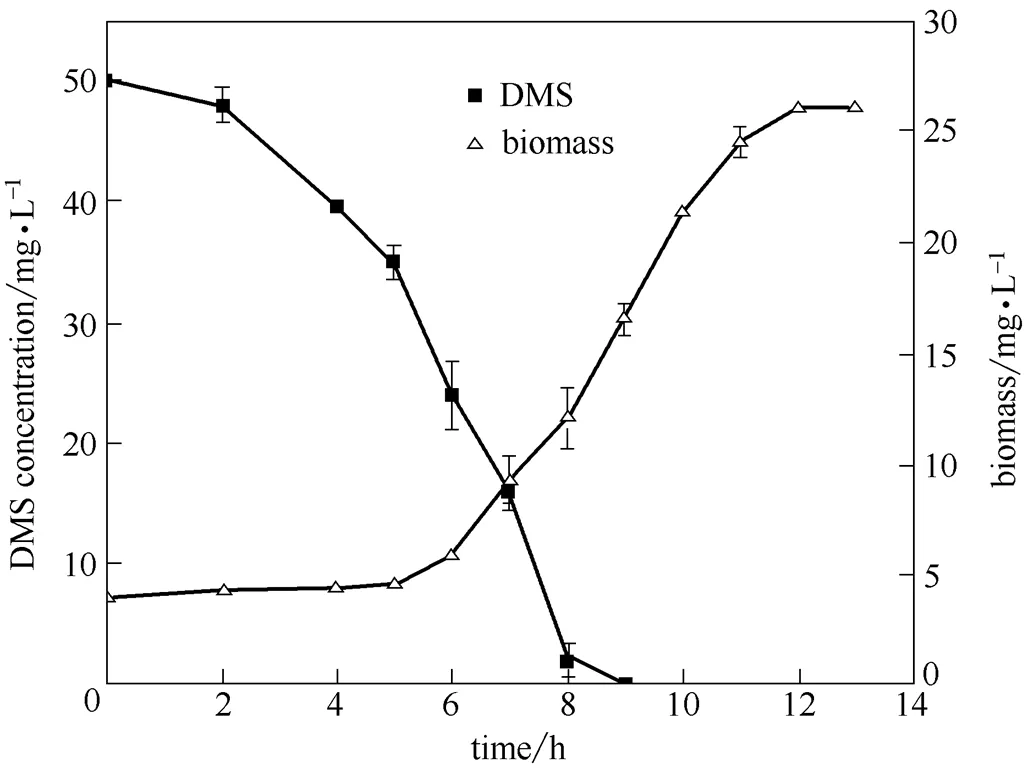
图2 菌株JLM-8对DMS的降解曲线及生长曲线
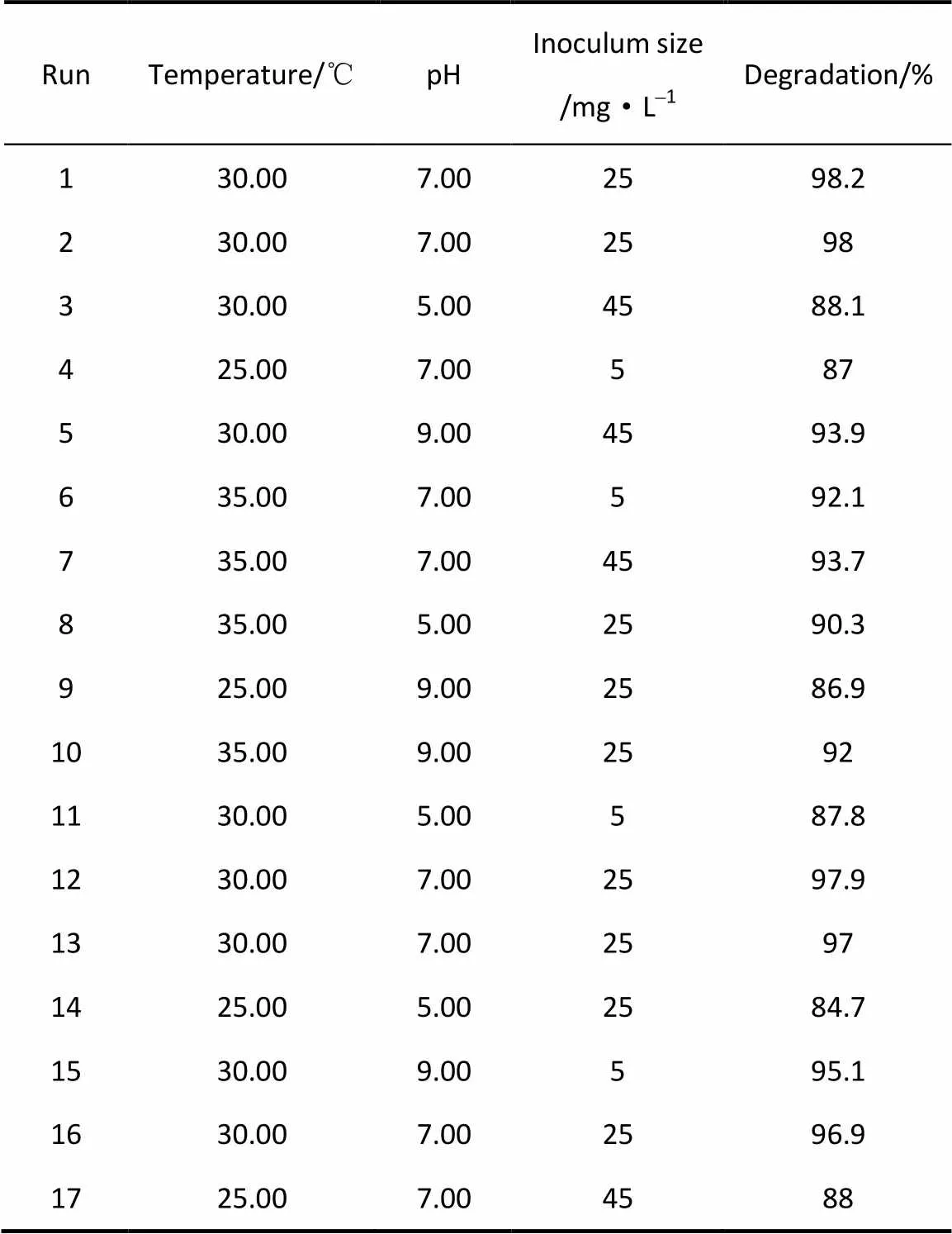
表2 实验方案与实际和预测响应值
式中,代表去除率,、、分别代表温度、pH和接种量。
本试验所拟合的模型的显著系数<0.0001,该模型具有极高的显著性,建立的模型具有较高的可靠性。在考察的几个因素中,-温度、-pH、2、2、2的值均小于0.01,说明这几项对去除率的影响极显著;而-接种量值大于0.05,说明对去除率的影响不显著,可能是由于所选接种浓度超过对降解产生影响的变化阈值。在本回归模型中,失拟指数0.0544>0.05,表明该二次方程失真不显著,因此可以进一步分析。
当接种量为25 mg·L-1时,最佳降解条件为温度31.3℃、pH7.5,最大预测降解率为98.2%。为了验证上述模型准确性,按上述条件进行了试验,得出的降解率数据为97.9%,这与预测值十分接近,表明该模型能很好地预测降解情况。
2.4 DMS起始浓度对菌株JLM-8降解的影响
不同DMS起始浓度下,菌株降解速率也不同。起始浓度为25、50、100 mg·L-1时,8 h内的降解率为100%。当浓度为150、200、250和300 mg·L-1,12 h的降解率分别为90%、85%、82.3%、75%。虽然菌株JLM-8是降解DMS的特定菌株,但在DMS降解过程中,由于其本身对微生物有一定的毒害作用,因此当浓度达到一定值时,会对降解过程产生抑制效应。为了定量描述这种抑制效应,采用Haldane’s模型对菌株降解过程进行动力学拟合,如图3所示。菌株JLM-8降解DMS的比降解动力学参数:max2.37 h-1、s143.55 mg·L-1、i51.35 mg·L-1。所得相关系数20.996说明试验数据与模型预测吻合度高。DMS临界抑制浓度为78.46 mg·L-1(图3),当DMS起始浓度低于此浓度时比降解速率随浓度增加而逐渐增加,当大于该值时,比降解速率逐渐降低,说明底物对降解的抑制作用越显著。
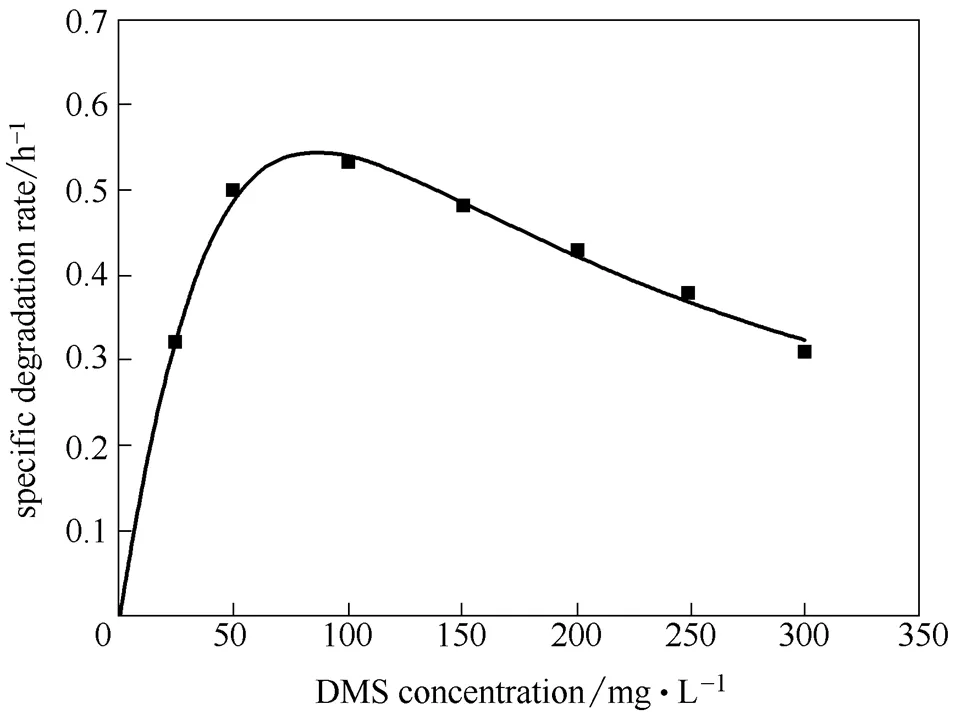
图3 菌株JLM-8降解DMS的起始浓度与比降解速率的Haldane’s模型拟合
3 结 论
本文分离到一株可以降解DMS的嗜麦芽寡养单胞菌,研究了不同条件下该菌株的降解特性,主要结论如下。
(1)根据菌株生理生化特性与16S rDNA系统发育树分析,将JLM-8鉴定为嗜麦芽寡养单胞菌。本研究是迄今为止首次报道嗜麦芽单胞菌属(spp.)的菌株具有DMS降解 能力。
(2)考察了温度、初始pH和接种量三单因素下DMS降解率,通过响应面法优化得到最佳降解条件:温度31.3℃、pH7.5,接种量为25 mg·L-1,最大预测降解率为98.2%,试验验证降解率数据为97.9%,表明该模型能很好地预测降解情况。
(3)通过测定不同DMS起始浓度的降解速率,根据Haldane’s模型拟合菌株降解动力学参数:max2.37 h-1、s143.55 mg·L-1、i51.35 mg·L-1,相关系数20.996。证明试验数据与模型预测吻合度高。
[1] Zhang Tingting (张婷婷), Qi Lei (祁蕾), Yu Yang (于洋), Yu Jiang (余江). Photolysis of dimethyl sulfide by microwave electrodeless discharge lamp [J].(化工学报), 2014, 65 (11): 4579-4585.
[2] van Gemert L J. ODOUR THRESHOLDS—Compilations of Odour Threshold Values in Air, Water and Other Media [M]. Netherlands: Oliemans Punter & Partners BV, 2003.
[3] Lomans B P, van der Drift C, Pol A, den Camp H J M Op. Microbial cycling of volatile organic sulfur compounds [J]., 2002, 59 (4): 575-588.
[4] Glindemann D, Novak J, Witherspoon J. Dimethyl sulfoxide (DMSO) waste residues and municipal waste water odor by dimethyl sulfide (DMS): the north-east WPCP plant of Philadelphia [J]., 2006, 40 (1): 202-207.
[5] Du Weiwei, Parker W. Modeling volatile organic sulfur compounds in mesophilic and thermophilic anaerobic digestion of methionine [J]., 2012, 46 (2): 539-546.
[6] Wei Z S, Li H Q, He J C, Ye Q H, Huang Q R, Luo Y W. Removal of dimethyl sulfide by the combination of non-thermal plasma and biological process [J]., 2013, 146:451-456.
[7] Rappert S, Müller R. Microbial degradation of selected odorous substances [J]., 2005, 25 (9): 940-954.
[8] Giri B S, Pandey R A. Biological treatment of gaseous emissions containing dimethyl sulphide generated from pulp and paper industry [J]., 2013, 142: 420-427.
[9] Hayes A C, Liss S N, Grant A D. Growth kinetics ofandspp. in mixed cultures degrading dimethyl sulfide and methanol [J]., 2010, 76 (16): 5423-5431.
[10] Jo W K, Shin M H. Applicability of a continuous-flow system inner-coated with S-doped titania for the photocatalysis of dimethyl sulfide at low concentrations [J]., 2010, 91 (10): 2059-2065.
[11] Suylen G M H, Kuenen J G. Chemostat enrichment and isolation ofEG [J]., 1986, 52 (4): 281-293.
[12] Schäfer H. Isolation ofspp. from marine dimethylsulfide- degrading enrichment cultures and identification of polypeptides induced during growth on dimethylsulfide [J]., 2007, 73 (8): 2580-2591.
[13] Laanbroek H J, Gerards S. Competition for limiting amounts of oxygen betweenandgrown in mixed continuous cultures [J]., 1993, 159 (5): 453-459.
[14] Fuse H, Ohta M, Takimura O, Murakami K, Inoue H, Yamaoka Y, Oclarit J M, Omori T. Oxidation of trichloroethylene and dimethyl sulfide by a marinestrain containing soluble methane monooxygenase [J].,,, 1998, 62 (10): 1925-1931.
[15] Horinouchi M, Kasuga K, Nojiri H, Yamane H, Omori T. Cloning and characterization of genes encoding an enzyme which oxidizes dimethyl sulfide insp. strain 20B [J]., 1997, 155 (1): 99-105.
[16] Boden R, Kelly D P, Colin M J, Schäfer H. Oxidation of dimethylsulfide to tetrathionate bysp. nov.: a new link in the sulfur cycle [J]., 2010, 12 (10): 2688-2699.
[17] Boden R, Colin M J, Schäfer H. Dimethylsulfide is an energy source for the heterotrophic marine bacterium[J]., 2011, 322 (2): 188-193.
[18] Luo J, Agnew M P. Gas characteristics before and after biofiltration treating odorous emissions from animal rendering processes [J]., 2001, 22 (9): 1091-1103.
[19] Xiao Wu (肖武), Li Mingyue (李明月), Ruan Xuehua (阮雪华), He Gaohong (贺高红), Du Jian (都健). Optimization of ethyl acetate process conditions for sodium bisulfate fluidized catalytic distillation using response surface methodology [J].(化工学报), 2014, 65 (11): 4465-4471.
[20] Liang Kaiqiang (梁凯强), Li Guoqiang (李国强), Jiang Shaojing (江绍静), Li Shiqiang (李世强), Ma Ting (马挺). Characteristics of chemotaxis movement towards crude oil of oil-degrading strainsp.6-1B [J].(化工学报), 2012, 63 (7): 2246-2251.
[21] Yu Jianming, Cai Wenji, Cheng Zhuowei, Chen Jianmeng. Degradation of dichloromethane by an isolated strainand its performance in a biotrickling filter [J]., 2014, 26 (5): 1108-1117.
[22] Chen Lan (陈岚), Quan Yuheng (权宇珩), Li Zhiyong (李志勇). Kinetics analysis of ozone degradating 2,4-D pollutant in soil [J].(化工学报), 2014, 65 (8): 3255-3260.
[23] Endoh T, Kasuga K, Horinouchi M, Yoshida T, Habe H, Nojiri H, Omori T. Characterization and identification of genes essential for dimethyl sulfide utilization instrain DS1 [J]., 2003, 62 (1): 83-91.
Isolation and characterization of a novel dimethyl sulfide degrading strainJLM-8
QIU Jiguo, LI Aiwen, YE Jiexu, CHEN Jianmeng
College of Biological and Environmental EngineeringZhejiang University of TechnologyHangzhouZhejiangChina
Dimethyl sulfide (DMS) is one of the most important volatile organic sulfur compounds. Due to its malodorous smell and the extremely low odor threshold, DMS has become a critical issue in wastewater collection and treatment systems. In this study, a novel strain JLM-8, with capability of degrading DMS as sole carbon and sulfur source, was isolated from the active sludge of a pharmaceutical plant. Based on the morphological, physiological and biochemical properties as well as its 16S rDNA gene sequence analysis, the strain JLM-8 was identified as a member of. The strain could degrade approximately 100% of 50 mg·L-1DMS within 8 hours at pH 7 and 30℃. Response surface methodology (RSM) analysis showed that the optimum conditions for degradation were at pH 7.5 and 31.3℃, using an inoculum amount of 25 mg·L-1. Under these conditions, approximately 97.9% of DMS was degraded. The kinetic parametersmax,s, andiwere established to be 2.37 h-1, 143.55 mg·L-1, 51.35 mg·L-1, respectively. The critical inhibitor concentration was determined to be 78.46 mg·L-1.Research on the characterization of DMS degradable bacteria can provide a new theoretical and technical fundamental basis for bioremediation of DMS-contaminated environments.
dimethyl sulfide;; degradation; kinetics; environment
2015-05-29.
Prof.CHEN Jianmeng, jchen@zjut.edu.cn
10.11949/j.issn.0438-1157.20150746
Q 939.9
A
0438—1157(2015)08—3242—06
陈建孟。
邱吉国(1984—),男,博士,助理研究员。
中国博士后科学基金面上项目(2014M560495);浙江省教育厅科研项目(Y201329224);教育部“长江学者和创新团队发展计划”(IRT13096)。
2015-05-29收到初稿,2015-06-06收到修改稿。
supported by the China Postdoctoral Science Foundation (2014M560495), the Program of the Department of Education of Zhejiang Province (Y201329224) and the Program for Changjiang Scholars and Innovative Research Team in University (IRT13096).
