曲美他嗪降低大鼠脂肪肝缺血再灌注损伤的研究
2015-11-24王腾飞杨涛张威方振宇王洪海刘蕾张海明王玉亮
王腾飞,杨涛,张威,方振宇,王洪海,刘蕾,张海明,王玉亮
曲美他嗪降低大鼠脂肪肝缺血再灌注损伤的研究
王腾飞1,杨涛2△,张威2,方振宇2,王洪海2,刘蕾2,张海明2,王玉亮3
目的探讨曲美他嗪(TMZ)对自体肝移植大鼠脂肪肝缺血再灌注损伤的保护作用。方法30只Wistar大鼠喂食高脂饲料诱导脂肪肝模型后,随机分为假手术(Sham)组、模型(Model)组和TMZ组,每组10只。采用脂肪肝大鼠自体肝移植缺血再灌注损伤模型,于再灌注6 h后取材,分别观察血浆丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、肝组织丙二醛(MDA)、超氧化物歧化酶(SOD)水平以及肝组织病理情况。Western blot法检测肝组织Bcl-2、Caspase-3的表达水平;TUNEL法检测肝细胞凋亡情况。结果术后6 h,与Model组相比,TMZ组血浆ALT、AST、肝组织MDA含量明显降低(P<0.05),肝组织SOD含量增高(P<0.05)。TMZ组肝组织中Bcl-2的表达水平明显高于Model组,而活化的Caspase-3的水平明显降低(P<0.05)。肝组织HE染色及TUNEL显示TMZ组肝细胞水肿、肝窦狭窄及肝细胞凋亡明显轻于Model组。结论在缺血再灌注时,TMZ减少氧化应激,促进Bcl-2表达,抑制Caspase-3的活化,减少肝细胞凋亡,对大鼠脂肪肝缺血再灌注损伤起保护作用。
曲美他嗪;脂肪肝;再灌注损伤;细胞凋亡;bcl-2相关X蛋白质;丙氨酸转氨酶;天冬氨酸氨基转移酶类;丙二醛;超氧化物歧化酶;caspase-3
我国每年实施肝移植手术约2 000例,而需要肝移植救助的患者数量远高于此,供肝的相对短缺限制了器官移植的发展[1]。因此,扩大供体来源如脂肪肝应用的研究成为热点。与正常肝脏相比,脂肪肝对缺血再灌注损伤(IRI)的耐受更差,移植后发生原发性肝无功能的危险更大[2]。大量的临床及实验研究显示,曲美他嗪(Trimetazidine,TMZ)能够通过降低微循环阻力、维持细胞内环境稳定、优化能量代
谢、抑制氧化应激等多种途径减轻心肌、脑、肾脏缺血再灌注时实质细胞凋亡及坏死水平,对心肌、脑、肾脏有保护作用[3-5]。本实验通过向肝脏保存液中添加TMZ预处理,探讨TMZ在大鼠脂肪肝IRI中的保护作用,为临床安全有效利用脂肪肝进行肝移植提供新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物及饲料清洁级健康Wistar大鼠30只,雄性,鼠龄10~12周,体质量(200±10)g,军事医学科学院实验动物中心提供,许可证号:SCXK-(军)2012-0004;饲料为缺乏胆碱和蛋氨酸(CMDD)饲料[6](军事医学科学院实验动物中心提供)。
1.1.2 药品和试剂UW(the University of Wisconsin solution)液购自美国ViaSpan;TMZ购自美国Sigma公司;丙二醛(MDA)和超氧化物歧化酶(SOD)测试盒购自南京建成生物研究所;兔抗鼠Bcl-2多克隆抗体、兔抗鼠Caspase-3多克隆抗体、兔抗鼠β-actin多克隆抗体购自北京中山生物技术公司产品。
1.2 方法
1.2.1 脂肪肝模型的建立30只Wistar大鼠,CMDD饲料喂养14 d后经病理验证,均出现中度脂肪肝变性。脂肪肝病理诊断标准[7]:脂肪变性的肝细胞<30%为轻度脂肪肝,脂肪变性的肝细胞>60%为重度脂肪肝,介于两者之间的为中度脂肪肝。
1.2.2 缺血再灌注模型的建立30只大鼠术前禁食12 h,不禁水。水合氯醛麻醉成功后取腹部正中切口,暴露剑突后,用血管钳钳夹拉开腹壁,并用裁剪合适的湿纱布保护肠管。游离右肾上腺静脉,不予结扎、切断,然后依次游离肝下下腔静脉(下腔静脉位于肝与右肾静脉之间的一段)、肝动脉、门静脉、肝上下腔静脉(下腔静脉位于肝与膈肌之间的一段),肝动脉和胆管一同游离。分别在肝动脉、肠系膜上静脉与脾静脉汇合处和肝下下腔静脉与右肾静脉汇合处上微血管夹,用4号针头刺入门静脉,匀速缓慢打入肝素盐水(30 U/mL)2 mL,使肝内血液进入体循环。开始灌注前,分别在肝上及肝下下腔静脉上微血管夹,注意钳夹肝上下腔静脉时尽量少钳夹膈肌,以免造成呼吸运动障碍;并在肝下下腔静脉血管夹上方静脉壁剪开约1 mm作灌注液流出道。以1.5 mL/min的速度经门静脉穿刺处缓慢持续灌注UW液,使肝全部变为土黄色、流出液清亮示灌注充分,灌注的同时用4℃生理盐水给肝脏表面物理降温。灌注完毕前1 min更换乳酸林格液灌注冲净肝脏中的UW液,灌注完毕后拔出穿刺针,用8-0血管线修补穿刺点和肝下下腔静脉流出道,检查确认修补成功后,松开各处微血管夹,结束无肝期,整个缺血过程为30 min,然后逐层关闭腹腔。
1.2.3 动物分组脂肪肝模型建立成功后,采用随机数字表法将30只大鼠随机分为3组,每组10只。假手术(Sham)组:麻醉后开腹,分离肝周组织后关腹,不进行IRI处理。模型(Model)组:采用IRI模型,灌洗液为UW液。TMZ组:采用IRI模型,灌洗液为添加了TMZ(TMZ浓度为10-6mol/L[8])的UW液。
1.2.4 标本处理及病理学检查再灌注6 h后,从肝下下腔静脉取血5 mL,静置30 min后,于常温下3 000 r/min离心10 min,提取血清,置于-80℃冰箱保存。每只大鼠在肝脏左叶和尾叶的固定部位取2块组织,其中1块修剪成约1.0 cm×1.0 cm×0.5 cm大小置于4%中性甲醛固定,另1块迅速置于冻存管中液氮速冻,之后-80℃冰箱保存备用。
1.2.5 指标检测(1)肝功能指标:取保存的血清1 mL用全自动生化分析仪检测丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)。(2)氧化损伤指标:取肝组织做10%的肝组织匀浆。采用硫代巴比妥法测量肝组织MDA含量;黄嘌呤氧化酶法测定SOD含量。(3)肝组织病理学检查:肝组织甲醛固定24 h后,常规石蜡包埋,连续4 μm厚切片,苏木精-伊红(HE)染色,光镜观察肝组织形态学变化。(4)肝细胞凋亡检测:采用免疫荧光法。取4%甲醛溶液固定后的肝组织,石蜡包埋、切片,按试剂盒说明操作。每张切片随机取5个高倍镜下视野(×400),计算凋亡细胞与正常细胞比例,即凋亡指数(AI),取其平均值。(5)Bcl-2和Caspase-3表达的检测:用Western blot法检测,取-80℃保存的肝组织约100 mg,匀浆、离心,取上清液测定蛋白质浓度。进行SDS-PAGE,转膜后封闭液封闭过夜,加入适当浓度的一抗、二抗,进行增强化学发光(ECL)显色,观察Bcl-2和Caspase-3蛋白条带的表达情况。
1.3 统计学方法采用SPSS 19.0统计软件进行数据处理,计量资料以均数±标准差表示,采用One-way ANOVA分析,组间多重比较采用LSD(方差齐)或Dunnett(方差不齐)法。P<0.05为差异有统计学意义。
2 结果
2.1 缺血再灌注6 h后血清ALT、AST及肝组织SOD、MDA含量的测定与Sham组相比,Model组ALT、AST含量明显增高。TMZ组与Model组相比,这一增高趋势明显受到抑制(均P<0.05)。Model组和TMZ组肝组织SOD含量较Sham组明显降低。与Model组比较,TMZ组肝组织SOD水平升高(P<0.05)。Model组和TMZ组肝组织MDA含量较Sham组明显升高;与Model组比较,TMZ组肝组织MDA水平降低(P<0.05)。见表1。
Tab.1Comparison of serum ALT,AST,SOD and MDA in liver tissues between three groups表1 各组血浆ALT、AST及肝组织SOD、MDA水平的比较(n=10)
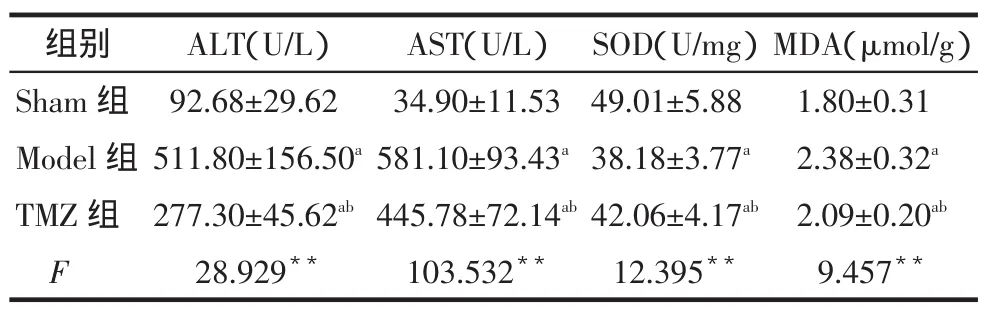
Tab.1Comparison of serum ALT,AST,SOD and MDA in liver tissues between three groups表1 各组血浆ALT、AST及肝组织SOD、MDA水平的比较(n=10)
**P<0.01;a与Sham组比较,b与Model组比较,P<0.05
组别S h a m组M o d e l组T M Z组F M D A(μ m o l / g)1 . 8 0 ± 0 . 3 1 2 . 3 8 ± 0 . 3 2a2 . 0 9 ± 0 . 2 0ab9 . 4 5 7**A L T(U / L)9 2 . 6 8 ± 2 9 . 6 2 5 1 1 . 8 0 ± 1 5 6 . 5 0a2 7 7 . 3 0 ± 4 5 . 6 2ab2 8 . 9 2 9**A S T(U / L)3 4 . 9 0 ± 1 1 . 5 3 5 8 1 . 1 0 ± 9 3 . 4 3a4 4 5 . 7 8 ± 7 2 . 1 4ab1 0 3 . 5 3 2**S O D(U / m g)4 9 . 0 1 ± 5 . 8 8 3 8 . 1 8 ± 3 . 7 7a4 2 . 0 6 ± 4 . 1 7ab1 2 . 3 9 5**
2.2 缺血再灌注6 h后肝脏组织病理学变化Sham组肝细胞肿大,细胞内充满大小不等的脂肪空泡,肝窦被挤压变窄。缺血再灌注6 h后Model组可见肝组织结构紊乱,肝细胞肿胀变性,肝窦狭窄更加明显,并伴有肝细胞凋亡。TMZ组上述情况明显减轻。见图1。
2.3 缺血再灌注6 h后肝细胞凋亡情况光镜下观察,Sham组大鼠肝细胞仅有少许凋亡,Model组及TMZ组肝细胞凋亡明显增加,见图2。Sham组、Model组及TMZ组AI分别为(6.7±2.1)%、(36.6± 7.3)%、(23.0±5.2)%,Model组高于Sham组,TMZ组低于Model组,但高于Sham组。
2.4 缺血再灌注6 h后Bcl-2和Caspase-3表达情况Model组和TMZ组肝组织Bcl-2表达较Sham组明显降低;与Model组比较,TMZ组肝组织Bcl-2表达增高。Model组肝组织Caspase-3表达较Sham组明显增高;与Model组比较,TMZ组Caspase-3表达降低;TMZ组与Sham组差异无统计学意义。见图3。
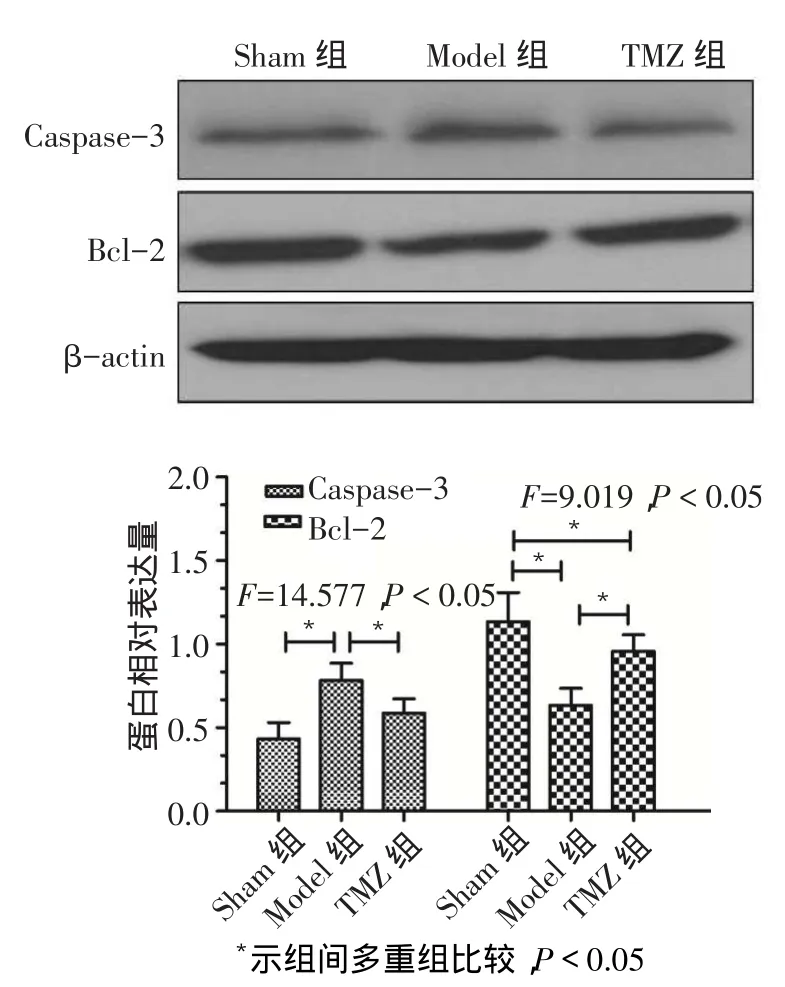
Fig.3Comparison of the expression levels of Bcl-2 and Caspase-3 between three groups图3 各组Bcl-2、Caspase-3表达水平的比较
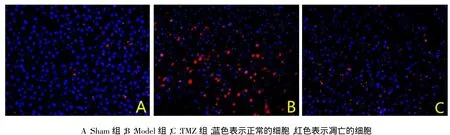
Fig.2Comparison of hepatocellular apoptosis between three groups(TUNEL,×400)图2 各组肝细胞凋亡情况的比较(TUNEL,×400)
3 讨论
3.1 脂肪肝等边缘供肝的临床应用肝移植是挽救终末期肝病患者安全且有效的手段。但供肝相对短缺已成为阻碍此类肝功能衰竭患者获得肝移植治疗的瓶颈。因此,越来越多的边缘供肝被用于临床,如高龄供肝、脂肪肝供肝等。脂肪肝由于存在微循环损害、脂质过氧化增加以及能量代谢障碍等因素,对缺血再灌注损伤更敏感,移植后易出现原发性移植物无功能及早期移植物功能延迟恢复。
3.2 TMZ对减轻脂肪肝IRI的作用肝脏缺血再灌注损伤的机制十分复杂,涉及到氧自由基、钙超载和细胞凋亡等。缺血再灌注过程中,肝脏通过产生氧自由基,引发脂质过氧化反应,损伤肝细胞。氧自由基清除剂SOD及脂质过氧化代谢产物MDA是目前公认的能较好反映体内氧自由基水平及脂质过氧化损伤程度的指标[9]。本实验肝脏缺血再灌注6 h
后,Model组和TMZ组肝功能指标均明显升高,而TMZ组同Model组相比,肝功能指标明显好转,肝组织MDA水平低、SOD含量高;HE染色也显示TMZ组肝细胞水肿、肝窦淤血轻于Model组。因此,笔者认为缺血再灌注时,可通过激活体内氧化系统、抑制抗氧化系统,增加脂质过氧化反应,损伤肝细胞。而灌注添加了TMZ的UW液能拮抗这一过程,明显降低脂质过氧化的程度,对脂肪肝缺血再灌注损伤起到保护作用。
3.3 TMZ对再灌注后肝细胞凋亡的作用本实验再灌注后,Model组及TMZ组血清AST含量急剧升高,AST是一种线粒体酶,主要存在于线粒体内,血清AST升高提示肝脏线粒体功能受损。另外,脂肪肝缺血再灌注后氧化应激增加也可归因于线粒体功能的损伤[10]。线粒体功能受损时,线粒体膜肿胀,膜通透性增高,使位于线粒体内的促凋亡分子如细胞色素C(Cyto-c)、凋亡诱导因子(AIF)、凋亡蛋白酶激活因子(Apaf)等的释放,启动细胞凋亡机制[11]。细胞凋亡过程受多种基因的调控,其中最重要的是Bcl-2、Caspase-3。Caspase-3是细胞凋亡的最终执行者,一旦被激活,即激发下游的级联反应,启动细胞凋亡[12]。而Bcl-2是肝脏缺血再灌注时最重要的抑制肝细胞凋亡的基因[13]。因此本实验选取再灌注后肝脏标本测其Bcl-2、Caspase-3水平及肝细胞凋亡情况,结果显示,再灌注后,Bcl-2表达下调,而活化的Caspase-3增加,肝细胞凋亡增多,提示肝脏缺血再灌注过程诱发了肝细胞凋亡;给予TMZ预处理后,Bcl-2的表达上调,Caspase-3的表达下调,可以抑制肝细胞的凋亡,肝组织TUNEL也证实这一结果。因此我们认为TMZ改善脂肪肝缺血再灌注损伤的机制可能与上调Bcl-2、抑制Cyto-c释放、抑制Caspase-3活化,减少肝细胞凋亡有关。
3.4 TMZ对再灌注后肝细胞损伤的保护作用综上所述,添加TMZ改良肝脏灌注保存液,通过移植前对脂肪肝预处理,可以减轻脂肪肝的缺血再灌注损伤,并有可能促进移植后肝脏功能的恢复,降低移植术后原发性移植物无功能及早期移植物功能延迟恢复的发生率,为临床扩大供体器官来源、安全有效地利用边缘供肝提供了参考方法。
[1]Wang XH,Li GQ.Status and challenges of liver transplantation in China[J].Chin J Dig Surg,2013,12(9):641-643.[王学浩,李国强.我国肝移植现状与面临的挑战[J].中华消化外科杂志,2013,12(9):641-643].doi:10.3760/cma.j.issn.1673-9752.2013.09.001.
[2]Jiang CP,Ding YT.Recent advance in liver grafts from marginal donor[J].Chin J Hepatobiliary Surg,2012,18(8):644-646.[江春平,丁义涛.边缘性供肝的研究进展[J].中华肝胆外科杂志,2012,18(8):644-646].doi:10.3760/cma.j.issn.1007-8118.2012.08.023.
[3]Luo XH,Luo Y.Clinical application and recent advance of trimetazidine[J].PJCCPVD,2009,17(12):1114-1117.[罗先虎,罗勇.曲美他嗪的临床应用与研究进展[J].实用心脑肺血管病杂志,2009,17(12): 1114-1117].doi:10.3969/j.issn.1008-5971.2009.12.057.
[4]Zhang R,Wei JR,Yin HY,et al.Effect of trimetazidine on renal function in patients with shock[J].Chin Crit Care Med,2014,26(4):219-222.[张锐,韦建瑞,尹海燕,等.曲美他嗪对休克患者肾功能影响的临床研究[J].中华危重病急救医学杂志,2014,26(4): 219-222].doi:10.3760/cma.j.issn.2095-4352.2014.04.004.
[5]Yalcin AD,Bisgin A,Erbay RH,et al.Trimetazidine effect on burninduced intestinal mucosal injury and kidney damage in rats[J].Int J Burns Trauma,2012,2(2):110-117.
[6]Koneru B,Dikdan G.Hepatic steatosis and liver transplantation current clinical and experimental perspectives[J].Transplantation,2002,73(3):325-330.
[7]Xiao JW,Xia SS,Jin XQ.Heme oxygenase-1 gene transfer attenuates rat steatotic liver graft from ischemia/reperfusion injury[J].Chin J Organ Transplant,2008,29(11):652-656.[肖江卫,夏树森,金先庆.转染血红素氧合酶-1基因减轻大鼠脂肪肝移植后的缺血再灌注损伤[J].中华器官移植杂志,2008,29(11):652-656].doi: 10.3760/cma.j.issn.0254-1785.2008.11.003.
[8]Hauet T,Goujon JM,Vandewalle A,et al.Trimetazidine reduces renal dysfunction by limiting the cold ischemia/reperfusion injury in autotransplanted pig kidneys[J].J Am Soc Nephrol,2000,11(1): 138-148.
[9]Evans ZP,Mandavilli BS,Ellett JD,et al.Vitamin E succinate enhances steatotic liver energy status and prevents oxidative damage following ischemia/reperfusion[J].Transplant Proc,2009,41(10): 4094-4098.doi:10.1016/j.transproceed.2009.09.055.
[10]Caraceni P,Bianchi C,Domenicali M,et al.Impairment of mitochondrial oxidative phosphorylation in rat fatty liver exposed to preservation-reperfusion injury[J].J Hepatol,2004,41(1):82-88.
[11]Lin FS,Shen SQ,Yan RC,et al.The effects of 17-β estradiol on hepatocyte apoptosis and expression of Bcl-2 and Bax in the liver-resected-rats with ischemia reperfusion injury[J].Chin J Hepatobiliary Surg,2012,18(3):215-219.[林福生,沈世强,闫瑞承,等.17-β雌二醇对大鼠肝切除肝缺血再灌注损伤肝细胞凋亡和Bcl-2、Bax表达的影响[J].中华肝胆外科杂志,2012,18(3):215-219]. doi:10.3760/cma.j.issn.1007-8118.2012.03.016.
[12]Sun JP,Liu JH.Recent advance of Apaf-1,Caspase-9 and apoptotic mechanisms[J].Chin J General Practice,2013,11(7):1102-1104.[孙军培,刘久华.Apaf-1、Caspase-9及凋亡体调节的研究进展[J].中华全科医学,2013,11(7):1102-1104].
[13]Ola MS,Nawaz M,Ahsan H.Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J].Mol Cell Biochem,2011,351(1-2):41-58.doi:10.1007/s11010-010-0709-x.
(2015-08-03收稿 2015-08-21修回)
(本文编辑 李鹏)
Protective effects of Trimetazidine on ischemia-reperfusion injury of fatty liver in rats
WANG Tengfei1,YANG Tao2△,ZHANG Wei2,FANG Zhenyu2,WANG Honghai2,LIU Lei2,ZHANG Haiming2,
WANG Yuliang31 First Central Clinical College of Tianjin Medical University,Tianjin 300192,China;2 Tianjin First Central Hospital;3 Key Laboratory for Critical Care Medicine of the Ministry of Health△
ObjectiveTo investigate the protective effects of Trimetazidine(TMZ)on the ischemia reperfusion injury(IRI)of fatty liver in autotransplantation model.MethodsFatty liver model was established by feeding high fat diet.Male Wistar rats(n=30)were randomized into three groups;Sham group,TMZ group and Model group.Liver was autotransplanted in both TMZ group and Model group.Serum levels of ALT,SOD,MDA,Bcl-2 and activated Caspase-3 were assessed 6 hours after the operation.The pathological performances of liver were also determined.ResultsCompared with the Model group,serum levels of ALT,AST,MDA and SOD levels decreased significantly in the TMZ group(P<0.05).Serum level of Bcl-2 was higher while level of activated Caspase-3 was lower in TMZ group than those in Model group(P<0.05).Histological assay and TUNEL staining showed reduced hepatocyte swelling and narrowed sinusoid as well as decreased hepatic apoptosis in TMZ group compared with Model group.ConclusionTMZ can reduce oxidative stress,promote the expression of Bcl-2 and inhibit the activation of Caspase-3,which all contribute to its protective effect on fatty liver with ischemia-reperfusion injury.
Trimetazidine;fatty liver;reperfusion injury;apoptosis;bcl-2-associated X protein;alanine transaminase;aspartate aminotransferases;malondialdehyde;superoxide dismutase;caspase-3
R617
A
10.11958/j.issn.0253-9896.2015.12.010
天津市卫生局科技基金资助项目(2011KZ30);卫生公益性行业科研专项(201302009);国家高技术研究发展计划(863计划)(2012AA021001);国家自然科学基金资助项目(81270554)
1天津医科大学一中心临床学院(邮编300192);2天津市第一中心医院器官移植中心;3卫生部危重病急救医学重点实验室
王腾飞(1988),男,硕士研究生在读,主要从事肝移植及肝胆外科研究
△通讯作者E-mail:yangtao5588@medmail.com.cn
