TNF-α在结肠癌细胞侵袭和迁移中的作用探讨
2015-11-24赵鹏陈俊卯曹文斌杨光华虞向阳刘春辉郑阳
赵鹏,陈俊卯,曹文斌,杨光华,虞向阳,刘春辉,郑阳
TNF-α在结肠癌细胞侵袭和迁移中的作用探讨
赵鹏,陈俊卯,曹文斌,杨光华,虞向阳,刘春辉,郑阳
目的探讨肿瘤坏死因子(TNF)-α对肿瘤相关钙信号转导蛋白(TROP)-2表达的影响及其对细胞侵袭和迁移能力的影响。方法以0、10、20、30、50、100、200 μg/L的TNF-α处理人结肠癌HCT-116细胞,采用噻唑蓝(MTT)实验检测细胞存活率。采用Western blot检测TROP-2的表达量。采用划痕实验和Transwell实验检测20 μg/L TNF-α处理前后细胞侵袭和迁移能力。借助脂质体Lipofectamine™2000转染TROP-2 siRNA,实时荧光定量PCR和Western blot验证转染后TROP-2的mRNA和蛋白水平。划痕实验和Transwell实验再次检测TNF-α对转染TROP-2 siRNA细胞的侵袭和迁移能力的影响。结果0、10、20、30、50 μg/L的TNF-α处理24 h和48 h时细胞存活率差异无统计学意义。100、200 μg/L与0 μg/L比较,细胞存活率下降(P<0.05)。与TNF-α浓度为0 μg/L比较,10、20、30、50 μg/L时TROP-2的表达量均升高,20 μg/L时TROP-2的表达量最高(P<0.05);而TNF-α浓度为100、200 μg/L时TROP-2的表达量下降(P<0.05)。划痕实验和Transwell实验中,TNF-α组24 h时的细胞划痕愈合率和穿膜细胞数均较对照组增加(P<0.05)。转染TROP-2 siRNA后siRNA组中TROP-2的mRNA和蛋白水平均低于正常对照组和阴性对照组(P<0.05)。此外,siRNA组24 h时的细胞划痕愈合率和穿膜细胞数均较正常对照组下降(P<0.05)。结论低浓度炎症因子TNF-α可能通过上调TROP-2的表达来促进结肠癌HCT-116细胞的侵袭和迁移。
结肠肿瘤;肿瘤坏死因子α;肿瘤侵润;细胞运动;肿瘤相关钙信号转导蛋白-2
慢性炎症在肿瘤的发生和进展过程中起重要作用。研究认为,肿瘤坏死因子(TNF)-α主要由肿瘤相关巨噬细胞分泌,可以启动慢性炎症[1]。最新的研究发现,TNF-α具有双重作用,大剂量的TNF-α可以诱导肿瘤细胞凋亡,杀伤肿瘤细胞;而持续低剂量的TNF-α可以作为炎症因子,促进肿瘤的侵袭和转移[2]。研究认为,将肿瘤细胞与巨噬细胞共培养后,肿瘤细胞的侵袭能力增强,主要是由巨噬细胞分泌的TNF-α介导[3]。目前TNF-α促进肿瘤侵袭和转移的机制尚不清楚。肿瘤相关钙信号转导蛋白(TROP)-2在多种人类上皮源性肿瘤中均存在高表达[4];而其在正常组织中不表达或低表达,可能与肿瘤细胞的侵袭和转移密切相关[5]。本研究旨在探讨TNF-α对结肠癌HCT-116细胞中TROP-2表达的调控及其对结肠癌细胞侵袭和迁移能力的影响,分析炎症促进结肠癌侵袭和转移的可能机制。
1 资料与方法
1.1 一般资料人类结肠癌细胞株HCT-116由河北医科大学病理教研室申海涛教授惠赠,细胞冻存于液氮。鼠抗人TROP-2单克隆抗体购自美国Abcam公司,重组人TNF-α购自美国Sigma公司,脂质体LipofectamineTM2000转染试剂购自美国Invitrogen公司,McCoy’s 5A培养基购自美国Gibco公司,TROP-2 siRNA和阴性对照siRNA购自上海拜沃生物技术有限公司,基底膜基质Matrigel购自美国becton Dickinson公司,辣根过氧化物酶标记的山羊抗兔IgG购自Cell Signaling Technology。
1.2 方法
1.2.1 细胞培养人结肠癌HCT-116细胞采用McCoy’s 5A培养基培养,使用前加入10%胎牛血清和1%双抗,置入含5%CO2、37℃的孵箱内培养。
1.2.2 MTT法检测不同浓度TNF-α对结肠癌细胞增殖的影响取对数生长期的HCT-116细胞,接种于96孔培养板,分别加入含不同的浓度TNF-α(0、10、20、30、50、100、200 μg/L)的培养液,置培养箱培养24 h和48 h时,每孔中加MTT标记混合液10µL,继续培养4 h,弃上清培养液,每孔加入150µL DMSO,振荡10 min,在酶联免疫检测仪上测定波长490 nm各孔吸光度值,参照文献[6]计算细胞存活率,绘制曲线。
1.2.3 Western blot检测TNF-α对结肠癌HCT-116细胞中TROP-2表达的影响取对数生长期的结肠癌HCT-116细胞,分别加入不同浓度的TNF-α(0、10、20、30、50、100、200 μg/L),作用24 h后,提取细胞总蛋白。蛋白定量后行SDSPAGE凝胶电泳,每孔上样量为50 μg蛋白,电泳并转膜至PVDF膜,5%脱脂奶粉封闭1 h,抗TROP-2一抗4℃孵育过夜。TBST漂洗3次,加山羊抗兔二抗室温孵育2 h,增强化学发光法显色。以β-tubulin为内参。
1.2.4 细胞迁移(划痕)实验选取对数生长期的HCT-116细胞,接种于6孔培养板,融合度达80%时,用一次性100µL移液器枪尖在6孔板上划出一条直线,用无菌PBS液洗去刮下的脱离细胞,更换无血清培养基。实验中分设TNF-α组和对照组,每组设3个平行孔,实验共重复3次。TNF-α组加入终浓度为20 μg/L的TNF-α,对照组加PBS代替TNF-α,继续培养,分别于划痕后0 h、24 h给细胞拍照,随机取5个不同位置测量细胞划痕宽度,取其平均值,利用Image J 2.1图像分析软件计算划痕愈合率。
1.2.5 细胞侵袭(Transwell)实验选取对数生长期的HCT-116细胞,分设TNF-α组和对照组,TNF-α组Transwell上室中加入含20 μg/L TNF-α的单细胞悬液100µL,培养箱孵育24 h后用棉签擦去Transwell上室面的细胞,下室面的细胞使用预冷甲醇4℃固定20~30 min,放入0.1%结晶紫溶液内,37℃温箱内染色30 min,PBS液洗去多余染料,倒置显微镜(×200)下随机读取5个视野,计数下室面的细胞数,即为穿过小室的细胞数(穿膜细胞数),实验共重复3次,取其平均数。
1.2.6 RNA干扰技术沉默TROP-2基因本部分实验借助脂质体Lipofectamine™2000转染TROP-2 siRNA,沉默结肠癌HCT-116细胞中TROP-2基因,抑制TROP-2的表达。实验共分3组:正常对照组、阴性对照组和siRNA组。TROP-2siNRA序列:上游5′-CGTGGACA ACGATGGCCTCTA-3′,下游5′-GGTACGCGAGGCACACGTAC-3′,产物片段大小160 bp。siRNA control序列:上游5′-UUCUCCGAACGUGUCACGUTT-3′,下游5′-ACGUGACACG UUCGGAGAATT-3′,产物片段大小198 bp。β-actin序列:上游5′-CACGAAACTACCT TCAACTCC-3′,下游5′-CATACTCCTGCTTGCTGATC-3′,产物片段大小262 bp。按脂质体Lipofectamine™2000说明书将TROP-2 siRNA和阴性对照siRNA进行转染,48 h后进行后续实验。
1.2.7 TROP-2 siRNA转染后TROP-2的mRNA及蛋白水平的测定(1)正常对照组、阴性对照组和siRNA组中TROP-2的mRNA水平检测。采用实时荧光定量PCR法,TROP-2 siRNA转染48 h后收集细胞,提取细胞总RNA。取灭菌无RNA酶的EP管,首先配制MixⅠ(Total RNA 5µL,50µmol/L oligodt 0.5µL,Random primer 0.5µL,10 mmol/L dNTP Mix 1µL,DEPC-treated water 5µL)。把MixⅠ置于65℃温浴中5 min,然后立即放入冰水中1 min。在MixⅠ里加入(5×First-Strand Buffer 4µL,0.1 mol/L Dtt 2µL,40 U/µL RNase OUT 1µL,Super ScripⅢRT 1µL,MixⅠ12µL),得到反应体系MixⅡ共20µL。混匀后进行下一步反应:5℃处理5 min;50℃处理60 min;70℃处理15 min;立即放到冰上。反转录反应50℃30 min,PCR初始变性95℃2 min,40个循环,95℃10 s,60℃30 s,70℃延伸30 s。实验中每个样品重复3次,基因的相对表达量采用2-△△Ct表示。(2)正常对照组、阴性对照组和siRNA组中TROP-2水平的检测,基本方法同1.2.3。
1.2.8 转染TROP-2 siRNA对结肠癌HCT-116细胞迁移和侵袭能力的影响分设正常对照组和TROP-2 siRNA组,培养24 h,方法同1.2.1。采用划痕和Transwell实验检测2组细胞的迁移和侵袭能力,方法同1.2.4和1.2.5。
1.3 统计学方法采用SPSS 17.0统计学软件进行统计分析。符合正态分布的计量数据以均数±标准差()表示,2组样本均数比较采用t检验;多组间均数比较采用单因素方差分析,组间多重比较采用SNK-q法,以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度TNF-α对结肠癌HCT-116细胞增殖的影响不同浓度TNF-α处理24 h和48 h时细胞存活率的差异有统计学意义(均P<0.05),其中低浓度TNF-α(10、20、30、50 μg/L)处理24 h和48 h时细胞存活率与0 μg/L比较差异均无统计学意义(P>0.05)。高浓度TNF-α(100、200 μg/L)较0 μg/L存活率下降,差异有统计学意义(P<0.05),见图1。
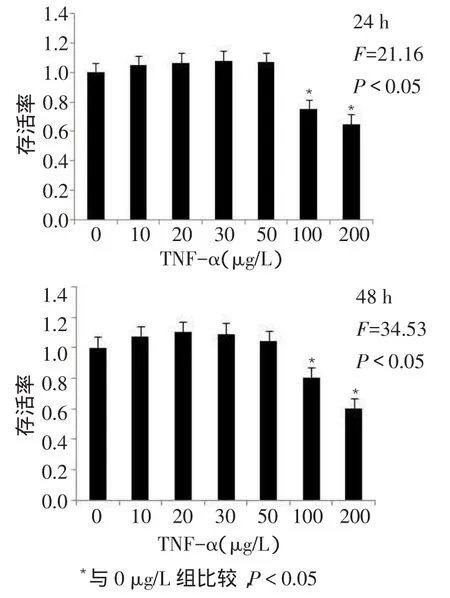
Fig.1The proliferative change of HCT-116 cells with TNF-α treatment for 24 h or 48 h图1 不同作用时间,不同浓度TNF-α对结肠癌HCT-116细胞存活率的影响
2.2 TNF-α对结肠癌HCT-116细胞TROP-2表达的影响不同浓度的TNF-α(0、10、20、30、50、100及200 μg/L)处理后结肠癌HCT-116细胞中TROP-2的相对表达量分别为1.12±0.31、1.83±0.28、2.16± 0.48、1.92±0.18、1.55±0.26、0.80±0.18及0.52±0.15(F=17.28,P<0.05),其中低浓度(10、20、30及50 μg/L)TNF-α处理时,TROP-2的表达量较0 μg/L均升高,以浓度20 μg/L时TROP-2表达量最高;而高浓度(100、200 μg/L)TNF-α处理时TROP-2的表达量较0 μg/L下降(均P<0.05),见图2。
2.3 TNF-α对结肠癌HCT-116细胞迁移和侵袭能力的影响TNF-α组24 h时的划痕愈合率高于对照组[(55.35±4.16)%vs(15.28±2.37)%,t=12.43,P< 0.01],见图3。TNF-α组中结肠癌HCT-116细胞的穿膜细胞数高于对照组[(237.2±28.4)个vs(85.8± 14.3)个,t=8.642,P<0.05],见图4。

Fig.2The expression of TROP-2 in HCT-116 cells with addition of different concentration of TNF-α图2 不同浓度TNF-α处理后结肠癌HCT-116细胞中TROP-2的表达情况

Fig.3The migratory capability of HCT-116 cells upon TNF-α treatment(×100)图3 TNF-α对结肠癌HCT-116细胞迁移能力的影响(×100)
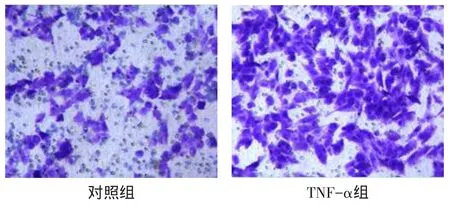
Fig.4The invasive capability of HCT-116 cells upon TNF-α treatment(Crystal violet,×200)图4 TNF-α对结肠癌HCT-116细胞侵袭能力的影响(结晶紫染色,×200)
2.4 TROP-2 siRNA对HCT-116细胞TROP-2的mRNA和蛋白的影响siRNA组TROP-2的mRNA和TROP-2蛋白表达水平均低于阴性对照组和正常对照组(P<0.05),见表1、图5。
2.5 TNF-α对转染TROP-2 siRNA的结肠癌HCT-116细胞迁移和侵袭能力的影响对照组24 h时的细胞划痕愈合率(48.58±4.39)%高于TROP-2 siRNA组的(19.34±5.18)%(t=9.63,P<0.01),见图6。TROP-2 siRNA组的穿膜细胞数(106.4±17.6)个低于对照组的穿膜细胞数(266±25.4)个(t=22.64,P<0.05),见图7。
Tab.1Comparison of TROP-2 expression and transcription levels in three groups表1 3组中TROP-2的mRNA和蛋白表达水平的比较(n=3)
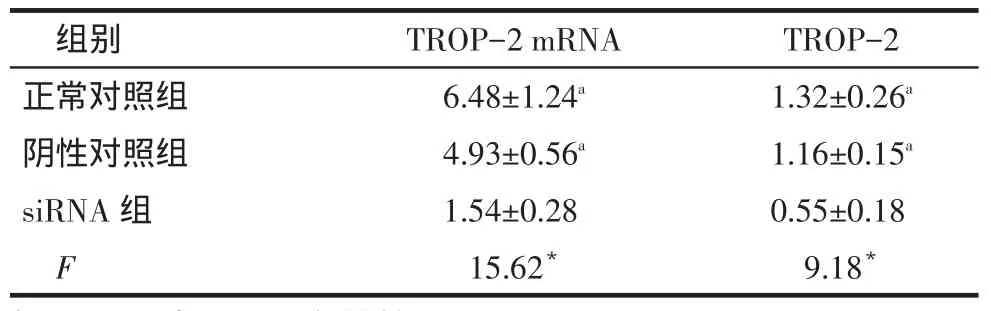
Tab.1Comparison of TROP-2 expression and transcription levels in three groups表1 3组中TROP-2的mRNA和蛋白表达水平的比较(n=3)
*P<0.05;a与siRNA组比较,P<0.05
组别正常对照组阴性对照组s i R N A组F T R O P -2 m R N A 6 . 4 8 ± 1 . 2 4a4 . 9 3 ± 0 . 5 6a1 . 5 4 ± 0 . 2 8 1 5 . 6 2*T R O P -2 1 . 3 2 ± 0 . 2 6a1 . 1 6 ± 0 . 1 5a0 . 5 5 ± 0 . 1 8 9 . 1 8*
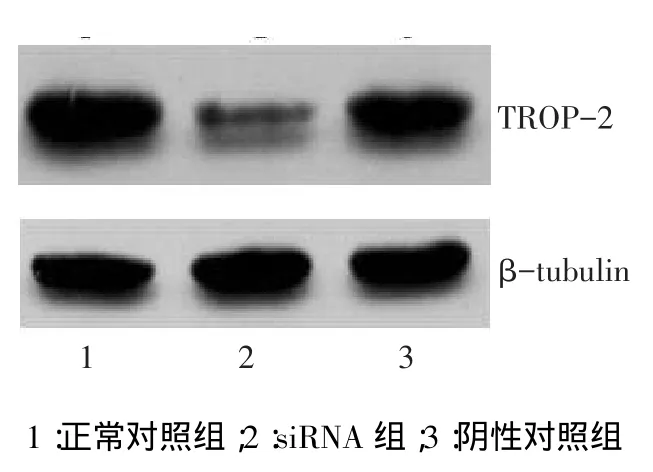
Fig.5The expression of TROP-2 protein in HCT-116 cells transfected with TROP-2siRNA图5 转染TROP-2 siRNA后HCT-116细胞中TROP-2的表达情况

Fig.6The migratory capability of HCT-116 cells upon TNF-α treatment after silencing TROP-2(×100)图6 TNF-α对沉默TROP-2的结肠癌HCT-116细胞迁移能力的影响(×100)
3 讨论
TROP-2是一种跨膜糖蛋白。最新研究表明,卵巢癌、结肠癌及膀胱癌等多种人类上皮源性肿瘤(如胃癌、胰腺癌等)中存在TROP-2的高表达,TROP-2与肿瘤的侵袭和转移密切相关,其高表达往往与不良预后相关[7-8]。然而,肿瘤中TROP-2高表达的机制目前尚不清楚,揭示TROP-2高表达的机制有望为肿瘤的早期诊断和治疗提供新方向。
目前,肿瘤炎症微环境为国内外学者研究的热点。有学者把肿瘤相关性炎症称为肿瘤的第七种特征[9]。炎症微环境与肿瘤的发生和发展关系密切,但有关其在肿瘤的侵袭和转移过程中的具体机制仍不清楚。TNF-α是肿瘤炎症微环境中的一种重要炎症细胞因子,其促进肿瘤侵袭和转移的具体机制目前仍不清楚。有研究发现,在乳腺癌中TNF-α能够激活转录因子AP-1,上调血管内皮生长因子的表达,促进肿瘤新生血管的形成,从而促进肿瘤转移[10]。TNF-α还能够通过上调口腔癌细胞的基质金属蛋白酶的表达来促进肿瘤细胞的侵袭和转移[11]。Szlosarek等[12]研究发现,TNF-α能够通过调节CD44的表达来促进肿瘤的侵袭和转移。因此,笔者推测在结肠癌中炎症因子TNF-α有可能通过上调TROP-2的表达,进而促进结肠癌的侵袭和转移。本实验旨在从细胞水平对这一假设进行验证。
MTT实验结果显示,低浓度TNF-α(10、20、30、50 μg/L)处理24 h和48 h时细胞存活率与0 μg/L比较差异均无统计学意义,高浓度TNF-α(100、200 μg/L)较0 μg/L存活率下降;Western blot实验结果显示,低浓度(10、20、30及50 μg/L)TNF-α处理时,TROP-2的表达量较0 μg/L均升高,以浓度20 μg/L时TROP-2表达量最高;而高浓度(100、200 μg/L)TNF-α处理时TROP-2的表达量较0 μg/L下降,证实了TNF-α对结肠癌细胞有双重作用,低浓度TNF-α可以上调结肠癌细胞TROP-2的表达,而高浓度TNF-α可以下调TROP-2的表达,这与Colotta等[9]的研究相一致,考虑可能机制为高浓度TNF-α可以产生细胞毒性作用,抑制了结肠癌HCT-116细胞的增殖,导致细胞存活率下降,从而导致TROP-2表达下降。

Fig.7The invasive capability of HCT-116 cells upon TNF-α treatment after silencing TROP-2(Crystal violet,×200)图7 TNF-α对沉默TROP-2的结肠癌HCT-116细胞侵袭能力的影响(结晶紫染色,×200)
细胞划痕实验和Transwell实验结果显示,给予低浓度(20 μg/L)TNF-α处理后结肠癌HCT-116细胞的划痕愈合率较对照组升高,穿膜迁移细胞数亦增加,表明低浓度TNF-α增强了结肠癌HCT-116细胞的侵袭和迁移能力。为了进一步验证低浓度TNF-α是否通过上调TROP-2的表达来促进结肠癌
细胞的侵袭和迁移,本实验中又采用RNA干扰技术,转染TROP-2 siRNA沉默TROP-2基因,从而抑制TROP-2的表达。实时荧光定量PCR和Western blot结果显示,TROP-2 siRNA组TROP-2的mRNA及蛋白水平较对照组均降低,表明实验转染成功。用同样浓度(20 μg/L)TNF-α处理TROP-2 siRNA组的HCT-116细胞,细胞划痕及Transwell实验结果显示,与正常对照组相比,TROP-2 siRNA组的细胞划痕愈合率和穿膜迁移细胞数均减少,表明沉默TROP-2基因,抑制TROP-2表达后,TNF-α则不能增强HCT-116细胞的侵袭和迁移能力,提示低浓度炎症因子TNF-α是通过上调TROP-2的表达,进而增强结肠癌HCT-116细胞的侵袭和迁移能力的。
综上所述,炎症因子TNF-α通过上调肿瘤细胞中TROP-2的表达来促进肿瘤的侵袭和转移,这为进一步研究结肠癌侵袭和转移的分子机制提供了理论基础,也为结肠癌的临床治疗提供了新的靶点和理论依据。
[1]Calcinotto A,Grioni M,Jachetti E,et al.Targeting TNF-a to neoangiogenic vessels enhances lymphocyte infiltration in tumors and increases the therapeutic potential of immunotherapy[J].J Immunol,2012,188(6):2687-2694.doi:10.4049/jimmunol.1101877.
[2]Ikemoto S,Sugimura K,Yoshida N,et al.TNF alpha,IL-1 beta and IL-6 production by peripheral blood monocytes in patients with renal cell carcinoma[J].Anticancer Res,2000,20(1A):317-321.
[3]Wu Y,Deng J,Rychahou PQ,et al.Stabilization of snail by NF-kappa B is required for inflammation-induced cell migration and invasion[J]. Cancer Cell,2009,15(5):416-428.doi:10.1016/j.ccr.2009.03.016.
[4]Cubas R,Li M,Chen C,et al.Trop2:A possible therapeutic target for late stage epithelial carcinomas[J].Biochim Biophys Acta,2009,1796(2):309-314.doi:10.1016/j.bbcan.2009.08.001.
[5]Stepan LP,Trueblood ES,Hale K,et al.Expression of Trop2 cell surface glycoprotein in normal and tumor tissues:potential implications as a cancer therapeutic target[J].J Histochem Cytochem,2011,59(7):701-710.doi:10.1369/0022155411410430.
[6]Shen FF,Guo R,Zhao SP.Effects of mitochondrial fission in proliferation,apoptosis and invasion of thyroid squamous[J].Tianjin Med J,2015,43(2):129-133.[申菲菲,郭睿,赵树鹏.线粒体分裂在甲状腺鳞癌SW579细胞增殖、凋亡以及侵袭中的作用[J].天津医药,2015,43(2):129-133].doi:10.11958/j.issn.0253-9896.2015.02.005.
[7]Fong D,Moser P,Gostner JM,et al.High expression of TROP2 correlates with poor prognosis in pancreatic cancer[J].Br J Cancer,2008,99(8):1290-1295.doi:10.1038/sj.bjc.6604677.
[8]Muhlmann G,Spizzo G,Gostner J,et al.TROP2 expression as prognostic marker for gastric carcinoma[J].J Clin Pathol,2009,62(2): 152-158.doi:10.1136/jcp.2008.060590.
[9]Colotta F,Allavena P,Garlanda C,et al.Cancer related inflammation,the seventh hallmark of cancer:links to genetic instability[J].Carcinogenesis,2009,30(7):1073-1081.doi:10.1093/carcin/bgp127.
[10]Yin YM,Shu YQ,Chen XF,et al.Tumor necrosis factor-a regulates expression of vascular endothelial growth factor via JNK and AP-1 pathway in MCF-7 cells[J].Chin J Cancer Biother,2009,16(1):12-17.[殷咏梅,束永前,陈晓锋,等.TNF-α通过JNK和AP-1途径调节乳腺癌MCF-7细胞VEGF的表达[J].中国肿瘤生物治疗杂志,2009,16(1):12-17].doi:10.3872/j.issn.1007-385X.2009.01.004.
[11]Gao ZL,Yang CC,Xu XH,et al.Experimental study on TNF-a promoting invasion and metastasis of oral cancer cells by regulating MMPs[J].Stomatology,2014,34(1):9-12.[高振林,杨聪翀,许小会,等.TNF-α调控基质金属蛋白酶促口腔癌细胞侵袭转移的实验研究[J].口腔医学,2014,34(1):9-12].
[12]Szlosarek PW,Balkwill FR.Tumour necrosis factor alpha:a potential target for the therapy of solid tumours[J].Lancet Oncol,2003,4(9):565-573.doi:10.1016/S1470-2045(03)01196-3.
(2015-05-21收稿 2015-08-07修回)
(本文编辑 陆荣展)
Role of TNF-α in promoting migration and invasion of colon cancer cells
ZHAO Peng,CHEN Junmao,CAO Wenbin,YANG Guanghua,YU Xiangyang,LIU Chunhui,ZHENG Yang
Department of General Surgery,North China University of Science and Technology Affiliated Hospital,Tangshan 063000,China
ObjectiveTo explore the effect of TNF-α on expression of TROP-2 and to explore the role of TROP-2 in the metastasis and invasion of colon cancer HCT-116 cells.MethodsHCT-116 cells were cultured and treated with 0,10,20,30,50,100 and 200 μg/L TNF-α.Cell viability was assessed by MTT.The expression of TROP-2 was determined by western blot.The effects of 20 μg/L TNF-α on cell migration and invasion were investigated by wound healing assay and Transwell method.Small interfering RNA(siRNA)was used to knock down endogenous TROP-2 expression.The transcription and translation levels of TROP-2 were detected by qPCR and Western blot respectively.The migratory and invasive capability of HCT-116 cells transfected with TROP-2 siRNA were checked by wound healing assay and Transwell method respectively.ResultsThere is no significant change of cell viability between HCT-116 cells treated with 0,10,20,30 and 50 μg/L TNF-α,but cell viability of HCT-116 decreased significantly with treatment of 100 μg/L and 200 μg/L TNF-α.Low concentration of TNF-α(≤50 μg/L)led to increase of TROP-2 protein expression that peaks when 20 μg/L TNF-α was added.High concentration of TNF-α(100,200 μg/L)result in decrease of TROP-2 protein.TROP-2 siRNA significantly downregulated the expression of TROP-2 at both mRNA and protein levels in colon cancer HCT-116 cells.Compared with control group,silencing TROP-2 by TROP-2 siRNA inhibited the migratory and invasive capability of HCT-116 cells.Wound healing rate and the number of transwell cell both decreased in siRNA group compared with those of control group(P<0.05).ConclusionThe mechanism that low concentration of TNF-α promoted HCT-116 cells migration and invasion might be through up-regulating the expression of TROP-2.
colonic neoplasms;tumor necrosis factor-alpha;neoplasm invasiveness;cell movement;TROP-2
R735.3
A
10.11958/j.issn.0253-9896.2015.12.007
河北唐山,华北理工大学附属医院普外科(邮编063000)
赵鹏(1977),男,副主任医师,博士,主要从事消化道肿瘤的基础与临床研究
