外泌体在疾病诊断和药物递送系统中的应用研究进展
2015-11-24刘佳凡杨莉洪岸王晓刚
刘佳凡,杨莉,洪岸,王晓刚
(暨南大学生物医药研究院,广东 广州 510632)
·前沿与进展·
外泌体在疾病诊断和药物递送系统中的应用研究进展
刘佳凡,杨莉,洪岸,王晓刚*
(暨南大学生物医药研究院,广东 广州 510632)

外泌体是直径为30~100 nm的内吞衍生囊泡,由多种活细胞分泌,含有大量的与其来源和功能密切相关的蛋白质、脂质和RNA分子,可以在细胞间传递。已有研究表明癌症患者血液中的外泌体浓度比正常人高,且其中包含癌症标志分子,因此其有潜力成为疾病诊断的生物标志物。此外,作为一种天然的物质运输载体,外泌体已经被作为一种新型的药物递送系统,用于肿瘤及阿尔茨海默病等疾病的治疗。对外泌体作为疾病诊断标记物以及药物递送载体的研究进展进行综述。
外泌体;生物标志物;药物递送系统
近年来的癌症研究中,药物载体特别是纳米级的药物载体,由于其具有可包载疏水性药物、提高药物生物利用度、可特异性修饰和靶向递送等特点,已成为研究热点。例如脂质体、微粒、纳米粒等已得到广泛研究[1-2]。而来源于细胞或生物体自身的天然载体外泌体(exosomes),可以从病人自身获得,从而可极大地减小载体自身的毒性及免疫原性,另外,外泌体作为一种膜结构载体,能够通过其表面的膜蛋白与靶细胞膜融合,从而将其负载的药物直接运送到受体细胞中,避免了细胞吞噬-溶酶体途径带来的药物降解及细胞毒性等问题。因此,外泌体作为一种新型药物载体获得了广泛关注。此外,许多研究表明外泌体最重要的生物利用价值之一是其作为生物标志物在疾病诊断方面的应用,和传统的诊断方法如单纯检测血清和尿液中的分子指标相比,外泌体中的生物标志物具有很高的特异性和灵敏性。本文对外泌体作为疾病诊断标记物以及药物递送载体的研究进展进行综述,旨在为其深度开发提供参考。
1 外泌体的产生和组成成分
外泌体来源于晚期内吞体(也称多囊泡体,multivesicular bodies,MVB)的囊泡,是细胞内吞泡膜向内凹陷形成含有多个小囊泡的多囊泡体,这种多囊泡体与细胞膜融合,释放到细胞外基质中的一种直径约30~100 nm的膜性囊泡[3]。外泌体最早由Johnstone等[4]在研究网织红细胞向成熟红细胞转变过程中发现。后来研究发现,不仅网织红细胞能释放这种小囊泡,几乎所有类型的活细胞都能分泌。
外泌体主要由蛋白质、脂质和核酸(mRNA,miRNA等)组成。外泌体的组成与其细胞来源有关,不同细胞来源的外泌体所含具体成分不尽相同。普遍存在的蛋白包括:胞质蛋白,如微管蛋白、三聚体G蛋白等;膜蛋白,如:四跨膜蛋白、溶酶体蛋白(Lamp2b)、热休克蛋白(hsp70,hsp90)等[5]。此外一些细胞来源的外泌体中还在其质膜上携带有MHC I和II类分子[6-7],如B细胞、T细胞、肿瘤细胞等。另一类是特异性蛋白质,只存在于特定细胞来源的外泌体,如肾癌细胞源性外泌体富含肾癌特异性抗原G250[8],人鼻咽癌来源的外泌体含LMP1,研究表明这些蛋白能促进癌细胞逃避宿主免疫[9]。
外泌体中除了蛋白质外,还包含其他多种成分,如脂质。目前临床学者对外泌体脂质的研究仍不充分,但是已经证实其主要成分为神经鞘磷脂及磷脂酰丝氨酸等。此外,Valadi等[10]首先提出小鼠和人的肥大细胞衍生出的外泌体中存在RNA,一些类型的RNA(如mRNA和miRNA)可以从外泌体腔内被分泌出来,这些mRNA在体外翻译实验中能翻译成蛋白质而发挥作用。此外,有大量的研究集中于生理及病理条件下外泌体中miRNA的变化,以表征机体的生理状况[11-13]。
2 外泌体的生物学功能
首先,外泌体参与细胞间的物质运输和信号传递。Ludwig等[14]提出,外泌体可以通过膜融合的方式将内容物释放到靶细胞中,以参与细胞间的通讯。如某些细胞来源的外泌体中含有参与信号通路的蛋白β-catenin、WNT5B以及mRNA、miRNA等,这些内含物可被外泌体转运至靶细胞来调控靶细胞的基因表达。Vlassov等[15]通过对肝癌细胞及其分泌的外泌体中miRNA的检测,发现存在于外泌体中的11种miRNA可能靶向TAK1、TAB2基因,以利于肿瘤细胞的生存。该研究揭示了外泌体分泌的miRNA通过细胞间通讯从而调控肝癌的一个重要机制。
其次,外泌体具有免疫调节功能。外泌体中含有大量免疫相关分子,如抗原呈递分子MHC I和II类分子、热休克蛋白等。最初,Raposo等[16]发现由B细胞分泌的外泌体可以抗原特异性的方式激活CD4+T细胞,从而发现了外泌体的免疫学应用价值。后来,经多组实验证实,树突细胞、肥大细胞和肿瘤细胞来源的外泌体均可产生抗肿瘤免疫反应(见表1)。
另外,外泌体还具有排泄细胞内蛋白质的作用。在Johnstone等[4]的研究中,网织红细胞会将不需要的质膜蛋白,如转铁蛋白受体排出细胞,从而达到清除的目的。而在此过程中,外泌体则作为运出这些废弃蛋白的载体。随后有研究表明,细胞内某些不能被降解的物质以及一些新陈代谢的产物,可以通过外泌体排出细胞。
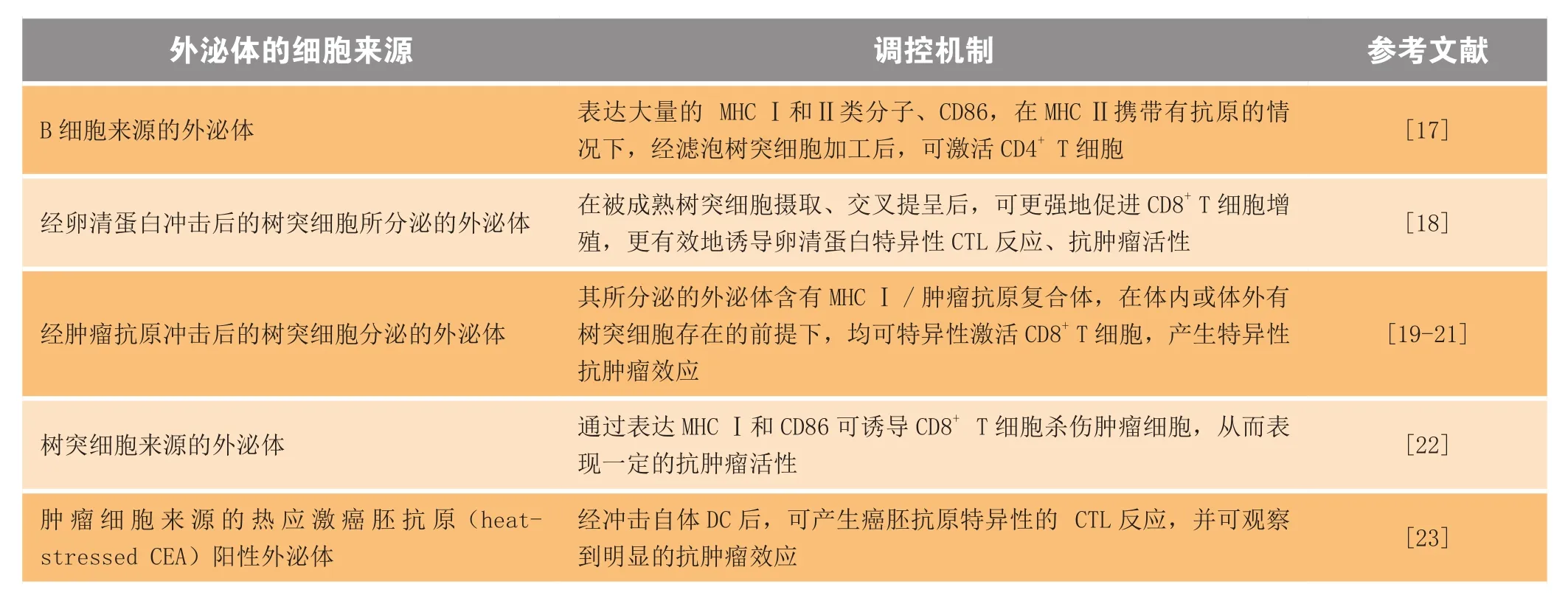
表1 不同细胞来源的外泌体的免疫调节功能Table 1 Immune modulatory functions of exosomes from different cells

续表1
3 外泌体用作疾病诊断的生物标志物
细胞在正常和病理条件下都能分泌外泌体,外泌体中的核酸和蛋白质能够表征一定的生理病理状况。目前外泌体的内容物已经被广泛作为一种重要的生物标志物用于临床上的疾病诊断。此外,外泌体易于从体液如血液和尿液中分离,这更为其作为诊断候选物提供了便利。
3.1 外泌体中蛋白作为诊断标志物
外泌体中含有多种类型的蛋白质,包括膜蛋白和胞浆蛋白,这些蛋白在一定程度上可以反映出细胞的功能和状况。目前,已发现多种外泌体蛋白可以作为疾病诊断的潜在标志分子,如癌症、肝病、肾病等。
在中枢神经系统疾病的诊断中,已发现大量的潜在标志蛋白分子。Skog等[26]的研究表明表皮生长因子vIII(EGFRvIII)在成胶质细胞瘤患者血清外泌体中的表达量上升。Graner等[27]指出脑癌患者的血清外泌体中含有EGFR、EGFRvIII和TGF-β。另外,在帕金森病中起重要作用的α-synuclein可以在外泌体中被检测到[28]。因此,外泌体中的EGFRvIII、TGF-β以及α-synuclein可以作为中枢神经系统疾病诊断的潜在标志分子。
外泌体中富含跨膜蛋白超家族,如CD63。Logozzi等[29]报道过黑色素瘤患者血浆中的CD63+外泌体比正常人高。之后,Yoshioka等[30]通过分析比较不同类型的癌症患者外泌体中标志蛋白的表达量,发现恶性肿瘤细胞分泌的外泌体中CD63比正常细胞的表达量要高,这进一步表明外泌体表面的CD63或可作为癌症诊断的蛋白标志物。此外,Welker等[31]提出,外泌体表面的CD81在慢性C型肝炎中的表达量上升,且可能与炎症和纤维化有关,这表明外泌体表面的CD81可以作为慢性C型肝炎诊断和治疗的潜在标志物。
3.2 外泌体中核酸作为诊断标志物
自从Valadi等[10]在2007年报道外泌体中含有RNA后,人们对外泌体中RNA的研究兴趣与日俱增,特别是对外泌体的miRNA作为诊断标志物的研究。外泌体中的miRNA可以免于RNA酶的降解,从而能在血液中循环[11,32-33],为其用作临床诊断的分子标志物奠定了基础。
外泌体中的miRNA经常被用于癌症诊断标志物的研究。Taylor等[11]研究了8种miRNA在卵巢癌组织切片以及血清外泌体中的表达量,与健康人相比发现其表达量上升,这表明外泌体的miRNA可以作为卵巢癌活体组织切片性能分析的一个参数。Brase等[12]研究指出,血清外泌体中的miR-141和miR-375与前列腺癌的肿瘤生长有关,因此,可以将miR-141和miR-375用于前列腺癌的诊断。此外,外泌体中的miR-21与初级食管癌的生长和侵染有关[13],因此外泌体中的miR-141、miR-375、miR-21等可以作为癌症诊断的标志分子。
除了外泌体的miRNA,一些研究表明外泌体中的mRNA也可作为潜在的临床诊断分子[34-35]。研究人员证实了两种mRNA:PCA-3和TMPRSS2,可以作为诊断前列腺癌的生物标志物。总之,外泌体的内含物作为疾病检测的标志分子,可以监控疾病的恶化程度和疗效,有望成为多种疾病的诊断标志物[36-37]。
4 外泌体在药物递送系统中的应用
近年来,将外泌体用于疾病治疗逐渐成为外泌体应用研究的一大热点。不断有研究提出将外泌体作为药物载体用于疾病治疗的设想。如Tan等[38]提出,外泌体可作为纳米治疗诊断的递送载体用于基因治疗。构建一个有效的外泌体药物递送系统,需要对其不同的组分进行适当的改造和修饰,以达到预期的效果。
4.1 用于药物递送系统的外泌体的细胞来源
几乎所有的活细胞都能产生外泌体,在构建一个有效的外泌体药物递送系统时,首先要找到最优的供体细胞类型。供体细胞产生的外泌体应该缺乏免疫原性以避免炎症反应,且这些外泌体在运输过程中是稳定的,以便有足够的时间递送药物。迄今为止,已有许多类型的细胞被作为外泌体的供体细胞,其中最为典型的是模型细胞系HeLa和HEK-293,它们作为外泌体的供体细胞被应用于许多研究中[39-45],另外,在一些研究中,不同类型的小鼠黑素瘤细胞系,如B16-F10、B16-BL6等也被用于分离外泌体,如在Takahashi等[46]的研究中。
Yin等[47]研究发现,未成熟的树突状细胞是外泌体的一种理想供体细胞。未成熟的树突状细胞特殊的膜表面蛋白组成,使其具有抗炎症特性,但是由于未成熟树突状细胞产生的外泌体的量不能满足需要,尚不适于临床应用。而骨髓间充质干细胞(MSC)能产生大量外泌体,在一些研究中被用作外泌体的供体细胞,如Yeo等[48]进行的研究。然而,由于MSC源性的外泌体有促肿瘤特性[49],所以在用MSC作为外泌体供体细胞用于肿瘤治疗时需谨慎。
4.2 外泌体可递送的药物类型
外泌体可用于装载多种药物,已有研究证明,药物在被外泌体递送到特定靶组织后呈现出一定的治疗效果。作为一种天然的物质运输载体,外泌体已经被开发运用于核酸类药物及其他一些小分子药物的靶向递送。
4.2.1 siRNA 小分子干扰RNA(siRNA)是一种基因治疗药物,但是由于siRNA在循环系统中会被降解,稳定性很低,用外泌体递送siRNA也许能够解决药物被降解的问题。许多研究已经证实外泌体能成功递送siRNA。Wahlgren等[50]的研究表明,体外实验中源于细胞和血浆的外泌体可以有效地递送MAKP1-siRNA到受体外周血单核细胞,致使体外特定基因沉默;Shtam等[51]用类似的方法递送RAD51-siRNA和RAD52-siRNA到纤维素肉瘤细胞来诱导两个基因沉默,从而抑制该细胞的生存和增殖。
在Alvarez-Erviti等[52]的研究中,为了提高外泌体的靶向性,经过人工改造,使树突状细胞分泌的外泌体上的膜蛋白Lamp2b连接上一个神经元特异性RVG多肽,从而使富含siRNA的外泌体能顺利地靶向递送到特定神经细胞,导致GAPDH和老年痴呆症相关基因BACE1的表达下调。可见,用外泌体递送siRNA用于疾病治疗是一大可行且十分有效的策略。
4.2.2 miRNA 外泌体自身携带miRNA,且利用外泌体递送小核酸药物miRNA已有成功的案例。Xin等[53]研究发现,体外实验中源于MSC的富含miR-133b的外泌体可以提高神经突触的生长水平,表明MSC源性外泌体可以用于大脑局部缺血的治疗;Chen等[54]的研究表明,miR-214可以通过外泌体穿梭到肝星状细胞,造成结缔组织生长因子(CCN2)表达的降低,从而抑制肝脏纤维化。
大多数类型的肿瘤细胞都以miRNA的异常表达为特征。MSC源性的外泌体中miR-146b高表达,而在多形性胶质母细胞瘤(GBM)的移植瘤模型中,miR-146能抑制肿瘤生长,因此一些研究中将外泌体的药物递送作用和miRNA的治疗作用结合起来[55-56]。在另外一些研究中,HEK293细胞源性的外泌体被用于递送肿瘤抑制性miRNA——miR-143和let-7,分别用于抑制前列腺癌和乳腺癌[57-58]。
4.2.3 小分子化合物 最近一些研究为装载小分子药物进入外泌体的可能性提供了证据。阿霉素(Dox)是临床上广泛应用的一种抗肿瘤药物,体内实验中,Dox被载入外泌体或者外泌体类似纳米囊泡中,并用于乳腺癌和结肠腺癌异植瘤模型动物的治疗[59]。利用未成熟树突状细胞衍生的外泌体靶向递送Dox到肿瘤组织,Dox的治疗效果显著提高,且对心脏等器官的伤害小。可见,外泌体不仅能靶向递送药物,其对药物的包裹还能降低药物的毒副作用。
外泌体还可以包载姜黄素,提高其溶解性和体内生物利用度[60];基于外泌体包裹药物的稳定性和抗炎症的特点,研究人员将STAT3抑制剂JSI-124(葫芦素Ⅰ)装载到外泌体中,并用于治疗多形性成胶质细胞瘤(GBM)模型鼠,结果表明其能有效抑制肿瘤生长[61];外泌体还可以通过携带自杀性mRNA和胞嘧啶脱氨酶来抑制神经鞘瘤的生长[62]。
5 结语与展望
近年来,外泌体作为疾病诊断的生物标志物和疾病治疗中的药物递送系统已成为研究热点。目前,外泌体中作为疾病诊断的生物标志物的物质主要是核酸和蛋白,在后续研究中脂质也有望成为疾病诊断的生物标志物。由于外泌体中的分子网络复杂,例如同一种核酸或蛋白在不同的疾病中表达量不一样,因此外泌体作为疾病诊断的生物标志物仍处于早期研究阶段,要使其应用于临床诊断,还有待进一步的研究和探索。
外泌体负载药物的方法主要有电穿孔法和脂质体转染法,但是药物包封率低,另外还可以用基因工程的方法,但是周期长,成本高,且并非所有药物都能表达。在未来研究中,我们可以通过找到负载目的药物(miRNA/siRNA)的天然外泌体,或者运用一些物理学方法,如增强外泌体膜的疏水性,以达到高效负载药物的目的。已有研究证实,30~100 nm的纳米粒是可以被有效靶向的,已研制出了许多类型的纳米靶向制剂,成功实现了药物的靶向递送,但目前外泌体的细胞来源多样,靶向性传递物质的机制尚不明确。因此,需要深入研究增强外泌体靶向性的方法,例如可以利用配体与受体结合的原理,在外泌体上连接特殊的靶向引导分子,使其靶向受体细胞;也可以利用仿生学原理,找到靶向性高的天然来源外泌体。总之,外泌体作为疾病诊断的生物标志物和疾病治疗中的药物递送系统的研究前景广阔,如何实现其在临床上的最大潜在应用价值仍需研究者的共同努力。
[1]Bysell H, Mansson R, Hansson P, et al. Microgels and microcapsules in peptide and protein drug delivery[J]. Adv Drug Deliv Rev, 2011, 63(13 ):1172-1185.
[2]Tan M L, Choong P F, Dass C R. Recent developments in liposomes,microparticles and nanoparticles for protein and peptide drug delivery[J]. Peptides, 2010, 31(1): 184-193.
[3]Record M, Subra C, Silvente-Poirot S, et al. Exosomes as intercellular signalosomes and pharmacological effectors[J].Biochem Pharmacol,2011 (81): 1171-1182.
[4]Johnstone R M, Adam M, Hammond J R, et al. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes)[J]. J Biol Chem, 1987, 262 (19): 9412-9420.
[5]Conde-Vancells J, Rodriguez-Suarez E, Embade N, et al. Characterization and comprehensive proteome profling of exosomes secreted by hepatocytes[J]. Proteome Res, 2008 (7): 5157-5166.
[6]Richard W, Rachel S L, Peter T M, et al. Proteomic and biochemical analyses of human B cell-derived exosomes [J]. J Biol Chem, 2003,278(13): 10963-10972.
[7]Nicolas B, Danielle L, Florence F, et al. TCR activation of human T cells induces the production of exosomes bearing the TCR /CD3/ ζ complex[J]. J Immunol, 2002, 168(7): 3235-3241.
[8]Zhang Y, Luo C L, He B C, et al. Exosomes derived from IL-12-anchored renal cancer cells increase induction of specific antitumor response in vitro: a novel vaccine for renal cell carcinoma[J]. Int J Oncol, 2010, 36(1): 133-140.
[9]Xiu F M, Cao X T. Exosome in the immune response and tolerance[J]. J Microbiol Immunol, 2004, 2(4): 231-235.
[10]Valadi H, Ekström K, Bossios A, et al. Exosome mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J]. Nat Cell Biol, 2007 (9): 654-659.
[11]Taylor D D, Gercel-Taylor C. MicroRNA signatures of tumor-derived exosomes as diagnostic biomarkers of ovarian cancer[J]. Gynecol Oncol,2008, 110(1):13-21.
[12]Brase J C, Johannes M, Schlomm T, et al. Circulating miRNAs are correlated with tumor progression in prostate cancer[J]. Int J Cancer,2011, 128(3): 608-616.
[13]Tanaka Y, Kamohara H, Kinoshita K,et al. Clinical impact of serum exosomal microRNA-21 as a clinical biomarker in human esophageal squamous cell carcinoma[J]. Cancer, 2013, 119(6): 1159-1167.
[14]Ludwig A K, Giebel B. Exosomes: small vesicles participating in intercellular communication[J]. Int J Biochem Cell Biol, 2012(44): 11-15.
[15]Vlassov A V, Magdaleno S, Setterquist R, et al. Exosomes: current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials[J]. Biochim Biophys Acta, 2012, 1820(7):940-948.
[16]Raposo G, Nijman H W, Stoorvogel W, et al. B lymphocytes secreteantigen-presenting vesicles[J]. J Exp Med, 1996, 183(3): 1161-1172.
[17]Clayton A, Court J, Navabi H, et al. Analysis of antigen presenting cell derived exosomes, based on immunomagnetic isolation and flow cytometry[J]. J Immunol Methods, 2001, 247(1/2): 163-174.
[18]Hao S, Bai O, Li F, et al. Mature dendritic cells pulsed with exosomes stimulate efficient cytotoxic T- lymphocyte responses and antitumourimmunity[J]. Immunology, 2006, 10(1111): 1365-2567.
[19]Utsugi-Kobukai S, Fujimaki H, Hotta C, et al. MHC class I-mediated exogenous antigen presentation by exosomes secreted from immature and mature bone marrow derived dendritic cells[J]. Immunol Lett, 2003,89 (2/3): 125-131.
[20]Hwang I, Shen X, Sprent J. Direct stimulation of naive T cells by membrane vesicles from antigen-presenting cells: distinct roles for CD54 and B7 molecules[J]. Proc Natl Acad Sci USA, 2003, 100(11):6670-6675.
[21]Zitvogel L, Regnault A, Lozier A, et al. Eradication of established murine tumors using a novel cell- free vaccine: dendritic cell- derived exosomes [J]. Nat Med, 1998, 4(5): 594-600.
[22]Clotilde T, Muriel B, Philippe V, et al. Proteomic analysis of dendritic cell-derived exosomes: a secreted subcellular compartment distinct from apoptotic vesicles[J]. J Immunol, 2001, 166(12): 7309-7318.
[23]Dai S, Wan T, Wang B, et al. More effcient induction of HLA-A*0201-restricted and carcinoembryonic antigen (CEA)- specifc CTL response by immunization with exosomes prepared from heat-stressed CEA-positive tumor cells[J]. Clin Cancer Res, 2005,11(20): 7554-7563.
[24]Andre F, Schartz N E, Movassagh M, et al. Malignant effusions and immunogenic tumour-derived exosomes[J]. Lancet, 2002, 360(9329):295-305.
[25]Skokos D, Le Panse S, Villa I, et al. Mast cell-dependent B and T lymphocyte activation is mediated by the secretion of immunologically active exosomes [J]. J Immunol, 2001, 166 (2): 868-876.
[26]Skog J, Würdinger T, van Rijn S, et al.Glioblastomamicrovesicles transport RNA and proteins that promote tumour growth and provide diagnostic biomarkers[J]. Nat Cell Biol, 2008, 10(12):1470-1476.
[27]Graner M W, Alzate O, Dechkovskaia A M, et al. Proteomic and immunologic analyses of brain tumor exosomes[J]. FASEB J, 2009,23(5):1541–1557.
[28]Alvarez-Erviti L, Seow Y, Schapira A H, et al. Lysosomal dysfunction increases exosome-mediated alpha-synuclein release and transmission[J]. Neurobiol Dis, 2011, 42(3): 360-367.
[29]Logozzi M, de Milito A, Lugini L, et al. High levels of exosomes expressing CD63 and caveolin-1 in plasma of melanoma patients[J]. PLoS One, 2009, 4(4): e5219.
[30]Yoshioka Y, Konishi Y, Kosaka N, et al. Comparative marker analysis of extracellular vesiclesin different human cancer types[J]. J Extracell Vesicles, 2013, 2: 20424.
[31]Welker M W, Reichert D, Susser S, et al. Soluble serum CD81 is elevated in patients with chronic hepatitis C and correlates with alanine aminotransferase serum activity [J]. PLoS One, 2012, 7 (2): e30796.
[32]Mitchell P S, Parkin R K, Kroh E M, et al. Circulating microRNAs as stable blood-based markers for cancer detection[J]. Proc Natl Acad Sci USA, 2008, 105 (30): 10513-10518.
[33]Hunter M P, Ismail N, Zhang X, et al. Detection of microRNA expression in human peripheral blood microvesicles[J]. PLoS One, 2008, 3(11): e3694.
[34]Hong B S, Cho J H, Kim H, et al. Colorectal cancer cell derived microvesicles are enriched in cell cycle-related mRNAs that promote proliferation of endothelial cells[J]. BMC Genomics, 2009, 10:556.
[35]Lv L L, Cao Y H, Panetal M M, et al. CD2AP mRNA in urinary exosome as biomarker of kidney disease[J]. Clin Chim Acta, 2014, 428: 26-31.
[36]Kahlert C, Kalluri R. Exosomes in tumor microenvironment infuence cancer progression and metastasis[J]. J Mol Med, 2013, 91 (4): 431-437.
[37]Nilsson J, Skog J, Nordstrand A, et al. Prostate cancer-derived urine exosomes: a novel approach to biomarkers for prostate cancer[J]. Br J Cancer, 2009, 100 (10): 1603-1607.
[38]Tan A, Rajadas J, Seifalian A M. Exosomes as nano-theranostic delivery platforms for gene therapy[J]. Adv Drug Deliv Rev, 2013, 65 (3): 357-367.
[39]Maguire C A, Balaj L, Sivaraman S, et al. Microvesicle-associated AAV vector as a novel gene delivery system[J]. Mol Ther, 2012, 20 (5): 960-971.
[40]Pan Q, Ramakrishnaiah V, Henry S, et al.Hepatic cell-to-cell transmission of small silencing RNA can extend the therapeutic reach of RNA interference (RNAi)[J]. Gut, 2012, 61 (9): 1330-1339.
[41]Kosaka N, Iguchi H, Yoshioka Y, et al. Competitive interactions ofcancer cells and normal cells via secretory microRNAs[J]. J Biol Chem,2012, 287 (2): 1397-1405.
[42]Ohno S I, Takanashi M, Sudo K, et al. Systemically injected exosomes targeted to EGFR deliver antitumor microRNA to breast cancer cells[J]. Mol Ther, 2012, 21 (1): 185-191.
[43]Wahlgren J, Karlson T D L, Brisslert M, et al. Plasma exosomes can deliver exogenous short interfering RNA to monocytesand lymphocytes[J]. Nucleic Acids Res, 2012, 40 (17): 130.
[44]Mizrak A, Bolukbasi M F, Ozdener G B, et al. Genetically engineered microvesicles carrying suicide mRNA/protein inhibit Schwannoma tumor growth[J]. Mol Ther, 2013, 21 (1): 101-108.
[45]Shtam T A, Kovalev R A, Varfolomeeva E Y, et al. Exosomes are natural carriers of exogenous siRNA to human cells in vitro[J]. Cell Commun Signal, 2013, 11: 88.
[46]Takahashi Y, Nishikawa M, Shinotsuka H, et al.Visualization and in vivo tracking of the exosomes of murine melanoma B16-BL6 cells in mice after intravenous injection[J]. J Biotechnol, 2013, 165 (2): 77-84.
[47]Yin W, Ouyang S, Li Y, et al. Immature dendritic cell-derived exosomes:a promise subcellular vaccine for autoimmunity [J]. Infammation, 2013,36 (1): 232-240.
[48]Yeo R W Y, Lai R C, Zhang B, et al. Mesenchymal stem cell:an effcient mass producer of exosomes for drug delivery [J]. Adv Drug Deliv Rev,2013, 65 (3): 336-341.
[49]Zhu W, Huang L, Li Y, et al. Exosomes derived from human bone marrow mesenchymal stem cells promote tumor growth in vivo[J]. Cancer Lett, 2012, 315 (1): 28-37.
[50]Wahlgren J, De L Karlson T, Brisslert M, et al. Plasma exosomes can deliver exogenous short interfering RNA to monocytes and lymphocytes[J]. Nucleic Acids Res, 2012, 40 (17): 130.
[51]Shtam T A, Kovalev R A, Varfolomeeva E Y, et al. Exosomes are natural carriers of exogenous siRNA to human cells in vitro [J]. Cell Commun Signal, 2013, 11: 88.
[52]Alvarez-Erviti L, Seow Y, Yin H,et al. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes[J]. Nat Biotechnol, 2011, 29 (4): 341-345.
[53]Xin H, Li Y, Buller B, et al. Exosome-mediated transfer of miR-133b from multipotent mesenchymal stromal cells to neural cells contributes to neurite outgrowth [J]. Stem Cells, 2012, 30 (7): 1556-1564.
[54]Chen L, Charrier A, Zhou Y, et al. Epigenetic regulation of connective tissue growth factor by microRNA-214 delivery in exosomes from mouse or human hepatic stellate cells [J]. Hepatology, 2013, 59 (3):1118-1129.
[55]Katakowski M, Buller B, Zheng X, et al. Exosomes from marrow stromal cells expressing miR-146b inhibit glioma growth [J]. Cancer Lett, 2013, 335 (1): 201-204.
[56]Katakowski M, Zheng X, Jiang F, et al. MiR-146b-5p suppresses EGFR expression and reduces in vitro migration and invasion of glioma[J]. Cancer Invest, 2010, 28 (10): 1024-1030.
[57]Kosaka N, Iguchi H, Yoshioka Y, et al. Competitive interactions of cancer cells and normal cells via secretory microRNAs[J]. J Biol Chem,2012, 287 (2): 1397-1405.
[58]Ohno S, Takanashi M, SudoK, et al. Systemically injected exosomes targeted to EGFR deliver antitumor microRNA to breast cancer cells [J]. Mol Ther, 2012, 21 (1): 185-191.
[59]Tian Y, Li S, Song J, et al. A doxorubicin delivery platform using engineered natural membrane vesicle exosomes for targeted tumor therapy [J]. Biomaterials, 2013, 35 (7): 2383-2390.
[60]Sun D, Zhuang X, Xiang X, et al. A novel nanoparticle drug delivery system: the anti-inflammatory activity of curcumin is enhanced when encapsulated in exosomes [J]. Mol Ther, 2010, 18 (9): 1606-1614.
[61]Blaskovich M A, Sun J, Cantor A, et al. Discovery of JSI-124 (cucurbitacin I), a selective Janus kinase/signal transducer and activator of transcription 3 signaling pathway inhibitor with potent antitumor activity against human and murine cancer cells in mice [J]. Cancer Res, 2003,63 (6): 1270-1279.
[62]Mizrak A, Bolukbasi M F, Ozdener G B, et al. Genetically engineered microvesicles carrying suicide mRNA/protein inhibit Schwannoma tumor growth [J]. Mol Ther, 2013, 21 (1): 101-108.
Research Progress in Exosomes for Disease Diagnosis and Drug Delivery System
LIU Jiafan, YANG Li, HONG An, WANG Xiaogang
(Biomedicine Institute, Jinan University, Guangzhou 510632, China)
Exosomes are 30-100 nm membrane vesicles of endocytic origin that are secreted by various living cells. Exosomes can be transferred between cells and contain various molecular constitutes closely related to their origin and function, including proteins, lipids and RNAs. It has been shown that exosomes in the blood of cancer patients are at abnormally high levels and contain cancer biomarkers, suggesting their potential as biomarkers for diagnosis. In addition, as natural carriers for material transportation, exosomes have been used as drug delivery systems for treating tumors and Alzheimer's disease. In this article, the research progress in exosome as biomarker and drug delivery system were reviewed.
exosomes; biomarker; drug delivery system
Q26
A
1001-5094(2015)09-0676-07
接受日期:2015-07-08
*通讯作者:王晓刚,教授;
研究方向:非编码RNA生物学;
Tel:020-85221983;E-mail:txg_wang@jnu.edu.cn
