蛋白质多肽类药物的脂肪酸修饰研究进展
2015-11-24王玥赵伟辛中帅张同存罗学刚
王玥,赵伟,辛中帅,张同存,罗学刚*
(1. 工业发酵微生物教育部重点实验室暨天津市工业微生物重点实验室,天津科技大学生物工程学院,天津300457;2. 正大天晴药业集团股份有限公司,江苏 南京 210023;3. 中国食品药品检定研究院,北京 100050)
蛋白质多肽类药物的脂肪酸修饰研究进展
王玥1,赵伟2,辛中帅3,张同存1,罗学刚1*
(1. 工业发酵微生物教育部重点实验室暨天津市工业微生物重点实验室,天津科技大学生物工程学院,天津300457;2. 正大天晴药业集团股份有限公司,江苏 南京 210023;3. 中国食品药品检定研究院,北京 100050)
随着基因工程技术的发展,蛋白质多肽药物的应用越来越受到人们的青睐。但此类药物具有血浆半衰期较短、免疫原性较强等不足之处,在很大程度上限制了其临床应用。因此,研究人员尝试采用各种化学方法对蛋白质多肽类药物加以修饰,以弥补这一不足。与PEG修饰、糖基化修饰、定点突变等方法相比,脂肪酸修饰除了可获得良好的生物活性、提高稳定性、降低免疫原性外,更重要的是由于脂肪酸是构成人体脂肪、类脂和细胞膜磷脂的重要成分,可有助于提高药物的脂溶性,增大肠道黏膜透过性,增强药物与受体的结合。对蛋白质多肽药物的脂肪酸修饰研究进展进行综述。
蛋白质多肽类药物;脂肪酸;修饰
随着生物技术的高速发展,蛋白质多肽类药物不断涌现,已成为21世纪医药研发领域中最活跃、进展最快的药物之一。蛋白质多肽类药物比化学药物更接近于机体内源性物质,具有毒副作用小、不易蓄积导致中毒、疗效稳定等优点,被广泛地应用于癌症、心血管疾病、自身免疫疾病等疾病的治疗,备受国内外药物开发商和研究者的青睐[1-2]。然而,蛋白质多肽药物仍在临床应用上存在瓶颈:不能直接口服给药,需皮下给药或肌注,在体内不稳定、易被蛋白酶降解、具有较高免疫原性从而容易被机体免疫系统识别,造成其半衰期普遍较短而必须加大给药频率和剂量,使病人的依从性大幅度降低[3-4]。为克服上述问题,研究人员尝试采用各种化学方法对蛋白质多肽类药物加以修饰,通过修饰可显著改善蛋白多肽类药物的性状,提高药物的生物利用度、延长其在血浆中的半衰期,从而降低用药剂量,减少用药频率。有关蛋白多肽类药物的化学修饰在很多年前就已经开始研究,已经成功应用的修饰方法包括PEG修饰、糖基化修饰和定点突变等等。近年来脂肪酸修饰、Fc片段融合以及白蛋白融合等新一代修饰方案也已有上市产品。本文就蛋白多肽类药物的脂肪酸修饰方法、特点以及药物研发情况进行综述。
1 蛋白质多肽类药物的化学修饰位点
根据不同的需要,蛋白质多肽类分子侧链或末端的自由氨基、羧基、巯基、酚羟基、咪唑基、胍基、吲哚基、甲硫基等均可选择作为化学修饰的位点。其中,由于蛋白质多肽侧链裸露的氨基自由度较大、亲核反应活性较高,氨基通常被选择作为蛋白质多肽侧链化学修饰的主要基团[5]。
胰岛素是最早应用于临床的蛋白类激素药物,多年以来,研究者不断致力于研发更加长效的胰岛素类似物,以减缓病人的生理痛苦和经济负担,因此胰岛素也是最常被用于化学修饰研究的蛋白质多肽类药物的典型代表。基于对胰岛素结构的综合研究,一般将胰岛素分子中3个裸露的氨基,即GlyA1、PheB1的α-氨基和LysB29的ε-氨基,作为胰岛素化学修饰的主要位点。其中,非质子化的赖氨酸的ε-氨基是蛋白质分子中亲核反应活性很高的基团[6]。在非保护条件下对这些位点的修饰通常可能得到单修饰、二修饰及三修饰的混合物。由于不同氨基酸的pKa值不同,通过调节pH值可以控制修饰位点的选择性和修饰度。在胰岛素分子中,GlyA1的pKa值为8.0,PheB1的pKa值为6.7,LysB29的pKa值为10.53。一般来说,在pH值为5~6时,单酰化主要发生在PheB1上,二酰化产物主要是A1,B1-酰化物;pH值为6.8~9.2时单酰化主要发生在GlyA1,同时二酰化产物可能是B1,A1-或A1,B29-酰化物;当pH值大于10时,单酰化主要发生在LysB29的ε-氨基,其次可能的位点为GlyA1的α-NH2[7-8]。此外,温度和反应介质也是影响蛋白质结构、活性和修饰程度的一个重要因素。
2 蛋白质多肽类药物结构修饰的手段
结构修饰是延长蛋白质多肽类分子半衰期、实现长效化的重要技术手段之一。利用合适的修饰方法和修饰剂对蛋白质多肽类药物的主链结构或对侧链基团进行化学修饰,可改变其分子大小、电荷和受体结合能力,提高脂溶性,同时通过修饰基团形成的空间位阻保护易受蛋白水解酶进攻的区域,延缓活性蛋白的降解,提高药物的药动学稳定性[9]。
2.1 定点突变
将蛋白质多肽分子中不稳定的氨基酸残基定点突变成稳定的残基,可以增加药物的稳定性及生物活性。人胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)的体内半衰期仅2 min[10]。而与GLP-1同源性93%、8位和35位被氨基异丁酸取代的他司鲁肽(taspoglutide)、与GLP-1同源性53%的exendin-4以及在exendin-4的C端添加Lys残基的利西拉肽(lixisenatide,VE0010)等,则不仅能够激动GLP-1受体,且因位点突变能够抵抗体内二肽基肽酶- 4(dipeptidyl peptidase-4,DPP- 4)降解,半衰期均显著延长。其中,exendin-4(exenatide,艾塞那肽,商品名:Byetta /百泌达)已在2005年成为第一个获FDA批准用于治疗Ⅱ型糖尿病的GLP-1受体激动剂[11-14]。
2.2 聚乙二醇修饰
聚乙二醇(polyethyleneglyeol,PEG)类修饰剂具有可体内降解、无毒性、无抗原性、高度的亲水性及水溶性、能与多种有机物组分相容等优点,是目前最为常用的修饰剂。PEG修饰可抑制免疫反应发生、阻碍蛋白酶降解,最终使药物缓慢释放、半衰期延长、血药浓度波动减小。此外,PEG可以将它的亲水性、柔性、抗凝血性等优良性质赋予到修饰后的蛋白质多肽分子上。因此,已有不少PEG修饰的蛋白质多肽类药物上市,如PEG修饰的干扰素、粒细胞集落刺激因子、天冬酰胺酶等[15-16]。然而,PEG在进行多位点修饰时,非定点修饰具有随机性,专一性差,定点修饰则由于蛋白质结构复杂而不易控制条件,甚至可能造成生物学活性降低。因此,建立PEG修饰最优方案依然是研究者们的一大难题。
2.3 糖基化修饰
糖基化修饰是指将寡糖结构与蛋白质多肽分子中某些特殊功能团以共价键相连接,包括N-糖基化、O-糖基化、C-糖基化以及糖基磷脂酰肌醇修饰等[17]。糖基化修饰可增加空间位阻、提高蛋白质水溶性和稳定性、减少肾小球滤过,从而影响蛋白质多肽类药物的药动学特性、生物学活性、免疫原性和凝聚性等[18]。Huet等[19]用戊糖载体(carrier pentasaccharide,CP)对恩夫韦肽T-20进行修饰,再用PEG连接构成恩夫韦肽-PEG(12)-CP,修饰后大鼠血浆半衰期从2.8 h延长至10 h以上,由此预测人体注射给药频率可由原来的每天2次减为每周1次,半衰期可达120 h。此外,促红细胞生成素(EPO)经过额外增加2个N糖基化修饰后所得到的Aranesp,半衰期延长了3倍,目前也已获批上市[20]。
2.4 脂肪酸修饰
脂肪酸修饰分为不饱和脂肪酸修饰和饱和脂肪酸修饰。不饱和脂肪酸修饰主要是以油酸、亚油酸等进行修饰,目前研究还相对较少。已有一些利用饱和脂肪酸进行修饰且获批上市用于临床的药物。饱和脂肪酸修饰主要是以肉豆蔻酸(myristic acid)、棕榈酸(palmitic acid)进行修饰。肉豆蔻酸,又名十四烷酸,是一种不溶于水,易溶于乙醇和乙醚的饱和脂肪酸,由椰子油的脂肪酸经分馏而制得。棕榈酸,又名十六烷酸、软脂酸,以甘油脂的形式广泛存在于动植物油脂中。与其他化学修饰类似,脂肪酸修饰可有效延长蛋白质多肽类药物的体内半衰期。例如,以棕榈酸修饰的exendin-4(Ex4-C16)给ICR小鼠皮下注射,其可在小鼠体内存在长达10 d之久,而未修饰的exendin-4(Ex4)则在2 d左右被清除[21]。此外,与其他修饰剂相比,脂肪酸是构成细胞膜磷脂及人体脂肪与类脂的重要成分,直接参与了细胞膜的组成以及蛋白质配体与膜受体的结合,因此脂肪酸修饰更有助于提高药物的脂溶性、肠道黏膜透过性及吸收效率,故而用脂肪酸修饰蛋白质多肽类药物越来越受到研究人员的关注。
3 脂肪酸修饰对蛋白质多肽类药物的影响
3.1 提高脂溶性与吸收
脂肪酸是细胞膜磷脂的重要成分,能维持细胞膜的流动性并参与细胞膜组装,同时也是构成人体脂肪和类脂的基本物质。因此,脂肪酸修饰的蛋白质多肽类药物有助于提高药物与细胞的亲和性,从而促进上皮细胞对药物的吸收。Hashizume等[22]对胰岛素分子的侧链进行棕榈酸修饰,得到亲脂性更高的棕榈酸酰化胰岛素,同位素示踪检测结果显示:双棕榈酸衍生物的血药浓度显著高于未经修饰的胰岛素,单棕榈酸衍生物则居于二者之间。此外,超氧化物歧化酶(SOD)经棕榈酸、月桂酸等修饰后,亲脂性及稳定性也表现出明显增加,与靶细胞的细胞膜结合也更牢[23-24]。
3.2 抵抗蛋白酶降解
体内蛋白酶的酶促降解是导致蛋白质多肽类药物半衰期短、生物利用度低的主要原因之一。脂肪酸修饰可遮蔽蛋白质多肽分子易受酶进攻的区域,从而延缓或抑制蛋白水解酶的破坏作用,延长体内作用时间。研究发现胰岛素(Ins)在体外用胰蛋白酶处理4 h后降糖活性几乎完全丧失,而硬脂酸酰化胰岛素(SA-Ins)、油酸酰化胰岛素(OA-Ins)以及亚油酸酰化胰岛素(LA-Ins)在酶解8 h后仍保有一定的降糖活性,其中LA-Ins甚至在酶解10 h后仍保持约40%的降糖活性。小鼠皮下注射3 h后,LA-Ins、SA-Ins及OA-Ins均表现出一定的降糖作用,而Ins则已被完全清除,表明脂肪酸修饰可提高蛋白质多肽分子的抗酶解能力、提高药物稳定性、延长体内半衰期,且这种抗酶解能力随着脂肪酸不饱和度的增加而增强[25]。
3.3 增强血浆白蛋白结合率
脂肪酸在体内能与血浆白蛋白(human serum albumin,HSA)可逆性地结合,结合后的复合体在跨膜转运中因分子过大而受到限制,因此脂肪酸修饰可延长药物在体内的滞留时间[26]。例如,胰岛素只有在单体形式时才能有效穿过毛细血管壁发挥药理学效应,经脂肪酸修饰后,一方面与HSA结合增加,另一方面脂肪酸侧链还同时促进胰岛素形成六聚体,从而延缓了胰岛素从循环血液向外周靶器官的扩散和分布,显著延长其半衰期[27-28]。
4 蛋白质多肽类药物脂肪酸修饰的方法
4.1 氨基修饰
氨基酰化是脂肪酸修饰蛋白质多肽类药物的常见方法。在体内,生理性的蛋白质多肽分子氨基端脂肪酸修饰通常是发生在N-末端Gly残基上,多由特异性豆蔻转移酶(N-myristoyltransferase,NMT)催化[29]。体外的氨基端脂肪酸修饰则首先需要进行羧基活化。不同的羧基活化方法将会很大程度上影响后续氨基酰化反应的选择性及修饰后的蛋白质亲疏水性等性质。常用的方法有:①酰氯法,这是其中反应活性最强的方法,然而,该法在水溶液(特别是碱性蛋白质溶液)中易发生水解且选择性差、副反应多,因此修饰率低;②二环己基碳二亚胺(dicyclohexylcarbodiimide,DCC)法,活化羧基得到的是O-酰基脲,反应迅速。但因胺类化合物会促使O-酰基脲重排生成N-酰基脲,所以反应要避免使用三乙胺,尽量使用极性较小的溶剂;③活性酯(N-羟基琥珀酰亚胺酯)法,这是目前业内较常使用的方法。在合适的pH和温度(通常0℃左右)下,N-羟基琥珀酰亚胺酯与氨基相连形成酰氨键,不仅可保留蛋白质多肽分子的生物活性,也可实现位点专一性修饰[30];④此外,还有酸酐法、活化酰胺法、叠氮化物法等方法。
4.2 羧基修饰
由于蛋白质多肽链中几种氨基活性差异很小,在进行修饰反应中,很难特定地修饰某一个氨基,修饰后所得的产物大多是混合物。因此,要获得定点修饰的药物纯品,就必须要经过复杂繁琐的分离纯化过程。受到人胰岛素半合成方法的启发,人们开始尝试在蛋白质多肽类药物的修饰领域中改修饰氨基为修饰羧基[31]。例如,先利用羧肽酶A去掉胰岛素B链C末端第一个氨基酸残基,然后利用胰蛋白酶催化将连有脂肪链的氨基酸衍生物与之相连接,形成B链C端被脂肪链修饰的胰岛素衍生物,分析显示该修饰产物在体内更加长效、稳定,且具有潜在的口服功能。
4.3 接头氨基酸介导的脂肪酸修饰
除了直接对蛋白质多肽分子进行脂肪酸修饰之外,还可以先制备脂肪酸修饰的氨基酸,然后通过这一接头氨基酸与蛋白质多肽分子进行连接,在药物中引入脂肪酸修饰侧链。例如诺和诺德(Novo Nordisk)公司的利拉鲁肽和德谷胰岛素,均是以谷氨酸(Glu)作为接头氨基酸,将脂肪酸连接到药物主链的Lys上[32-33]。
4.4 巯基修饰与羟基修饰
此外,在体内还存在另外2种常见的脂肪酸修饰形式。一种是Cys残基的巯基与脂肪酸发生可逆共价结合,生成不稳定的硫脂键。能够在Cys的巯基发生修饰的脂肪酸主要有棕榈酸、豆蔻酸、硬脂酸、花生四烯酸等,其中最常见的是棕榈酸。另一种是Ser或Thr残基中的羟基被脂肪酸修饰形成醚氧键,研究已发现Wnt等蛋白可在膜结合O-脂转移酶(membrane-bound O-acyltransferases,MBOATs)作用下被棕榈酸、棕榈油酸及胆固醇等修饰[34-35]。目前,这2种修饰在体外药物修饰研究方面还未见报道。
5 脂肪酸修饰药物开发中需关注的问题
与其他修饰方法相比,脂肪酸修饰的蛋白质药物涉及到更多的化学过程和更为复杂的修饰产物高级结构,药物开发质量控制需要特别考虑以下几个方面。
5.1 修饰位点的选择
如前所述,不论是何种修饰,修饰位点的选择都至关重要。一般而言,修饰位点应考虑设计在非活性相关位点区域以免影响多肽蛋白质药物的物理和药理性质。例如,研究表明:对于胰岛素而言,GlyA1的修饰可能会导致降糖活性的部分丧失,而PheB1和LysB29的共价修饰则不仅基本上保持原有的二级、三级结构和生物活性,还几乎完全消除了产物的免疫原性和致敏性,延长了药物的半衰期。分析还显示PheB1和LysB29修饰后物理稳定性均显著增强,且其中PheB1修饰后的稳定性比LysB29修饰产物更强[36]。
5.2 相关杂质的监测与控制
在蛋白质多肽类药物的脂肪酸修饰过程中,需要做好对工艺中易于引入的相关杂质的检测及控制工作,主要的相关杂质包括如下方面。
①脂肪酸修饰剂及相关杂质。脂肪酸及活化均需要通过化学合成途径获得,合成过程会引入工艺相关有机物杂质,需考虑对相关工艺杂质进行追踪和分析,并进行结构确证和风险评价,确保产品在安全限度范围内。
②修饰异构体。修饰过程中,可能由于不同修饰剂引入而产生多种修饰异构体,异构体间结构非常相似,工艺难于去除,需建立良好的专属性方法,对修饰杂质谱进行系统、全面的分析,并确证杂质结构,给予风险评价,并结合工艺控制杂质范围。
③蛋白产品相关杂质的监控。对于蛋白质多肽类药物进行脂肪酸修饰,需要考虑产品相关杂质,针对修饰过程中可能涉及到产品或者中间体敏感的条件,需要特别关注与蛋白质相关的杂质谱变化,例如各种蛋白脱酰胺化杂质、氧化态杂质、旋光异构体杂质、降解物杂质、聚合物杂质、双修饰蛋白质、未修饰蛋白质等,这些杂质均应在产品开发过程中予以关注,其中有些杂质是影响产品关键质量属性(Critical Quality Attribute,CQA)的物质,需要在工艺开发过程中特别重视,对每个杂质进行溯源追踪和风险评估,并根据分析结果予以控制。
5.3 体内药动学参数的分析
在完成对蛋白质多肽分子的修饰之后,除了常规体外分析外,还必须重点对其体内聚合情况、与HSA结合能力、消除半衰期等体内药动学参数等进行系统性的分析,以明确修饰后是否可达到稳定、缓释的目的。
6 目前上市的脂肪酸修饰类药物
6.1 地特胰岛素
地特胰岛素(detemir, Levemir,诺和平)是由诺和诺德公司研发的新型胰岛素类似物,地特胰岛素是将人胰岛素B30位Thr去除后在B29位Lys上连接一个肉豆蔻酸侧链而成(见图1)[37]。皮下注射该药后,肉豆蔻酸侧链能有效促进胰岛素形成六聚体并与HSA发生可逆性结合,从而减缓了胰岛素的体内扩散速度,使药物缓慢释放、药效可保持24 h,达到长效降糖的作用[38]。该药物率先于2004年在欧洲上市,2005年美国FDA也正式批准其用于治疗1和2型糖尿病。因安全性能良好,2011、2012年又先后被欧洲人用医药委员会(Committee for Medicinal Products for Human Use,CHMP)和美国FDA批准用于2到5岁1型糖尿病患儿,此外2012年美国FDA批准将地特胰岛素的妊娠分类变更为B类,明确其可安全地应用于患有糖尿病的孕妇。

图1 胰岛素和地特胰岛素的结构Figure 1 Structures of insulin and detemir
6.2 利拉鲁肽
利拉鲁肽(liraglutide, Victoza)由诺和诺德公司研发,于2010年1月在美国上市,用于治疗2型糖尿病。2014年,又被美国FDA批准新增适应证,用于治疗肥胖。利拉鲁肽是将人GLP-1第34位的Lys替换为Arg,同时在第26位Lys上引入一个由Glu介导的16碳棕榈酸侧链(见图2)[39]。利拉鲁肽保留了GLP-1的全部生物活性,且不良反应显著减少。皮下注射后,利拉鲁肽可在注射部位形成胶态分子团样聚集体,且化学稳定性增强、不易被DPP-4降解,同时还可与HSA形成可逆的复合体,这三方面因素共同作用,延缓了利拉鲁肽的吸收与失活,体内半衰期从天然GLP-1的1~2 min延长至13 h,只需每日在上臂、腹部或股部皮下注射1次,即可有效控制血糖24 h[32,40]。
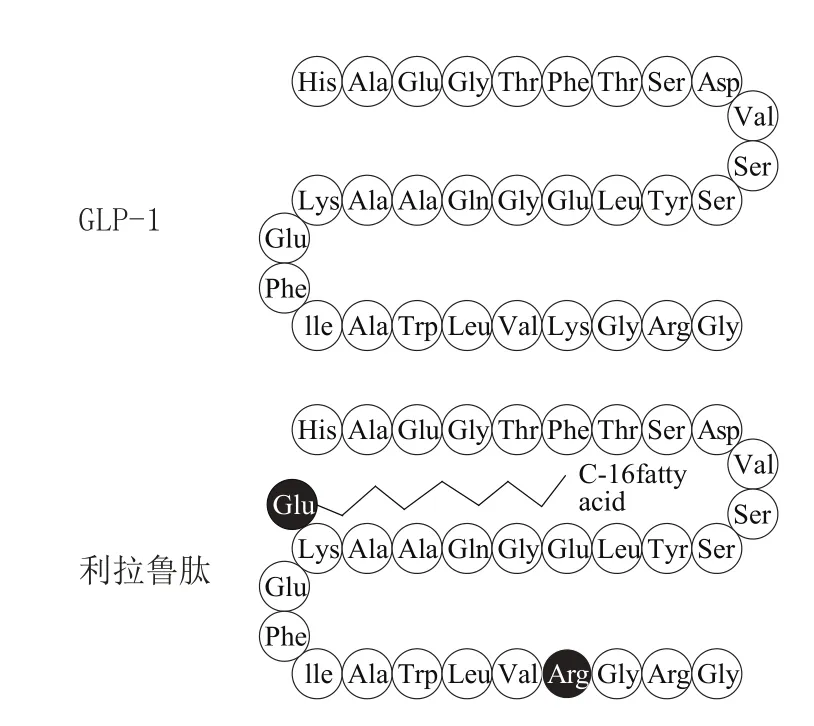
图2 利拉鲁肽的结构Figure 2 Structure of liraglutide
6.3 德谷胰岛素
德谷胰岛素(degludec, Tresiba)是诺和诺德公司研发的超长效基础胰岛素类似物。本品是将人胰岛素B30位的Thr去除后,在B29位Lys上引入一个L-γ-谷氨酸连接的16碳脂肪二酸而成(见图3)。这种结构修饰使其在锌离子、苯酚及间甲苯酚等的辅助下以双六聚体形式稳定地存在于制剂中。皮下注射本品后,随着制剂中苯酚的迅速扩散,双六聚体自我聚集形成多六聚体,并在锌离子分散过程中缓慢解离释放出单体,吸收进入血液循环。侧链脂肪酸与HSA的可逆性结合进一步减缓了药物的吸收与扩散速度,从而发挥长效降糖作用。德谷胰岛素的药效学曲线波动很小,可在24 h内保持平稳。与甘精胰岛素相比,德谷胰岛素在不同个体的体内药效学变异性更低[33,41]。德谷胰岛素于2012年10月在日本上市,用于治疗1、2型糖尿病,随后于2012年11月在欧盟获准上市。其在美国的上市申请则在2013年2月被FDA拒绝,在补充了心血管结局试验中期分析数据等资料之后,2015年4月FDA接受了诺和诺德公司重新提交的上市申请。

图3 德谷胰岛素的结构Figure 3 Structure of degludec
7 结语与展望
蛋白质多肽类药物与传统化学药物相比具有作用专一、高效等优点,同时也有半衰期短、稳定性差等缺点,这些问题严重限制了蛋白质多肽类药物的发展。采取化学修饰可以改变蛋白质多肽类药物的高级结构和理化性质,并保持其高度的生物活性以使其在体内长效化。脂肪酸修饰与其他修饰剂相比,能更好地增加药物的脂溶性,增加肠道的膜透过性,具有很好的应用价值。然而,这类制剂也有其自身的局限性,在今后的研究中还需要进一步深入研究解决的问题主要有:一是对于药物脂肪酸修饰位点的专一性研究,通过修饰条件的优化、修饰剂的选择、蛋白多肽中可修饰氨基酸残基理化性质的深入研究,使进行修饰反应后能够得到单一修饰位点的产物,尽可能减少非特异性修饰位点产物;二是要开发其他蛋白多肽类药物的脂肪酸链修饰产物,包括一些用于治疗肿瘤、心血管疾病且需要长期给药的蛋白多肽类药物,基于已上市药物的研究经验,开发其脂肪酸修饰位点,得到新的具有长效稳定性的化合物;三是拓展多肽药物化学修饰方法的新视野,将化学和生物技术的优势相结合,共同探索出新型的长效化技术,并力求实现大规模工业化生产。
[1]Fosgerau K, Hoffmann T. Peptidetherapeutics: current status and futuredirections[J]. Drug Discov Today, 2015, 20 (1): 122-128.
[2]Kaspar A A, Reichert J M. Future directions for peptide therapeutics development[J]. Drug Discov Today, 2013, 18 (17/18): 807-817.
[3]Smart A L, Gaisford S, Basit A W, et al. Oral peptide and protein delivery: intestinal obstacles and commercial prospects [J]. Expert Opin Drug Deliv, 2014, 11 (8): 1323-1335.
[4]Wang J, Yadav V, Smart A L, et al. Stability of peptidedrugs in the colon[J]. Eur J Pharm Sci, 2015, 278: 31-36.
[5]Zhou M, Bao Y, Li H, et al. Defciency of adipocyte fatty-acid-binding protein alleviates myocardial ischaemia/reperfusion injury and diabetesinduced cardiac dysfunction[J]. Clin Sci (Lond), 2015, 129 (7): 547-559.
[6]Tambascia M A, Eliaschewitz F G. Degludec: the new ultra-longinsulin analogue[J]. Diabetol Metab Syndr, 2015, 7: 57.
[7]Rolla A. Pharmacokinetic and pharmacodynamic advantages of insulin analogues and premixed insulin analogues over human insulins: impact on effcacy and safety[J]. Am J Med, 2008 (6 Suppl): S9-S19.
[8]Uchio T, Baudys M, Liu F, et al. Site-specifc insulin conjugates with enhanced stability and extended actionprofle[J]. Adv Drug Deliv Rev,1999, 35 (2/3): 289-306.
[9]Yewale C, Baradia D, Vhora I, et al. Proteins: emerging carrier for delivery of cancer therapeutics[J]. Expert Opin Drug Deliv, 2013, 10(10): 1429-1448.
[10]Heppner K M, Perez-Tilve D. GLP-1 based therapeutics: simultaneously combating T2DM and obesity[J]. Front Neurosci, 2015, 9: 92-102.
[11]Bhavsar S, Mudaliar S, Cherrington A. Evolution of exenatide as a diabetes therapeutic[J].Curr Diabetes Rev, 2013, 9 (2): 161-193.
[12]Bain S C.The clinical development program of lixisenatide: a once-daily glucagon-like peptide-1 receptor agonist[J]. Diabetes Ther, 2014, 5 (2):367-383.
[13]Seino Y, Ikeda Y, Niemoeller E, et al. Effcacy and safety of lixisenatide in Japanese patients with type 2 diabetes insuffciently controlled with basal insulin±sulfonylurea: asubanalysis of the getGoal-L-Asia study [J]. Horm Metab Res, 2015: Epub ahead of print.
[14]Li H Q, Xu J Y, Jin L, et al. Utilization of model-based meta-analysis to delineate the net effcacy of taspoglutide from the response of placebo in clinical trials [J]. Saudi Pharm J, 2015, 23 (3): 241-249.
[15]Dong H, Tang M, Li Y, et al. Disulfde-bridged cleavable PEGylation in polymeric nanomedicine for controlled therapeutic delivery [J]. Nanomedicine, 2015, 10 (12): 1941-1958.
[16]Zündorf I, Dingermann T. PEGylation--a well-proven strategy for the improvement of recombinant drugs [J]. Pharmazie, 2014, 69 (5): 323-326.
[17]Berger M, Kaup M, Blanchard V. Protein glycosylation and its impact on biotechnology [J]. Adv Biochem Eng Biotechnol, 2012, 127: 165-185.
[18]Johnson Q R, Lindsay R J, Raval S R, et al. Effects of branched O-glycosylation on a semiflexible peptide linker[J]. J Phys Chem B,2014, 118 (8): 2050-2057.
[19]Huet T, Kerbarh O, Schols D, et al. Long-lasting enguvirtide carrier pentasaccharide conjugates with potent anti-human immunodefciency virus type 1 activity[J]. Antimicrob Agents Chemother, 2010, 54 (1):134-142.
[20]Roger S D, Jassal S V, Woodward M C, et al. A randomised single-blind study to improve health-related quality of life by treating anaemia of chronic kidney disease with Aranesp®(darbepoetin alfa) in older people:STIMULATE [J]. Int Urol Nephrol, 2014, 46 (2): 469-475.
[21]Lee C, Choi J S, Kim I, et al. Decanoic acid-modifed glycol chitosan hydrogels containing tightly adsorbed palmityl-acylated exendin-4 as a long-acting sustained-release anti-diabetic system[J]. Acta Biomater,2014, 10 (2): 812-820.
[22]Hashizume M, Douen T, Murakami M, et al. Improvement of large intestinal absorption of insulin by chemical modifcation with palmitic acid in rats [J]. J Pharm Pharmacol, 1992, 44 (7): 555-559.
[23]孙淑芬, 莫简, 郭正仁, 等. 月桂酸修饰的超氧化物歧化酶保护红细胞抗氧化溶血作用的试验研究[J]. 第四军医大学学报, 1995, 16 (2):89-91.
[24]孙红颖, 曹海石, 罗贵民. 棕榈酰化超氧化物歧化酶的制备及其性质研究[J]. 生物加工过程, 2003, 1 (1): 47-51.
[25]黄涛, 黄开勋. 不饱和脂肪酸修饰胰岛素的降糖活性及抗酶解作用[J]. 中国生化药物杂志, 2005, 26 (2): 65-67.
[26]Rizzuti B, Bartucci R, Sportelli L, et al. Fatty acid binding into the highest affinity site of human serum albumin observed in molecular dynamics simulation [J]. Arch Biochem Biophys, 2015, 1 (579): 18-25.
[27]Chen X Y, Dong Q, Li G M. Effect of combined application insulin and insulin detemir on continous glucose monitor in children with type 1 diabetes mellitus [J]. Int J Clin Exp Med, 2015, 8 (3): 4287-4291.
[28]Claxton A, Baker L D, Hanson A, et al. Long acting intranasal insulin detemirimproves cognition for adults with mild cognitive impairment or early-Stage alzheimer's disease dementia[J]. J Alzheimers Dis, 2015, 45(4): 1269-1270.
[29]Giglione C, Fieulaine S, Meinnel T. N-terminal protein modifcations:Bringing back into play the ribosome [J]. Biochimie, 2015, 114: 134-146.
[30]Suchi R, Stern-Bach Y, Gabay T, et al. Covalent modification of the amine transporter with N, N'-dicyclohexylcarbodiimide[J]. Biochemistry,1991, 30 (26): 6490-6494.
[31]何明磊, 赵轶男, 权春善, 等. 胰岛素的脂肪链定位修饰及产物的表征[J]. 药物生物技术, 2009, 16 (5): 414-416.
[32]Iepsen E W, Torekov S S, Holst J J. Liraglutide for Type 2 diabetes and obesity: a 2015 update [J]. Expert Rev Cardiovasc Ther, 2015, 13 (7):753-767.
[33]Tambascia M A, Eliaschewitz F G. Degludec: the new ultra-long insulin analogue[J]. Diabetol Metab Syndr, 2015, 7: 57-63.
[34]Hannoush R N.Synthetic protein lipidation [J]. Curr Opin Chem Biol,2015, 28: 39-46.
[35]Takada R, Satomi Y, Kurata T, et al. Monounsaturated fatty acid modification of Wnt protein: its role in Wnt secretion [J]. Dev Cell,2006, 11 (6): 791-801.
[36]Hinds K D, Kim S W. Effects of PEG conjugation on insulin properties[J]. Adv Drug Deliv Rev, 2002, 54 (4):505-530.
[37]Tibaldi J M. Evolution of insulin: from human to analog [J]. Am J Med,2014, 127 (10 Suppl): S25-S38.
[38]Asias B D, Stock E M, Small N L, et al. Clinical and fnancial outcomes of switching insulin glargine to insulin detemir in a veteran population with type 2 diabetes[J]. J Diabetes Metab Disord, 2015, 14: 53.
[39]Sjöholm A. Liraglutide therapy for type 2 diabetes: overcoming unmet needs [J]. Pharmaceuticals, 2010, 3 (3): 764-781.
[40]Fujioka K, Sparre T, Sun L Y, et al. Usability of the novel liraglutide 3.0 mg pen injector among overweight or obese adult patients with or without prior injection experience[J]. J Diabetes Sci Technol, 2015,Epub ahead of print.
[41]Kanazawa I, Notsu M, Tanaka K, et al. An open-label longitudinal study on the effcacy of switching from insulin glargine or detemir to degludec in type 2 diabetes mellitus[J]. Intern Med, 2015, 54 (13): 1591-1598.

[专家介绍] 罗学刚 : 副教授,硕士生导师。天津市“131”人才计划第三层次人选,中国药理学会、中国细胞生物学学会、中国微生物学会会员。2007年6月毕业于中国药科大学,获微生物与生化药学博士学位,同时进入天津科技大学工作,现任天津科技大学生物工程学院制药工程教研室主任。近5年先后主持2项国家自然科学基金、1项天津市高等学校科技发展基金计划项目、4项企事业单位横向项目,并作为骨干参与国家863计划、国家自然科学基金等省部级以上科研项目10项。先后发表各类科研论文60余篇,其中第一或通讯作者SCI论文19篇、EI论文13篇、中文期刊论文15篇;主编教材1部、参编英文专著1部;申请专利10项,其中获授权3项。
Advances in Research on Modifcation of Protein and Peptide Drugs with Fatty Acids
WANG Yue1, ZHAO Wei2, XIN Zhongshuai3, ZHANG Tongcun1, LUO Xuegang1
(1. Key Laboratory of Industrial Fermentation Microbiology Affliated to Ministry of Education & Tianjin Industrial Microbiology Key Laboratory,School of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China; 2. Chia Tai Tianqing Pharmaceutical Group Co., Ltd. Nanjing 210023, China; 3. National Institute for Food and Drug Control, Beijing 100050, China)
With the development of techniques in genetic engineering, protein and peptide drugs have gained increased popularity. However, their clinical application is limited by several shrotcomings such as short half-time and high immunogenicity, which leads to the recent efforts made by many researchers in various chemical modifcations of protein and peptide drugs. Compared with PEG modifcation, glycosylation and site-directed mutagenesis, modifcation with fatty acids results in good biological activity, improved stability and reduced immunogenicity of protein and peptide drugs. What's more, as important components of body fat, lipids and cell membrane phospholipids, fatty acids can increase drug lipophilicity and permeability through intestinal mucosa, and promote the association of drugs with their receptors. In this article, current advances in research on the modifcation of protein and peptide drugs with fatty acids were reviewed.
protein and peptide drug; fatty acid; modifcation
Q51; TQ464.7
A
1001-5094(2015)09-0651-08
接受日期:2015-07-08
项目资助:国家高技术研究发展计划(863计划)资助项目(2012AA022108);长江学者和创新团队发展计划(IRT1166);国家自然科学基金(3130642)
*通讯作者:罗学刚,副教授;
研究方向:生物技术药物及益生菌微生态制剂的研究与开发,肿瘤表观遗传与转录调控机制;
E-mail:luoxuegang@hotmail.com
