多肽类药物的研究进展
2015-11-24王克全徐寒梅
王克全,徐寒梅
(中国药科大学多肽药物创制工程研究中心,江苏 南京 211198)
多肽类药物的研究进展
王克全,徐寒梅*
(中国药科大学多肽药物创制工程研究中心,江苏 南京 211198)
多肽在包括细胞增殖分化、免疫防御、肿瘤病变等在内的生命活动过程中起着至关重要的作用。自1953年首个人工合成的具有生物活性的多肽问世至今,全球上市的多肽药物有80多个,有大量多肽药物进入临床研究。多肽类药物具有独特的优势:活性显著、特异性强、毒性较弱,在体内不易产生蓄积,与其他药物的相互作用比较少。综述了目前国内外多肽药物的发展情况,希望对从事多肽类药物研发的同行有所帮助。
多肽类药物;市场;临床研究
自1953年Robert Bruce Merrifield合成第一个具有生物活性的多肽起,多肽类药物的研究发展迅猛,国际上甚至还开展了针对多个受体的多肽类药物的研究。多肽合成技术的成熟,进一步加快了多肽类药物的发展速度,尤其在1990—2000年,出现了大幅度的增长,多肽药物的靶点不断增多、适应证更广泛、合成长度可超过50个氨基酸、成本大大降低。本文就多肽发展的现状以及未来趋势进行简要概述。
1 多肽类药物简介
多肽一般是指少于100个氨基酸通过肽键连接而成的化合物,其相对分子质量低于10 000。多肽类药物在治疗肿瘤、糖尿病、心血管疾病、肢端体肥大症、骨质疏松症、胃肠道疾病、中枢神经系统疾病、免疫疾病以及抗病毒、抗菌等方面具有显著的疗效[1],已在全球批准上市的多肽药物共有80余种,其中抗肿瘤药物17种,糖尿病治疗药物7种,感染与免疫治疗药物16种,血管与泌尿治疗药物9种,其他药物31种(见表1)[2]。
1.1 多肽药物的来源
目前,多肽药物共有3种获取途径,分别是:①基因重组多肽;②化学合成多肽;③从天然生物中提取的多肽。我国在进行多肽药物申报过程中,根据其来源不同,分别按照生物制品、化学药物及生化药物划分,目前多数多肽药物以化学合成为主。
1.2 多肽药物的作用靶点
目前多肽药物的主要作用靶点是G蛋白偶联受体(GPCRs)[3],在临床研究中有39%多肽药物靶向GPCRs,GPCRs包括GLP-1受体和GLP-2受体、趋化因子4受体、阿片类受体、生长素受体、黑素皮质素受体、催产素受体等。其他靶点还有细胞因子受体超家族和利钠肽受体家族。随着生物技术的发展,多肽的作用靶点逐渐增加,如细胞表面黏附因子、通道分子、酶、缝隙连接蛋白等。针对这些不同靶点开发的多肽药物逐年增加。
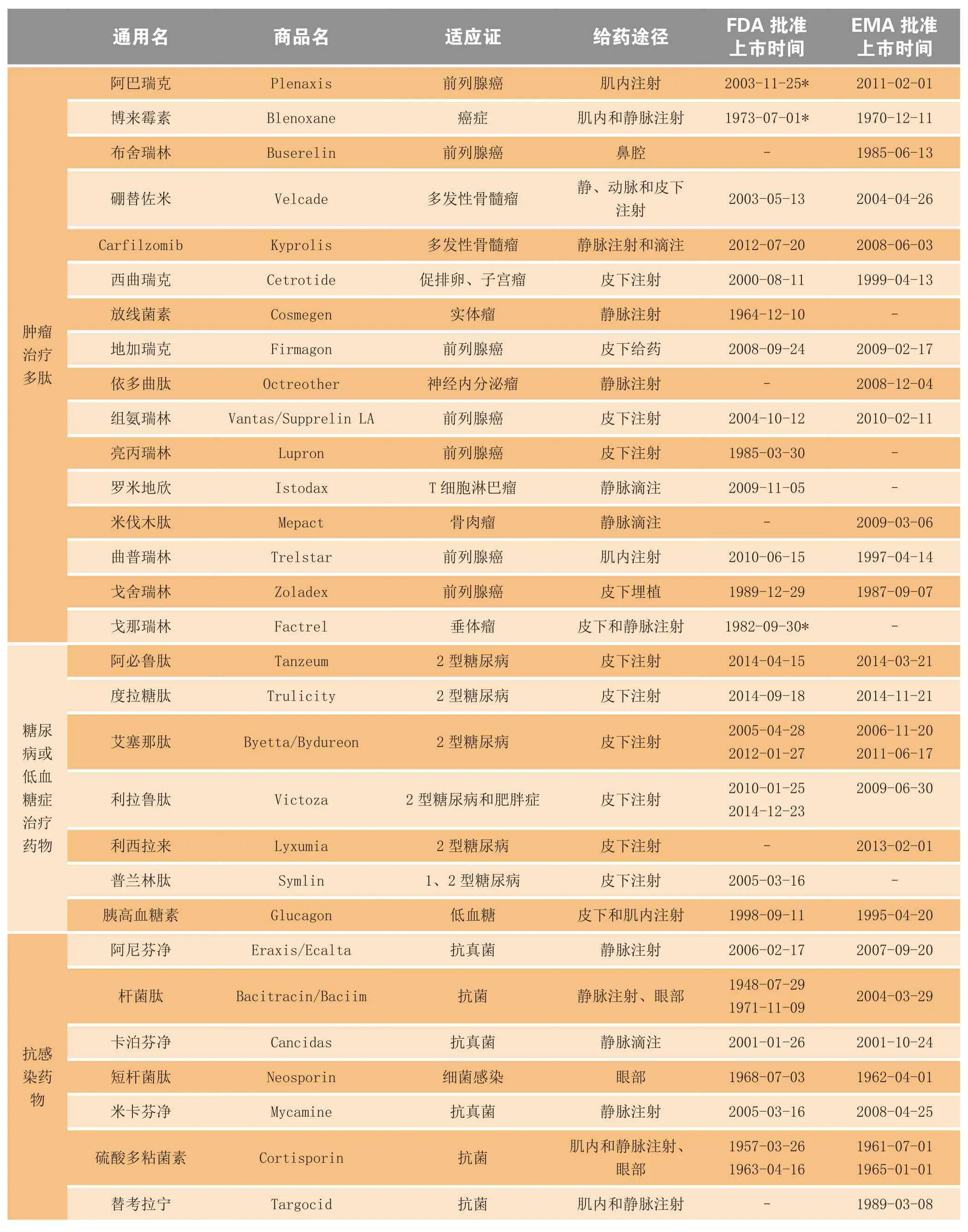
表1 全球上市的多肽类药物Table 1 Peptide drugs in the global market
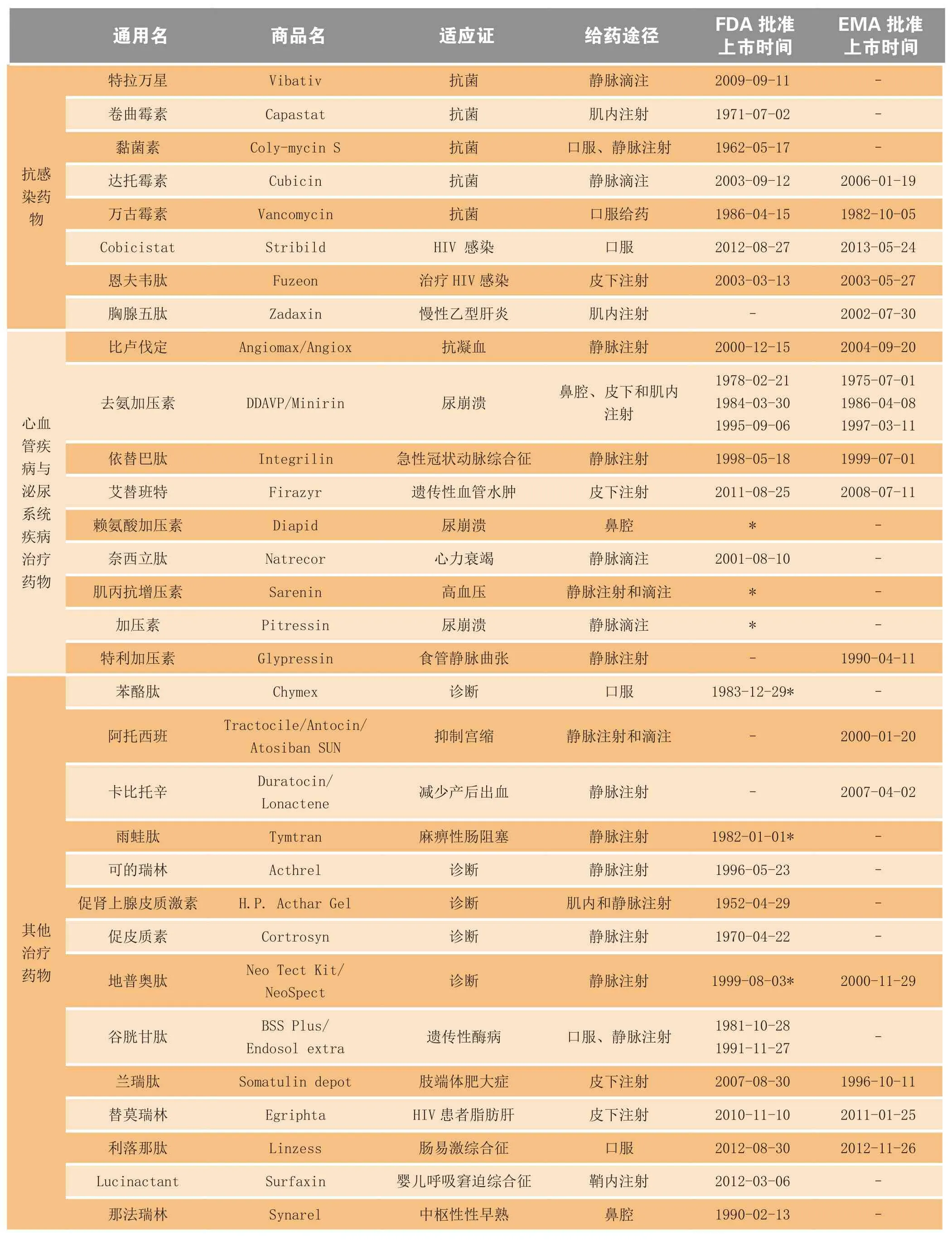
续表1
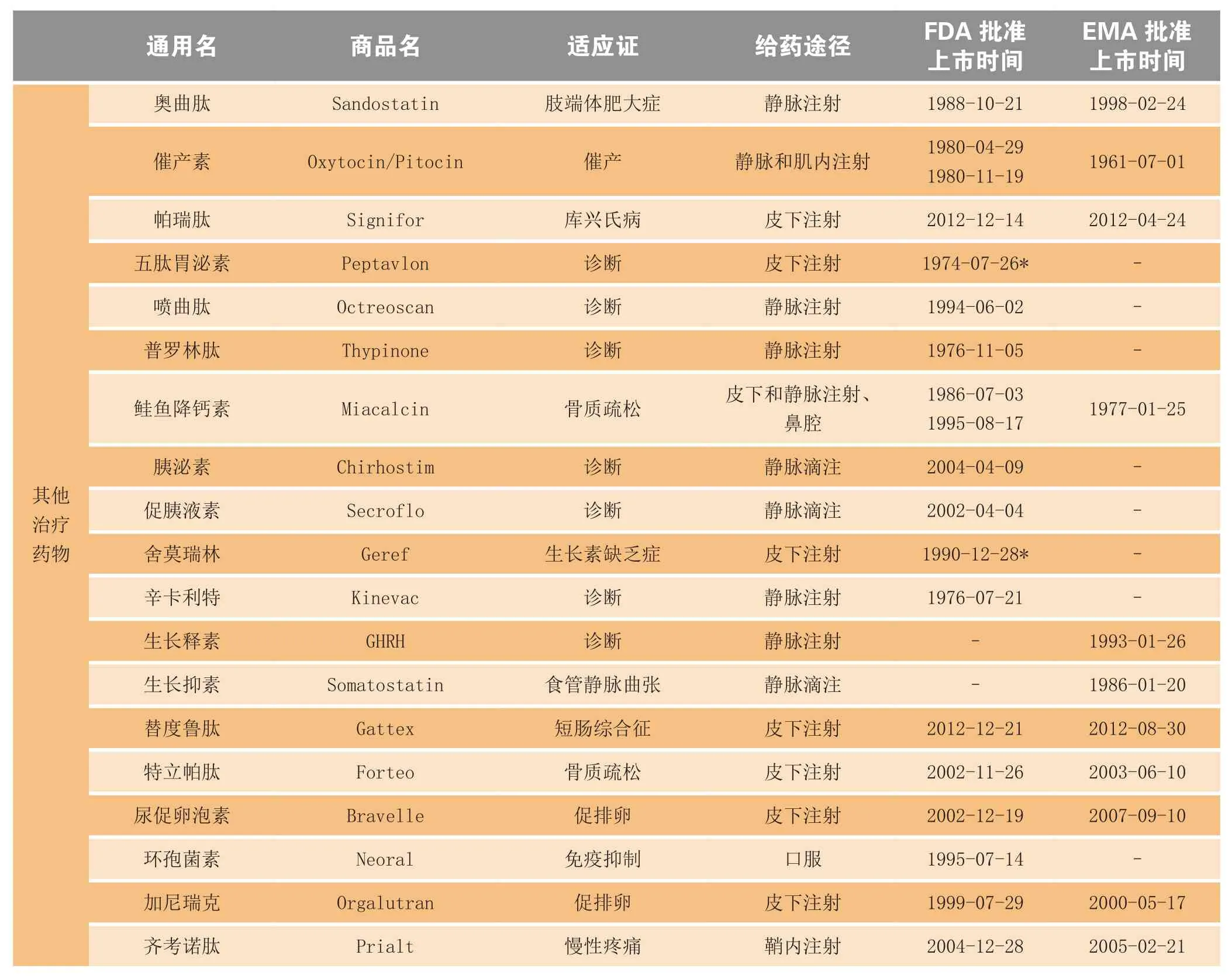
续表1
1.3 多肽药物的优缺点
多肽药物的成药性高于一般化学药物,其生物活性高,特异性强,毒性反应相对较弱,在体内不易产生蓄积,与其他药物的相互作用比较少,与体内受体的亲和性比较好。鉴于此,许多医药企业加大了多肽药物的研发力度,特别是在肿瘤及糖尿病治疗领域,已有多个多肽药物上市,并取得了巨大的经济效益。
多肽药物虽然具有独特的优势,但与小分子化学药物相比,也有不足之处:即多肽分子的稳定性较差,在体内容易被降解,因而半衰期较短,需要连续给药以维持其药效,给患者带来不便。目前,经过科学家多年的努力,针对多肽药物容易降解的现象,已有多种方法可以有效延长其体内半衰期。
1.4 延长多肽分子半衰期的方法
一般多肽分子的血浆半衰期较短,从而使其应用受到限制。经过科学家多年的努力,目前已建立了一系列成熟的方法来延长多肽分子的半衰期。第一种方法是改变多肽的结构:从源头开始进行多肽链的设计,在保证药效的前提下,用其他的氨基酸替代易被酶切割的氨基酸;或者是增强多肽分子二级结构,保护切割位点,如形成环肽[3]。第二种方法是对多肽进行修饰,国际上用聚乙二醇(PEG)修饰多肽的技术已经非常成熟,已有多个蛋白多肽类药物经过修饰后成功上市,如PEG修饰干扰素[4-5]。第三种方法:多肽与白蛋白[人血清白蛋白(HSA)或牛血清白蛋白(BSA)]结合,如白蛋白与白细胞介素-2的融合蛋白;多肽与外源性或内源性HSA偶联,如艾塞那肽与HSA形成重组白蛋白CJC-1134-PC,其皮下注射给药的半衰期为8 d[6];通过基因工程,使多肽与人免疫球蛋白的Fc片段形成融合蛋白[7],例如度拉糖肽,成人每周注射1次。使用其他修饰方法也可以改变多肽半衰期,如脂肪酸衍生物地特胰岛素注射液[8]。改变多肽的剂型也是一种有效改善多肽半衰期的方法,如治疗晚期前列腺癌的醋酸组氨瑞林植入剂,将其原来每天给药1次延长到12个月给药1次[9]。
2 多肽药物新剂型与给药途径
传统的多肽药物由于其室温下不稳定、在体内容易被降解的特点,在应用时大部分为注射剂,特别是静脉注射或静脉滴注为主,主要制剂类型为冻干粉。近年来,随着各种递药系统的发展,研究人员开发了多肽药物多种不同的制剂类型,呈现出多种给药途径。
2.1 多肽剂型
目前上市的多肽药物制剂有微球、埋植剂、脂质体微乳纳米粒等。
微球:微球包括缓释微球与原位微球。其中,缓释微球是将多肽药物溶解或分散于高分子材料中形成的微小球状实体。例如,曲普瑞林是第一个上市的缓释多肽微球制剂,缓释周期可达一个月。原位微球制剂是将生物可降解的聚合物与多肽药物制成注射液,给药后,聚合物会随着溶剂的扩散而固化,形成微球,达到控制释药的作用。例如亮丙瑞林缓释注射液(商品名:Eligard),6个月注射给药1次。
埋植剂:埋植剂可分为两大类,即天然聚合物(如明胶、葡聚糖等)与合成聚合物[如聚乳酸(PLA)]。临床上的多肽药物埋植剂有戈舍瑞林植入剂,28 d给药1次。
脂质体:多肽药物被包封在磷脂双分子层内所形成的脂质体制剂可以提高药物的稳定性,且具有生物相容性好及免疫原性低的优点。最新研发的脂质体有PEG修饰长循环脂质体、柔性脂质体、免疫脂质体等。例如,以聚丙烯酸酯脂质体包裹胰岛素,口服该制剂后,胰岛素药效明显增强[10]。
微乳:疏水性多肽主要是分布在水包油(O/W)型微乳的分散相,亲水性多肽的制剂为油包水(W/O)型,后者居多。研究人员用微乳包裹多肽,使多肽免受胃酸中酸性物质以及酶的影响,从而提高多肽的稳定性,延长其半衰期。例如,将环孢素制成微乳剂后,其口服生物利用度明显提高。
纳米粒:纳米载药系统具有一定的靶向性,并且可以保护多肽药物,使其不接触到蛋白酶,从而延长多肽药物的半衰期。纳米粒一般分为2种——聚合物纳米粒与固体脂质纳米粒。RGD多肽易在体内被清除,在实体瘤模型动物中进行的研究表明,壳聚糖纳米粒作为RGD多肽的载体,可以有效延长RGD多肽在体内作用的时间,增强其抑制血管增生的活性,从而达到抗肿瘤的最佳效果[11]。
2.2 多肽给药途径
多肽药物给药途径分为两种:注射给药与非注射给药,前者包括静脉注射、皮下注射、肌内注射,后者包括口腔、鼻腔、眼部、舌下、经皮、肺部、直肠、阴道给药等[12-13]。
相对于其他给药方式,患者更倾向于口服给药,但由于多肽分子的口服生物利用度低[14],所以大部分还以注射给药为主。目前有少数多肽药物为口服给药,如杆菌肽、环孢菌素、利那洛肽等,这些药物的多肽结构较为稳定,多为环肽。鼻腔给药方式简单,且鼻腔内毛细血管丰富,上皮细胞具有主动吸收功能,故鼻腔给药成为理想的给药途径之一。临床使用的鼻腔给药多肽制剂以鼻喷雾剂为主,如降钙素、布舍瑞林等。随着新一代吸收促进剂(烷基糖、PEG修饰的脂肪酸等)的出现,新的多肽药物鼻腔给药制剂被研发出来,部分已经进入了临床试验[15-16]。
肺部因其表面积大、毛细血管丰富,肺部给药剂型多为干粉吸入剂、定量型气雾剂。如吸入性胰岛素(Afrezza),已于2014年6月27日被FDA批准上市[17]。
由于皮肤的酶活性低,不会对药物产生降解作用,经皮给药是有潜力的给药途径,现在已有多种技术应用到临床,如离子导入技术、电致孔技术、微针技术、超声波技术。虽然多肽药物不易穿过皮肤,但通过对以上这些新技术的应用,多肽的经皮给药也有了新进展,例如多肽药物BA058为人甲状腺激素相关蛋白类似物,用于治疗骨质疏松,采用微针阵列技术,可通过角质层进入真皮,使用方便,现已进入Ⅱ期临床[18]。
3 多肽药物的设计与发现
多肽药物一级结构由氨基酸组成,可以先进行人工设计,然后通过合成及基因重组技术获得;另外,也可以从天然动植物中进行提取,获得新的多肽组分或多肽成分。
3.1 天然活性多肽的发现
从自然界存在的生命体中提取分离单一的多肽分子,通过一系列活性测定手段,筛选出具有开发价值的活性多肽,是多肽药物研发初期的新药发现模式。自然界中有许多多肽分子参与了机体的代谢、生理或病理等过程,根据这些自然存在的现象也可以发现多肽的药用开发价值。例如艾塞那肽的成功上市就是很好的例子——胰高血糖素样肽-1(GLP-1)可抑制胃排空,减少肠蠕动,故有助于控制摄食,减轻体重,但其在体内的半衰期只有几分钟,由此引发GLP-1类似物的研发热潮,经过不懈努力,人们成功研制了艾塞那肽,该多肽药物作为糖尿病治疗药物成功上市。
3.2 基于肽库的多肽药物发现
利用化学降解或蛋白酶水解对一些天然蛋白质进行降解后,就会有大量的多肽片段产生,可以从中筛选出具有活性的多肽。另外,构建生物合成肽库包括噬菌体肽库、细胞表面呈现肽库、以真核细胞为载体的肽库,可以从中筛选先导多肽分子。随着合成技术的不断成熟,目前很容易进行化学合成多肽库的构建及多肽药物筛选,此类肽库可以通过随机合成一定长度的多肽而组建,成本低、速度快。
3.3 基于蛋白质功能区域的多肽药物研发
蛋白质发挥其功能时,有时仅需其部分功能区域,并不需要全部序列,通过基因敲除或者仅合成多肽功能片段的方式,也可发挥药效,从而避免了基因工程表达蛋白质的工艺繁琐以及高成本、难纯化等缺点。例如,内皮抑制素可以抑制血管的增生,从而起到抗肿瘤、抗类风湿性关节炎的作用,根据内皮抑制素的功能片段,Xu等[19]研制出多肽HM-3,其具有抑制血管增生的功能,临床前研究表明本品具有较好活性,目前其已进入Ⅰ期临床研究阶段。
3.4 基于分子设计和修饰的多肽药物研发
多肽药物的研发及多肽先导化合物的发现,仍是一项耗资巨大、风险较高的工程。近年来,以各种理论计算方法和分子模拟技术为基础的计算机辅助设计在各种多肽药物的研究开发中得到广范应用。例如,抗艾滋病药物西夫韦肽是一种人类免疫缺陷病毒(HIV)膜融合蛋白抑制剂,依据HIV膜融合蛋白gp41的空间结构进行全新设计和合成的药物。Ⅰ期、Ⅱ期临床试验结果表明西夫韦肽具有良好的抗病毒效果[20]。
4 国内外多肽药物发展状况
4.1 多肽药物相关专利
1980—2013年,国际上申请了大约有389 320件多肽相关专利。从1996年开始,每年申请的多肽专利超过10 000件,其中2003年申请专利数量高达23 690件,为历年之最。由此可见,多肽市场的发展空间非常巨大。一般药物从研发到进入市场大约为10年,国际上多肽专利申请集中在2000—2005年,预计在2010—2015年,将有多个多肽新药进入市场。这一点已得到证实,2001—2012年,已有16种多肽新药在美国、欧洲等地区上市[21]。
4.2 国际多肽药物发展现状
据统计,多肽批准上市率比小分子新化合药物高出10%。从1970年开始,每年有1个多肽药物进入临床,据不完全统计,2011年有500~600个多肽处于临床前研究阶段,至2012年,进入临床研究的多肽药物有128个,其中处于Ⅰ期临床研究阶段的有40个,Ⅱ期临床74个,Ⅲ期临床14个[22],2012年有6个多肽药物在美国、欧洲上市。
对全球多肽药物的市场进行分析可见,美国占有全球多肽药物市场的65%,欧洲占30%,主要市场在德国和英国;在亚洲,日本独占鳌头。全球多肽药物销售逐年增加,2010年多肽全球销售额超过130亿美元,占全球药物销售额的1.5%,2013年的多肽销售额为141亿美元,预计在2018年多肽药物的市值将达到254亿美元[3]。
市售多肽药物集中在代谢疾病与肿瘤领域,代谢疾病领域以2型糖尿病和肥胖症居首。北美市场是全球多肽治疗2型糖尿病与肥胖症的最大市场,亚洲是增长最快的区域。抗糖尿病多肽药物的销售额也在大幅度增加,例如治疗2型糖尿病的利拉鲁肽,2013年的全球销售额高达26亿美元。治疗肿瘤的多肽药物,如亮丙瑞林、奥曲肽、硼替佐米等多肽药物,在新药中的比例不断扩大,市场占有率高,销售额突飞猛进。另外,多肽治疗药物在罕见病领域也开始了研究与开发。
4.3 我国多肽药物研发状况
我国多肽药物开发并不晚,众所周知,第一个人工合成的胰岛素就是在我国合成的。然而,合成多肽的后续投入不够,我国早期自主研发的多肽药物,大多数是从天然生物中提取的多肽,多肽市场主要由国外龙头药企把控。我国多肽研制存在的问题是药企的多肽生产技术落后、规模小、研发能力不足、仿制力不足、创新能力弱等,例如胸腺五肽就有几十家在重复生产。
近年来,我国加大了研发力度,多肽药物开发有了长足发展,多肽品种逐渐增多,截至2011年底,在我国上市的多肽药物有20余种;目前在我国上市的仿制多肽药物和进口多肽药物也有所增加,大约有33种;目前我国在审的多肽仿制药还有约22种。
随着多肽固液相合成技术、液相合成技术的成熟以及国家相关政策的扶持,特别是重大新药创制科技重大专项的支持,国内开始有许多药企以及科研院所抓住机遇,在多肽药物研发的创新能力上不断提升,出现了包括中国药科大学、重庆前沿生物技术有限公司、南京正大天晴制药有限公司等在内的研发单位和企业推出的一类多肽药物,并已进入临床前、临床研究阶段。相信不久的将来,我国多肽药物也会进入国际市场。
5 多肽药物面临的挑战
近年来,多肽新药上市数量明显增多,但多肽药物研发仍然面临着严峻的挑战。在研发阶段,多肽自身的性质使其应用受到限制,如在体内迅速被清除、半衰期短、结构复杂等;多肽研发成本高,如固相合成的代价较高,后续纯化工作复杂;多肽以注射给药为主,患者不易接受,限制了多肽的广泛应用,因此加大力度开发多肽新剂型,可以有效解决这一问题。目前对多肽生产要求与小分子化合物要求一致,然而两者并不相同,如何给多肽设置药物标准也是亟需解决的问题。多肽研发需要各领域研发人员协同合作,才能攻克难题,推进多肽药物研发的进步。
6 多肽药物未来发展方向
随着多肽合成技术、生化和分子生物学技术的日臻成熟,多肽药物研究取得了划时代的进展,并已成为国外各医药公司新药研发的重要方向之一。如辉瑞、默克、罗氏、礼来等一些大型跨国医药巨头通过收购或自主研发的形式在该领域投入了巨资。同时,国内外也涌现出以Zealand Pharma(ZP)为代表的多肽药物研发企业。1995年至今,在通过各国药品主管部门评审的新药中,约有1/3为多肽或蛋白质药物。
未来多肽药物的发展将集中在多肽免疫、拓展多肽功能、新型多肽制剂的研究等领域。
6.1 多功能多肽药物
多功能多肽可以是针对多个适应证的多肽,也可以是将多个多肽偶联,从而发挥多种功能。例如,抗生素多肽还具有其他生物功能,包括增强机体免疫力和创伤修复的功能;多肽偶联方面的应用很多,目前研究得较多的是GLP-1多功能受体激动剂,将GLP-1分别与GLP-2、胰高血糖素(GCG)、缩胆囊素、促胰岛素(GIP)相连接形成新的分子,这方面临床实验已经取得了实质性的进展,例如Zealand Pharma和礼来公司分别研发的GLP-1-GCG双受体激动剂ZP2929和GLP-1-GIP双受体激动剂MAR709已分别进入Ⅰ期和Ⅱ期临床研究阶段。已上市的多功能多肽药物有阿必鲁肽、利拉鲁肽,处于Ⅲ期临床研究阶段的有礼来公司研发的多肽偶联物TT401[23]。
6.2 细胞穿透肽
传统的多肽药物由于本身的理化性质特点,很难跨越细胞膜;而细胞穿透肽是一类以非受体依赖方式,非经典内吞方式直接穿过细胞膜进入细胞的多肽,例如1型人免疫缺陷病毒转录激活因子TAT(HIV-1 TAT)是第一个被发现的细胞膜穿透肽,其进入细胞的方式是高效的,且对细胞无毒性作用[24]。细胞穿透肽可以介导小分子、核酸、多肽、蛋白质进入胞内,增强其吸收。
6.3 多肽与其他药物偶联
多肽可以与小分子、寡核糖核苷酸、抗体等分子偶联,偶联物的药效、安全性、靶向性得到进一步提高。在肿瘤治疗领域,已有20多种多肽偶联分子进入临床试验。例如,将抗CD-22单克隆抗体与促凋亡多肽结合,其中单克隆抗体起靶向作用,多肽则能够促进肿瘤细胞凋亡[25]。
6.4 多肽疫苗
传统疫苗分为减毒疫苗和灭活疫苗,与其相比,多肽疫苗具有价格低廉、安全性高、特异性强等优点,且多肽疫苗完全由人工合成,不存在毒力回升或灭活不完全的现象,且不易引发过敏性反应。截至2014年3月中旬,进入Ⅰ期临床、Ⅱ期临床、Ⅲ期临床的多肽疫苗种类分别为270、224和12个[26]。
6.5 抗菌肽
细菌耐药性增强的问题日趋凸显,传统的抗菌药研发难度大,因此,临床上对于新型抗菌药物的需求尤为迫切。与传统的抗菌药不同,抗菌肽作用于细菌的细胞膜,导致膜通透性增大,从而杀死细菌。抗菌肽OP-452已进入Ⅱ期临床研究阶段,Magainin进入Ⅲ期临床研究阶段[27]。
6.6 抗病毒多肽
抗病毒多肽药物主要作用于病毒吸附受体以及病毒复制阶段,可以从肽库中筛选出与细胞表面受体相结合或能与病毒蛋白酶等活性位点结合的多肽,这些被筛选出来的多肽具有潜在的抗病毒作用。人类免疫缺陷病毒(HIV)易变异,耐药性强,采用从肽库中筛选出针对包膜糖蛋白gp41的多肽,有良好的抗HIV效果,如抗HIV多肽VIR-576,现已进入Ⅱ期临床研究阶段,抗HIV多肽SFT已进入Ⅲ期临床研究阶段[28]。
7 结语
总之,我国完全有能力推进多肽药物研发,使之走在世界前列。为此,需要国家在“十三五”期间全面布局和开展多肽药物综合技术研发,根据重大疾病防治和我国医药产业健康、高效发展的战略需求,通过自主创新和引进、消化、吸收、再创新相结合的方式,开展跨区域、跨部门的产学研联合攻关和国际科技合作。如此,定能解决多肽药物研究和开发过程中存在问题,如复杂结构多肽合成效率较低,以及多肽药物半衰期普遍较短等问题,从而大幅度提升我国多肽类药物研究与开发水平,不断推出创新品种,并在不久的将来在世界多肽药物领域占据一席之地。
[1]Du Q S, Xie N Z, Huang R B. Recent development of peptide drugs and advance on theory and methodology of peptide inhibitor design [J]. Med Chem, 2015, 11 (3): 235-247.
[2]D'Hondt M, Bracke N, Taevernier L, et al. Related impurities in peptide medicines [J]. J Pharm Biomed Anal, 2014, 101: 2-30.
[3]Fosgerau K, Hoffmann T. Peptide therapeutics: current status and future directions [J]. Drug Discov Today, 2015, 20 (1): 122-128.
[4]Di Bisceglie A M, Janczweska-Kazek E, Habersetzer F, et al. Effcacy of immunotherapy with TG4040, peg-interferon, and ribavirin in a phase 2 study of patients with chronic HCV infection [J]. Gastroenterology,2014, 147 (1): 119-131.
[5]Hamley I W. PEG–peptide conjugates [J]. Biomacromolecules, 2014, 15(5): 1543-1559.
[6]Sleep D. Albumin and its application in drug delivery [J]. Expert Opin Drug Deliv, 2015, 12 (5): 793-812.
[7]Mahlangu J, Powell J S, Ragni M V, et al. Phase 3 study of recombinant factor VIII Fc fusion protein in severe hemophilia A [J]. Blood, 2014,123 (3): 317-325.
[8]Chou D H, Webber M J, Tang B C, et al. Glucose-responsive insulin activity by covalent modification with aliphatic phenylboronic acid conjugates [J]. Proc Natl Acad Sci USA, 2015, 112 (8): 2401-2406.
[9]Eckstein N, Haas B. Clinical pharmacology and regulatory consequencesof GnRH analogues in prostate cancer [J]. Eur J Clin Pharmacol, 2014,70 (7): 791-798.
[10]Simões S M, Rey-Rico A, Concheiro A, et al. Supramolecular cyclodextrin-based drug nanocarriers [J]. Chem Commun (Camb), 2015,51 (29): 6275-6289.
[11]Kovalainen M, Mönkäre J, Riikonen J, et al. Novel delivery systems for improving the clinical use of peptides [J]. Pharmacol Rev, 2015, 67 (3):541-561.
[12]Bruno B J, Miller G D, Lim C S. Basics and recent advances in peptide and protein drug delivery [J]. Ther Deliv, 2013, 4 (11): 1443-1467.
[13]Lewis A L, Richard J. Challenges in the delivery of peptide drugs: an industry perspective [J]. Ther Deliv, 2015, 6 (2): 149-163.
[14]Christophersen C P, Fano M, Saaby L, et al. Characterization of particulate drug delivery systems for oral delivery of peptide and protein drugs [J]. Curr Pharm Des, 2015, 21 (19): 2611-2628.
[15]Illum L. Nasal drug delivery——recent developments and future prospects [J]. J Controlled Release, 2012, 161 (2): 254-263.
[16]Lewis A L, Jordan F, Illum L. CriticalSorbTM: enabling systemic delivery of macromolecules via the nasal route [J]. Drug Deliv Transl Res, 2013,3 (1): 26-32.
[17]Klonoff D C. Afrezza inhaled insulin the fastest-acting FDA-approved insulin on the market has favorable properties [J]. J Diabetes Sci Technol, 2014, 8 (6): 1071-1073.
[18]Lopes L B, Carvalho V F, de Lemos D P. Potential of peptide-based enhancers for transdermal delivery [J]. Curr Pharm Des, 2015, 21 (20):2814-2822.
[19]Xu H, Pan L, Ren Y, et al. RGD-modifed angiogenesis inhibitor HM-3 dose: dual function during cancer treatment [J]. Bioconjug Chem, 2011, 22 (7): 1386-1393.
[20]Meng Q, Dong T, Chen X, et al. Pharmacokinetics of sifuvirtide in treatment-naive and treatment-experienced HIV-infected patients [J]. J Pharm Sci, 2014, 103 (12): 4038-4047.
[21]Uhlig T, Kyprianou T, Martinelli F G, et al. The emergence of peptides in the pharmaceutical business: from exploration to exploitation [J]. EuPA Open Proteomics, 2014, 4: 58-69.
[22]Kaspar A A, Reichert J M. Future directions for peptide therapeutics development [J]. Drug Discov Today, 2013, 18 (17): 807-817.
[23]Gault V A, Bhat V K, Irwin N, et al. A novel glucagon-like peptide-1(GLP-1)/glucagon hybrid peptide with triple-acting agonist activity at glucose-dependent insulinotropic polypeptide, GLP-1, and glucagon receptors and therapeutic potential in high fat-fed mice [J]. J Biol Chem,2013, 288 (49): 35581-35591.
[24]Copolovici D M, Langel K, Eriste E, et al. Cell-penetrating peptides:design, synthesis, and applications [J]. ACS Nano, 2014, 8 (3): 1972-1994.
[25]Berguig G Y, Convertine A J, Frayo S, et al. Intracellular delivery system for antibody-peptide drug conjugates [J]. Mol Ther, 2015, 23 (5):907-917.
[26]Li W, Joshi M, Singhania S, et al. Peptide vaccine: progress and challenges [J]. Vaccines (Basel), 2014, 2 (3): 515-536.
[27]Fox J L. Antimicrobial peptides stage a comeback [J]. Nat Biotechnol,2013, 31 (5): 379-382.
[28]Zhang D, Li W, Jiang S. Peptide fusion inhibitors targeting the HIV-1 gp41: a patent review (2009-2014) [J]. Expert Opin Ther Pat, 2015, 25(2): 159-173.

[专家介绍] 徐寒梅:教授,女,1966年出生,博士生导师,中国药科大学海洋药学教研室主任。海南省药物研究所顾问,中国生物化学与分子生物学学会海洋生物化学与分子生物学分会理事会理事,江苏省生物化学协会理事。多年从事抗多肽药物的研究,设计了抗肿瘤多肽安替安吉肽、AP25、EDSM等具有自主知识产权的分子,其中安替安吉肽具有安全性高、动物体内活性显著、不易引发耐药性等优点,现已获得1.1类化学新药临床批件。近5年在国内外发表学术文章50余篇,其中SCI收录20篇,主编及参编论著各一部,主编教材一部;申请发明专利共28项(其中国际专利8项)。近5年以来,先后主持了由国家自然科学基金、国家“863”高科技发展计划、国家“重大新药创制”科技重大专项等资助的项目。因与企业合作抗肿瘤多肽研究的卓著成果获得内蒙古自治区“杰出创新引进人才”奖和“草原英才”;先后获得江苏省“青蓝工程”优秀骨干教师、中青年学术带头人、南京市领军人才等奖励和称号;被内蒙古自治区政府聘为科技特派员,被教育部“蓝火工程”聘为泰州市科技特派员。
Advances in Research on Polypeptide Drugs
WANG Kequan, XU Hanmei
(The Engineering Research Center of Peptide Drug Discovery and Development, China Pharmaceutical University, Nanjing 211198, China)
Polypeptide plays a vital role in various living processes, such as cell proliferation and differentiation, immune defense and tumor formation. Since the emergence of the frst synthesized active polypeptide in 1953, there have been more than 80 peptide drugs reaching the global market and still more proceeding into clinical development. Peptide drugs are characterized by high effectiveness and specifcity, less toxicity, very low tendency to accumulate in the body and little interaction with other drugs. The current development of peptide drugs in China was reviewed in this article, so as to provide
for researchers engaged in R&D of peptide drugs.
polypeptide drug; market; clinical research
Q51; TQ464.7
A
1001-5094(2015)09-0642-09
接受日期:2015-07-03
*通讯作者:徐寒梅,教授;
研究方向:多肽类药物研究与开发;
Tel:025-86185437;E-mail:13913925346@126.com
